lncRNA CASC2靶向miR-217对过氧化氢诱导的心肌细胞凋亡及氧化应激的影响
周亚南 张建新 杜巍 胡大军 钟敏
心肌细胞损伤与多种心血管疾病的发生发展有关,其损伤与心肌细胞凋亡及氧化应激密切相关[1-2],长链非编码RNA(lncRNA)可参与调控心肌细胞损伤[3-4]。LncRNA 癌易感性候选基因2(CASC2)通过调节微小RNA(miRNA)-144-3p/水通道蛋白1(AQP1)轴,减少肺上皮细胞凋亡,改善急性肺损伤[5]。在脂多糖刺激的人肾小管上皮HK-2 细胞中,CASC2 可以增加细胞活性,抑制炎性因子分泌、细胞凋亡和氧化应激,改善急性肾损伤[6]。CASC2 通过miR-133b/叉头框蛋白p1(FOXP1)轴调节人肾小球系膜细胞的增殖、细胞外基质积累和氧化应激[7]。上述研究提示CASC2具有抑制细胞凋亡和氧化应激、减轻细胞损伤的作用。研究表明,敲低miR-217 可减轻H9c2 细胞的心肌缺氧/复氧损伤[8],改善氧葡萄糖剥夺和复氧诱导的神经元损伤[9]。过表达miR-217 可加重缺氧诱导的H9c2 细胞损伤[10],而生物学预测软件显示miR-217 与CASC2 有靶向结合位点。本研究探讨CASC2 能否通过调控miR-217 影响心肌细胞凋亡和氧化应激。
1 材料与方法
1.1 材料
H9c2 细胞购自无锡欣润生物科技有限公司;DMEM 培养基购自上海高创化学科技有限公司;过氧化氢、四甲基偶氮唑盐比色法(MTT)试剂盒、凋亡检测试剂盒购自上海经科化学科技有限公司;实时荧光定量聚合酶链反应(qRT-PCR)试剂盒购自北京拜尔迪生物技术有限公司;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、乳酸脱氢酶(LDH)试剂盒购自南京建成生物工程研究所。
1.2 细胞处理与分组
用DMEM 培养基培养H9c2 细胞,取对数生长期细胞并分组。模型(Model)组:用300 μmol/L过氧化氢处 理H9c2 细胞。Model+pcDNA 组、Model+pcDNA-CASC2 组:将空载体(pcDNA)、过表达CASC2 载体(pcDNA-CASC2)分别转染至H9c2 细胞后再用300 μmol/L 过氧化氢处理。Model+anti-miR-NC 组、Model+anti-miR-217组:将抑制物对照(anti-miR-NC)、miR-217 抑制物(anti-miR-217)分别转染至H9c2 细胞后再用300 μmol/L 过氧化氢处理。Model+pcDNA-CASC2+miR-NC 组、Model+pcDNA-CASC2+miR-217 组:将pcDNA-CASC2 分别与miR-NC、miR-217 共转染至H9c2 细胞后再用300 μmol/L 过氧化氢处理。对照组:正常培养的H9c2 细胞。各组细胞培养48 h。
1.3 qRT-PCR检测CASC2和miR-217的表达水平
提取各组细胞总RNA,参照逆转录试剂盒合成cDNA 模板,以cDNA 模板按荧光定量试剂盒说明进行PCR,相对表达水平用2-△△Ct法计算。CASC2 和miR-217 分别以GAPDH 和U6 为内参,CASC2 上游引物序列为5'-TACAGGAC AGTCAGTGGTGGTA-3',下游引物序列为5'-AC ATCTAGCTTAGGAATGTGGC-3';miR-217 上游引物序列为5'-CGCAGATACTGCATCAGG AA-3',下游引物序列为5'-CTGAAGGCAATGCA TTAGGAACT-3'。
1.4 MTT检测细胞增殖
细胞培养48 h,每孔加入20 μL MTT 溶液,孵育4 h 后加入二甲基亚砜(DMSO)反应10 min,用酶标仪检测490 nm 处检测吸光度(OD)值。
1.5 流式细胞术检测细胞凋亡
细胞培养48 h,加入10 μL Annexin V-FITC、5 μL PI,避光孵育10 min;用流式细胞仪检测细胞凋亡率。
1.6 Western blot法检测Bax、Bcl-2蛋白表达水平
提取细胞总蛋白,定量后取50 μL 蛋白样品进行10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转至PVDF 膜,封闭后加入Bax、Bcl-2 一抗(稀释1 ∶800)4 ℃过夜,加入二抗室温培养1 h,加入化学发光试剂显影,以GAPDH 为内参分析蛋白条带灰度值。
1.7 试剂盒检测细胞SOD活性、MDA含量和培养液中LDH水平
细胞培养48 h 后收集各组细胞及细胞培养上清液,按试剂盒说明书检测细胞SOD 活性、MDA含量和培养液中LDH 水平。
1.8 双荧光素酶报告实验
构建CASC2 的野生型(WT-CASC2)和突变型(MUT-CASC2)荧光素酶载体,将其分别与miRNA 对照(miR-NC)和miR-217 共转染至心肌细胞中,按照说明书检测荧光素酶活性,以萤火虫荧光素酶报告基因活性值为参照,计算心肌细胞荧光素酶活性值。
1.9 统计学分析
用SPSS 20.0 软件进行统计学分析,符合正态分布的计量资料用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 CASC2对过氧化氢诱导的心肌细胞损伤的影响
与对照组相比,Model 组心肌细胞中CASC2 mRNA 表达水平和Bcl-2 蛋白表达水平降低,miR-217 和Bax 蛋白表达水平升高,心肌细胞活性、SOD 活性降低,凋亡率、MDA 含量和LDH 水平升高(P均<0.05);与Model组和Model+pcDNA组相比,Model+pcDNA-CASC2 组心肌细胞中CASC2 mRNA 表达水平和Bcl-2 的蛋白表达水平升高,miR-217 和Bax 蛋白表达水平降低,心肌细胞活性、SOD 活性升高,凋亡率、MDA 含量和LDH 水平降低(P均<0.05)。见图1、表1、表2。
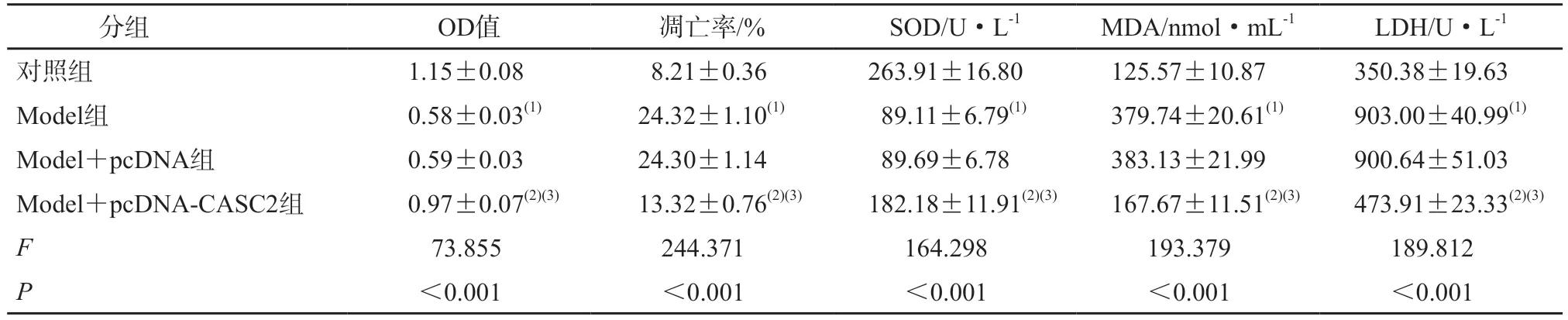
表2 CASC2对过氧化氢诱导心肌细胞OD值、凋亡率及氧化应激的影响(n=3)
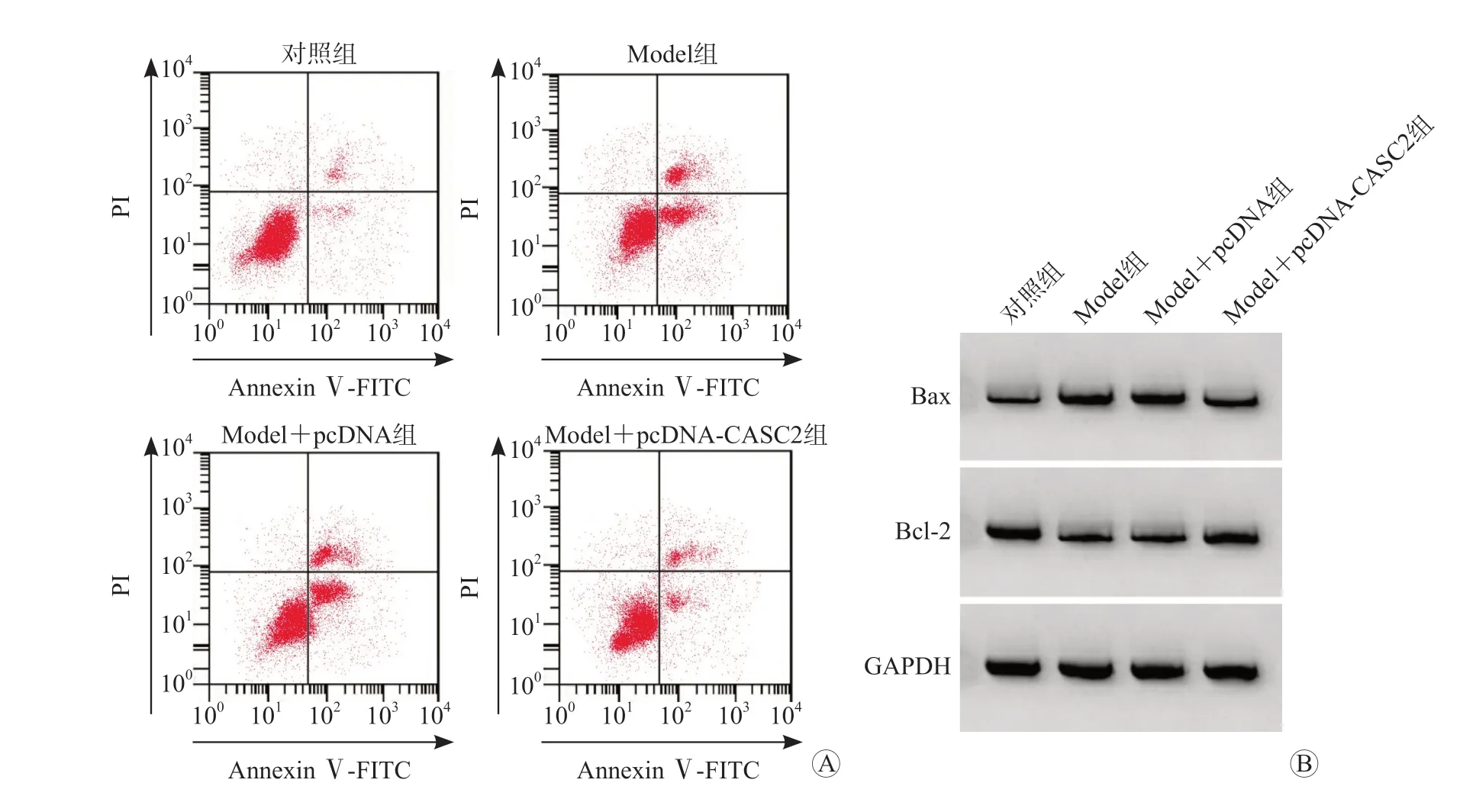
图1 CASC2对过氧化氢诱导的心肌细胞凋亡的影响
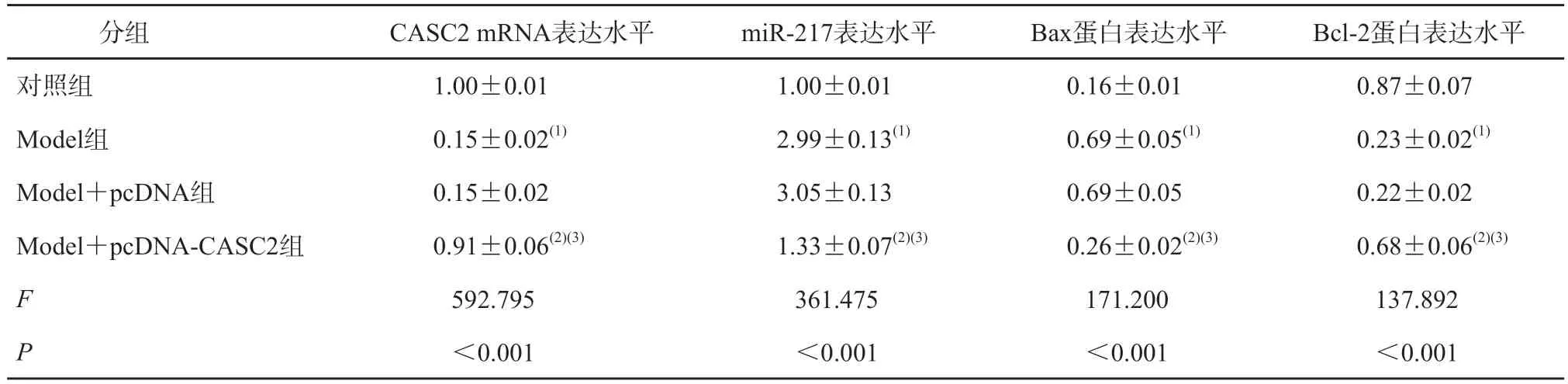
表1 上调CASC2表达对心肌细胞CASC2、miR-217及凋亡相关蛋白表达的影响(n=3)
2.2 CASC2靶向miR-217
CASC2 和miR-217 存在互补的核苷酸序列,见图2。miR-217 与WT-CASC2 共转染的心肌细胞荧光素酶活性降低,而miR-217 与MUT-CASC2共转染的心肌细胞荧光素酶活性无显著变化,见图2、表3。
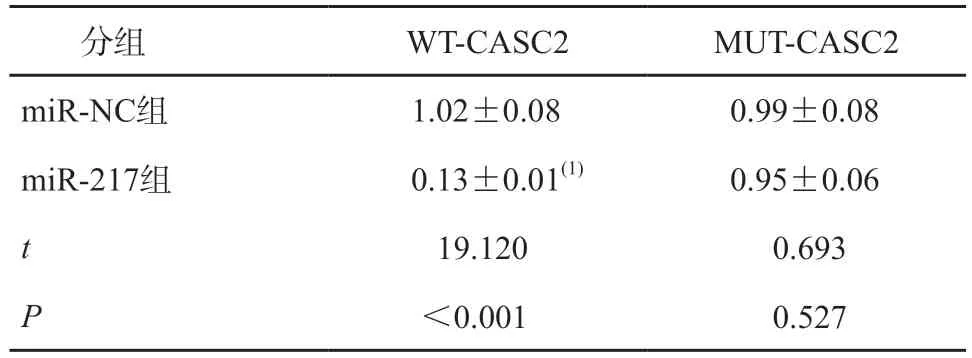
表3 miR-NC或miR-217与WT-CASC2及MUT-CASC2共转染心肌细胞后双荧光素酶活性比较(n=3)

图2 CASC2和miR-217的互补序列
2.3 抑制miR-217对过氧化氢诱导的心肌细胞损伤氧化应激的影响
与Model 组和Model+anti-miR-NC 组相比,Model+anti-miR-217 组心肌细胞中miR-217、Bax蛋白表达水平降低,Bcl-2 蛋白表达水平升高,心肌细胞活性升高,凋亡率降低,SOD 活性水平升高,MDA 含量和LDH 水平降低(P均<0.05)。见图3、表4、表5。
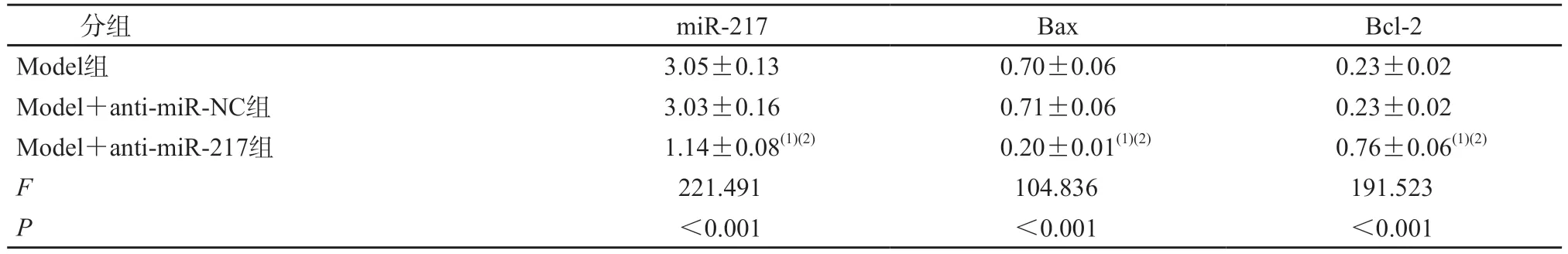
表4 抑制miR-217对过氧化氢诱导的心肌细胞miR-217及凋亡相关蛋白表达的影响(n=3)
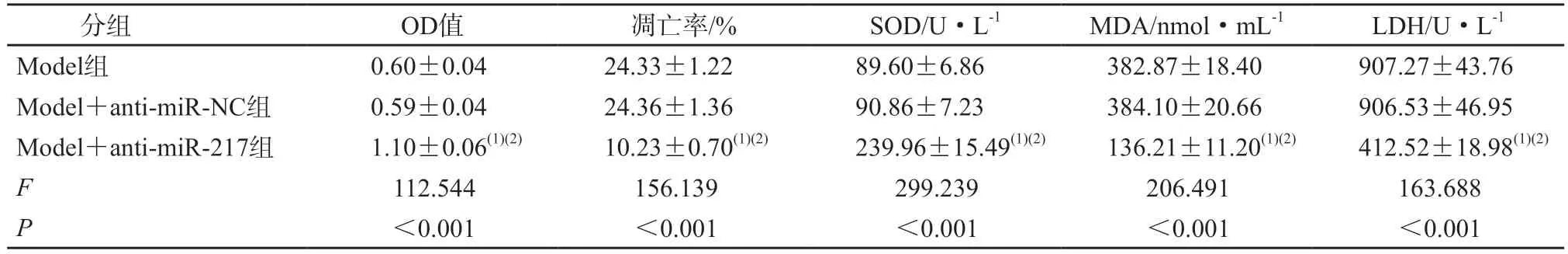
表5 抑制miR-217对过氧化氢诱导的心肌细胞OD值、凋亡率及氧化应激的影响(n=3)
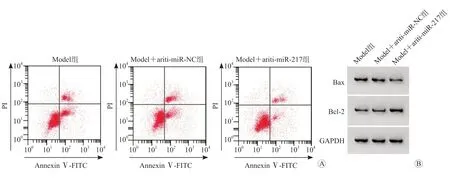
图3 抑制miR-217对过氧化氢诱导的心肌细胞凋亡的影响
2.4 miR-217可逆转CASC2对过氧化氢诱导的心肌细胞损伤的影响
与Model+pcDNA-CASC2+miR-NC 组相比,Model+pcDNA-CASC2+miR-217 组心肌细胞中miR-217、Bax 蛋白表达水平升高,Bcl-2 表达水平降低,心肌细胞活性降低,凋亡率升高,心肌细胞中SOD 活性水平降低,MDA 含量、LDH 水平升高(P均<0.05),见图4、表6、表7。

表6 miR-217可逆转CASC2对过氧化氢诱导的心肌细胞miR-217和凋亡相关蛋白表达的影响(n=3)
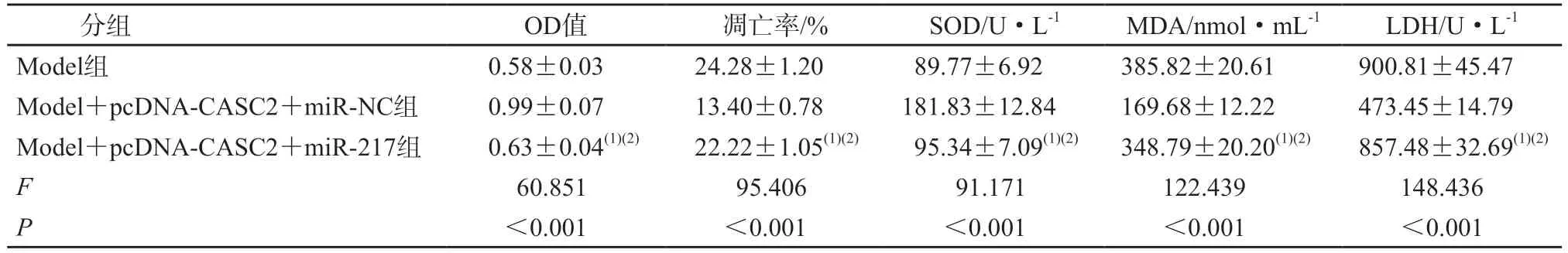
表7 miR-217可逆转CASC2对过氧化氢诱导的心肌细胞OD值、凋亡率及氧化应激的影响(n=3)

图4 miR-217可逆转CASC2对过氧化氢诱导的心肌细胞凋亡的影响
3 讨论
研究表明过氧化氢可进入细胞形成自由基,造成细胞损伤[11]。因此,本实验采用过氧化氢处理心肌细胞建立损伤模型,结果发现心肌细胞活性降低,凋亡率升高,SOD 活性降低,MDA 含量、LDH 水平升高。SOD、MDA、LDH 是氧化应激相关因子,其水平异常影响氧化应激的发生[12],上述结果表明本研究成功建立心肌氧化损伤模型。
研究报道CASC2 通过调控miR-194-5p/陷窝蛋白-1(CAV1)轴减轻小鼠和细胞模型中高氧诱导的肺损伤[13]。CASC2 还可通过调节miR-9-5p/过氧化物酶体增殖物激活受体γ 轴提高细胞活性并抑制细胞凋亡,从而减轻高糖诱导的人足细胞损伤[14]。本研究中,过氧化氢诱导心肌细胞中CASC2 表达降低,过表达CASC2 后心肌细胞活性升高,凋亡率降低,SOD 活性升高,MDA 含量、LDH 水平降低,表明过表达CASC2 可抑制过氧化氢诱导的心肌细胞凋亡和氧化应激。
研究发现,慢性心力衰竭患者心脏中的miR-217 表达水平增加,miR-217 可促进心肌肥大和心功能障碍[15]。抑制miR-217 可降低柯萨奇病毒B3感染所致心肌炎中MDA 含量降低,SOD 活性增加[16]。下调miR-217 可抑制1-甲基-4-苯基吡啶离子(MPP+)诱导的人神经母细胞瘤SH-SY5Y细胞凋亡和氧化应激[17]。本研究显示,过氧化氢诱导的心肌细胞中miR-217 表达水平升高,抑制miR-217 表达可抑制过氧化氢诱导的心肌细胞凋亡和氧化应激。本研究还发现,CASC2 靶向调控miR-217,miR-217 可逆转CASC2 对过氧化氢诱导的心肌细胞凋亡及氧化应激的影响。
综上所述,过表达CASC2 通过靶向miR-217抑制过氧化氢诱导的心肌细胞凋亡及氧化应激。

