血凝集素样氧化型低密度脂蛋白受体-1在氧化型低密度脂蛋白诱导的巨噬细胞氧化应激中的作用
智丽霞 王康 殷利茜 马茴煌 李姚娜 杨慧宇
氧化应激是机体活性氧(ROS)产生过多或抗氧化能力下降,氧化系统与抗氧化系统平衡紊乱的病理生理过程。大量的ROS 使低密度脂蛋白(LDL)发生氧化修饰,形成氧化型低密度脂蛋白(ox-LDL)。血凝素样氧化型低密度脂蛋白受体1(LOX-1)是ox-LDL 在血管内皮细胞上的主要受体,在巨噬细胞中也有表达,可介导ox-LDL 对血管内皮细胞的损伤,参与动脉粥样硬化的发生过程[1]。还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)产生的O2-与LDL 相互作用引起LDL 氧化,产生ox-LDL,这可能是泡沫细胞吞噬ox-LDL 的主要来源[2],ROS 在血管性疾病的发生发展中起到重要作用,参与动脉粥样硬化、高血压、动脉瘤形成等多种病理生理过程[1,3]。本研究利用小干扰RNA(siRNA)沉默LOX-1基因,探讨LOX-1 对ox-LDL 诱导的巨噬细胞氧化应激的影响。
1 材料与方法
1.1 材料
Ox-LDL 购自中国医学科学院基础医学研究所,细胞内ROS 荧光定性检测试剂盒购自上海杰美基因医药科技有限公司,丙二醛(MDA)、超氧化物歧化酶(SOD)测试盒购自南京建成生物工程研究所,DNA 引物及荧光探针购自上海生工生物工程技术有限公司。
1.2 巨噬细胞培养及分组
将巨噬细胞无血清培养16 h,使细胞生长至对数增殖期,更换新的无血清培养液,随机分为对照组、空质粒对照组(pCon 组)、ox-LDL 组、LOX-1-siRNA+ ox-LDL 组,每组1×107个细胞。对照组单纯无血清培养不作任何处理;pCon 组为空质粒对照组;ox-LDL 组加入ox-LDL 50 mg/L 处理16 h;LOX-1-siRNA+ox-LDL 组用沉默LOX-1 效果最佳的干扰序列干预24 h 后,再加入ox-LDL 50 mg/L 处理16 h。
1.3 MDA含量检测
按照说明书,分别向离心管中加入0.1 mL 不同浓度梯度标准品及待测样本,然后分别加入0.2 mL MDA 检测工作液,轻微混匀后,100 ℃加热15 min,冷却至室温后1 000 g 离心10 min,取上清200 μL 分别加入到96 孔板中,用酶标仪测定532 nm 处吸光度,并计算各组细胞MDA 含量。
1.4 巨噬细胞SOD活性检测
将巨噬细胞移至96 孔板培养,每孔5 000~10 000 个细胞,48 h 后吸去培养液,PBS 洗涤1 次,每孔加入200 μL SOD 检测工作液,轻微震荡后,37 ℃孵育3 min。按照说明书用酶标仪测定450 nm 处吸光度,并计算各组细胞SOD 活性。
1.5 LOX-1对巨噬细胞ROS水平的影响
使用荧光显微镜及流式细胞仪检测各组细胞ROS 水平。该过程中将对照组细化为阴性对照组(正常培养细胞不加荧光探针)、正常对照组(正常培养细胞只加入荧光探针)、阳性对照组(加阳性药物H2O2在常温下培养1 h),其余分组(pCon组、ox-LDL 组、LOX-1-siRNA+ ox-LDL 组)不变。
1.6 实时定量聚合酶链反应检测巨噬细胞NOX2、p22phox的mRNA表达水平
以GAPDH 为内对照,应用实时定量聚合酶链反应(PCR)检测各组巨噬细胞内NOX2、p22phox的表达。引物序列如下:NOX2上游引物 为5'-CCTTCCTGACACCTCTCTCG-3',下游引物为5'-GAGCTCAGACCCTCACTTGG-3',预计PCR 产物片段大小为198 bp;p22phox上游引物 为5'-CAGTCCCAAGGAGAATGGAA-3',下 游引物为5'-TCTGCCATAGCTGGACAGTG-3',预计PCR 产物片段大小为207 bp;GAPDH上游引物为5'-TGAACGGGAAGCTCACTGG-3',下游引物为5'-TCCACCACCCTGTTGCTGGA-3',预计PCR 产物片段大小为307 bp。扩增条件为:预变性94 ℃2 min;94 ℃ 20 s,56 ℃ 20 s,72 ℃ 20 s,40 次循环。
1.7 Western blot法检测巨噬细胞NOX2、p22phox的蛋白表达水平
用4 ℃预冷的细胞裂解液裂解各组巨噬细胞,BCA 法测定蛋白浓度。取20 μg 总蛋白样品经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,电转移至PVDF 膜上,脱脂奶粉封闭2 h,抗NOX2、p22phox、β-actin 抗体4 ℃孵育过夜,二抗室温下孵育2 h,化学发光试剂显色,仪器自动扫描后保存图像。用ImageJ 软件分析扫描所得图像的灰度值,重复3 次,与内参蛋白β-actin 条带灰度值的比值即为该目的蛋白的相对表达量。
1.8 统计学分析
采用SPSS 26.0 软件进行统计学分析,定量资料采用均数±标准差表示;多组间比较满足正态性和方差齐性时,采用ANONA 单因素方差分析;组间两两比较采用SNK 法(q检验);组间任意两组比较采用LSD-t检验;不满足条件则采用秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 LOX-1对巨噬细胞MDA含量及SOD活性的影响
与对照组、pCon 组相比,ox-LDL 组MDA 含量明显升高,SOD 活性明显降低(P均<0.05),表明经ox-LDL 诱导的巨噬细胞氧化与抗氧化功能失衡,处于氧化应激状态。与ox-LDL 组比较,LOX-1-siRNA+ox-LDL 组MDA 含量明显降低,SOD 活性明显升高。见表1。

表1 各组细胞MDA含量及SOD活性的比较
2.2 LOX-1对巨噬细胞ROS水平的影响
荧光显微镜观察结果及流式细胞仪检测结果显示,阴性对照组巨噬细胞ROS 平均荧光强度低于其他对照组,阳性对照组巨噬细胞ROS 平均荧光强度高于其他对照组(P均<0.05),pCon 组与正常对照组相比差异无统计学意义,ox-LDL 组巨噬细胞ROS 平均荧光强度较正常对照组、pCon 组明显增强,LOX-1-siRNA+ox-LDL 组巨噬细胞ROS平均荧光强度较ox-LDL 组明显减弱(P均<0.05)。见图1、图2、表2。

表2 各组流式细胞术细胞内平均荧光强度比较

图1 荧光显微镜观察各组巨噬细胞内ROS水平(×200)

图2 流式细胞术检测各组细胞内ROS水平
2.3 LOX-1-siRNA对巨噬细胞NOX2、p22phox mRNA和蛋白表达水平的影响
与对照组、pCon 组相比,ox-LDL 组NOX2及p22phox的mRNA 和蛋白表达水平均明显升高(P均<0.05);与ox-LDL 组相比,LOX-1-siRNA+ox-LDL 组NOX2、p22phox的mRNA 和蛋白表达水平均明显下降(P均<0.05)。见图3、表3。

图3 Western blot法检测各组NOX2和p22phox蛋白表达情况
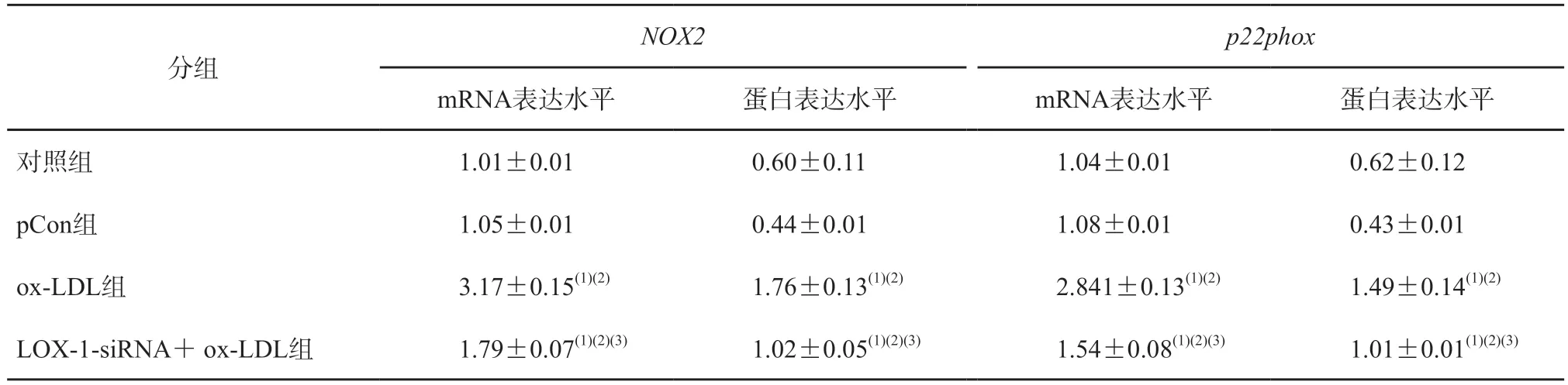
表3 各组NOX2和p22phox的mRNA和蛋白表达水平比较
3 讨论
氧化应激是机体氧化系统和抗氧化系统平衡紊乱,导致潜在损伤的病理生理过程。正常情况下,细胞中含有的SOD、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)可清除ROS,维持细胞的氧化还原自稳态[4]。当某些因素作用于机体,导致该稳态失去平衡、ROS 的产生速率大于清除速率时,大量的ROS 在体内蓄积,可使LDL 发生氧化修饰,生成ox-LDL。泡沫细胞吞噬ox-LDL 后,堆积形成动脉粥样硬化病变早期的脂质条纹,动脉管壁中氧化脂质的积累导致动脉粥样硬化病变的发生发展[5],而ROS被认为是此过程的始动因素[6]。
研究发现,小剂量ROS 可作为细胞内第二信使,在维持机体组织细胞的正常功能中发挥重要作用[7],然而在氧化应激状态时,ROS 大量蓄积并损伤核酸、蛋白质及脂质,最终导致机体可逆或不可逆的损伤[8]。SOD 是维持细胞氧化还原自稳态的关键抗氧化酶,可通过歧化ROS 终止ROS 链式反应并将其清除[9]。MDA 作为一种脂质过氧化产物,可间接反映氧化损伤的程度,是目前常用的氧化应激指标[10-11]。本研究发现,ox-LDL 诱导的巨噬细胞MDA 含量升高,SOD 活性降低,提示经ox-LDL 诱导的巨噬细胞氧化系统与抗氧化系统失衡,处于氧化应激状态。
Ox-LDL 的细胞效应主要依赖于ox-LDL 与LOX-1 受体的特异性结合,LOX-1 是介导ox-LDL进入细胞并引起胞内氧化应激的主要受体,引起内皮活化、功能失调和损伤,在动脉粥样硬化的早期能促进泡沫细胞形成,在氧化应激中发挥重要作用[12]。本研究发现,巨噬细胞经ox-LDL 处理后,ROS 平均荧光强度显著增强,而沉默LOX-1基因后再经ox-LDL 处理,巨噬细胞中ROS 平均荧光强度显著降低,表明抑制LOX-1基因表达能减少巨噬细胞ROS 的生成,LOX-1 可以影响巨噬细胞ROS的生成,从而影响巨噬细胞的氧化应激。
Ox-LDL 可以通过促进细胞内ROS 生成,激活转录活化因子(AP-1)和核因子κB(NF-κB),引发细胞凋亡,同时AP-1 和NF-κB 能进一步促进炎性反应相关产物表达,诱导单核/巨噬细胞在受损血管内膜下聚集。在单核/巨噬细胞中,NOX将电子从NADPH 转移至O2并产生O2-,进而生成ROS[13]。NOX 作为ROS 的主要来源,在斑块的形成、破裂与血栓形成中起重要作用[14-15],也是氧化还原的重要信号[16]。本研究证实,巨噬细胞经ox-LDL 处理后,NOX2、p22phox的mRNA 及蛋白表达水平明显升高,沉默LOX-1基因后再经ox-LDL 处理,NOX2、p22phox的mRNA及蛋白表达水平明下降,表明抑制LOX-1基因表达能减少巨噬细胞NOX2、p22phox的mRNA 及蛋白表达,LOX-1 可以影响巨噬细胞NOX 的表达。值得注意的是,LOX-1 不会改变未受刺激的巨噬细胞对ox-LDL 的摄取。在粥样斑块内的巨噬细胞中,促炎性细胞因子诱导LOX-1高表达,此时LOX-1 会显著增加ox-LDL 的摄取,表明在巨噬细胞中,LOX-1对ox-LDL 摄取的调节具有特异性[17]。
综上所述,本研究通过ox-LDL 诱导巨噬细胞,发现ox-LDL 与LOX-1 相互作用可激活巨噬细胞NOX,使NOX2、p22phox表达明显增加,进一步促进ROS 生成,导致氧化应激,而抑制LOX-1 可以抑制巨噬细胞的氧化应激反应,表明LOX-1 在巨噬细胞氧化应激、动脉粥样硬化发展中具有重要作用。LOX-1 是潜在的抗动脉粥样硬化靶点,其在巨噬细胞中的具体作用机制仍有待进一步深入研究。明确ox-LDL/ LOX-1 通过何种信号转导通路诱导ROS 产生,进而激活下游信号,对防控心脑血管疾病具有深远意义。

