NLRP3、AIM2 炎症小体在创伤性脑损伤中作用的研究进展
陶丙岩,刘羽阳,张泽瀚,张军
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 神经外科,北京 100853
创伤性脑损伤(traumatic brain injury,TBI)是指外力造成的脑部损伤,发生率很高,全世界每年有超过5 000 万人发生TBI[1]。依据临床发展过程,TBI 主要包括创伤导致的原发性脑损伤和继发性脑损伤,其中继发性脑损伤会引起一系列复杂事件的发生,如线粒体功能紊乱、活性氧(reactive oxygen species,ROS)生成等,继而导致神经炎症的发生,其严重程度与患者的预后息息相关[2]。目前TBI 的救治时效性已经得到了明显的提高,但治疗效果有限,TBI 患者的预后仍较差,因此深入研究TBI 的病理生理机制,寻找新的治疗靶点仍是当务之急。炎症小体作为炎症过程的重要组成部分,密切参与TBI 后继发性脑损伤的发生、发展。本文总结了NLRP3、AIM2 炎症小体在TBI中的作用机制及相关研究进展,以期为后续研究提供参考。
1 炎症小体的结构
炎症小体是主要由受体蛋白、凋亡相关斑点样蛋白(apoptosis-associated speak-like protein containing CARD,ASC) 和胱天蛋白酶前体Procaspase-1 组成的蛋白酶复合物[3]。在功能上,炎症小体通过活化Caspase-1,进而将白细胞介素1β(interleukin-1β,IL-1β) 前 体(pro-interleukin-1β,Pro-IL-1β)、白细胞介素18 前体(pro-interleukin-18,Pro-IL-18)裂解为成熟的IL-1β 和IL-18,之后将其分泌出细胞外,引起一系列炎症反应,活化的Caspase-1 也能裂解消皮素D(gasdermin D,GSDMD),导致细胞焦亡的发生[4]。
炎症小体的受体蛋白包括NOD 样受体蛋白(NOD-like receptors,NLR) 和AIM2 样受体蛋白(AIM2-like receptor,ALR)。其中NLR 主要包括NLRP3、NLRP4 和NLRC4,ALR 主要包括AIM2和IFI16。近年来研究较多的炎症小体是NLRP3和AIM2,因此下文主要就NLRP3 和AIM2 炎症小体在TBI 中的研究进展予以概述。
2 NLRP3 炎症小体
目前,NLRP3 炎症小体是研究最多的炎症小体,它由NLRP3、ASC 和Pro-caspase-1 通过蛋白-蛋白相互作用偶合而成[5]。NLRP3 炎症小体的经典激活途径包括转录和寡聚两个过程(图1,Created with BioRender.com)。1) 转录:病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)或损伤相关分子模式(damage-associated molecular patterns,DAMPs) 被细胞膜表面的Toll样受体(toll-like receptor,TLR)感知,诱导NF-κB的活化,促使NLRP3 和Pro-IL-1β 的转录[6]。2)寡聚:在K+外流、ROS 生成、组织蛋白酶释放和Ca2+内流等信号的刺激下,NLRP3 炎症小体发生寡聚反应,NLRP3、ASC 和Pro-caspase-1 开始组装并将Caspase-1 激活,进而将Pro-IL-1β、Pro-IL-18 切割加工为成熟的IL-1β 和IL-18,引起细胞焦亡和炎症反应的发生[7-8]。不同于经典激活途径,在NLRP3 的非经典激活途径中,Caspase-11 直接识别并结合脂多糖LPS,形成脂多糖-Caspase-11 炎症小体,进而切割GSDMD,生成GSDMD-C 端结构域和GSDMD-N 端结构域,其中GSDMD-N 可以导致细胞焦亡[9]。
此外,NLRP3 炎症小体的活化也存在负性调节机制,使炎症小体在未受到激活物质刺激时处于抑制状态。细胞在未受到刺激时,ASC 位于胞核内,胞质内因缺少ASC 适配器,导致炎症小体无法组装激活,从而抑制细胞焦亡和IL-1β、IL-18的成熟分泌[10]。此外,在静息巨噬细胞中,E3泛素连接酶可以与NLRP3 结合,使NLRP3 泛素化,从而抑制炎症小体的激活和炎症反应的发生[11]。
3 AIM2 炎症小体
AIM2 炎症小体也是研究较多的炎症小体,它由AIM2、ASC 和Pro-caspase-1 组成。AIM2 炎症小体的经典激活途径类似于NLRP3 的经典激活途径(图2,Created with BioRender.com),但不同于NLRP3 炎症小体,AIM2 炎症小体直接识别并结合的刺激物是胞质内的双链DNA[12-13]。因此,AIM2 炎症小体在宿主防御DNA 病毒或细菌感染时发挥着重要的保护作用。有研究报道,AIM2 炎症小体还可以通过非经典激活途径间接诱导NLRP3 炎症小体的激活,进而诱导细胞焦亡的产生以及IL-1β、IL-18 的成熟和释放[14]。
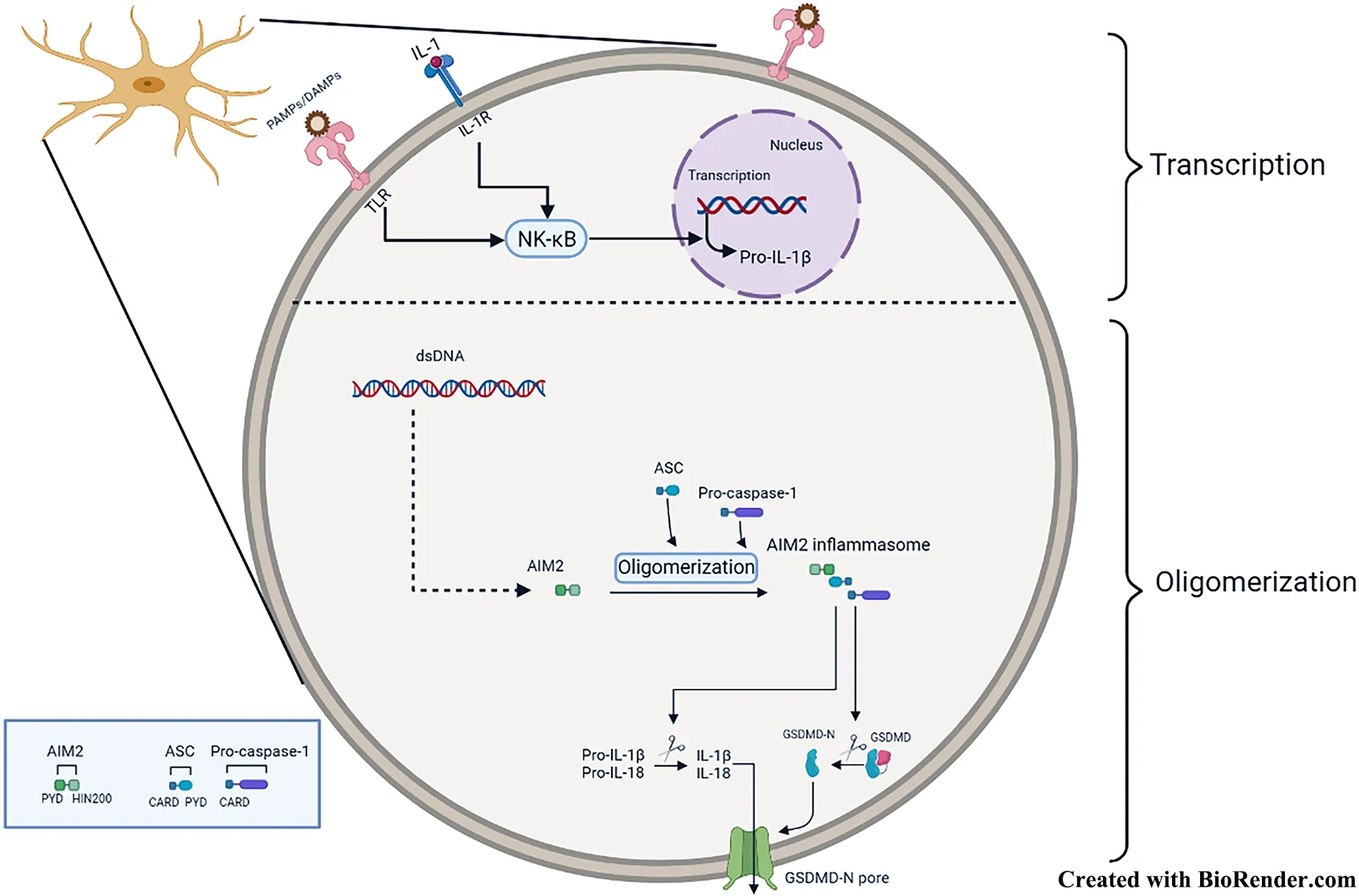
图2 AIM2 炎症小体的激活机制Fig.2 Activation mechanism of AIM2 inflammasome
此外,AIM2 炎症小体的活化虽然能在机体受到DNA 病毒或细菌感染时发挥重要保护作用,但过度活化的炎症小体也会对正常细胞造成伤害,因此,类似于NLRP3,机体也存在对AIM2 炎症小体活化的负性调节机制,使细胞在未受刺激时维持静息状态[15-16]。
4 NLRP3、AIM2 炎症小体的过度激活参与TBI的发生、发展
TBI 是一种常见的中枢神经系统损伤性疾病。越来越多证据表明,脑创伤会导致细胞损伤和组织损伤,并释放多个DAMPs,进而激活各种炎症小体参与继发性损伤和炎症反应。炎症小体,特别是NLRP3 和AIM2 的活化在继发性脑损伤和神经炎症的发生、发展过程中发挥着重要作用[17-18]。
有研究发现,在TBI 大鼠的神经元和神经胶质细胞中,NLRP3 炎症小体各组分及IL-1β、IL-18 表达均增加[19]。Chen 等[20]发现TBI 发生后NLRP3 的表达并非逐渐升高,而是随时间具有波动性变化,NLRP3 mRNA 的表达在TBI 发生后6 h内开始升高,24 h 达到高峰,在这个峰值之后,NLRP3 表达下降,在TBI 发生后3 d 达到另一个峰值,在第7 天NLRP3 减少,但其表达总是高于对照组。Kerr 等[21]发现,TBI 发生后NLRP3 升高的现象不仅出现在动物实验中,在TBI 患者的血清和脑脊液样本中ASC、Caspase-1 和IL-18 的表达亦升高。另外,有研究表明在严重TBI 患儿脑脊液中NLRP3 含量明显升高,且NLRP3 表达水平与TBI 患儿的预后呈显著负相关[22]。除了NLRP3 炎症小体,Ge 等[23]发现小鼠的AIM2 炎症小体在TBI 发生后也被激活,并介导了脑微血管内皮细胞的焦亡,加重了颅脑损伤后血-脑脊液屏障的破坏。以上结果表明,NLRP3、AIM2、ASC、Caspase-1、IL-1β、IL-18 与TBI 密切相关,可能在评估TBI 患者的严重程度和预后等方面发挥重要作用。
近年来有很多学者发现应用某些炎症小体抑制剂可减轻TBI 的组织损伤并促进神经功能恢复。Zheng 等[24]研究发现右美托嘧啶可以抑制NLRP3 炎症小体活化,改善TBI 大鼠的认知功能;Zou 等[25]研究发现白藜芦醇作为一种天然抗氧化剂,可以抑制ROS 的生成,干扰NLRP3炎症小体的活化,减轻TBI 引起的损害;Xu等[26]研究表明MCC950 作为一种特定的小分子NLRP3 炎症小体抑制剂,可以通过减少白细胞募集和IL-1β 等促炎细胞因子的生成来限制TBI 的进展,保护神经细胞。此外应用Caspase-1 抑制剂Ac-YVAD-cmk 也可以通过抑制NLRP3、AIM2 炎性小体的亚基Caspase-1 和关键的下游促炎细胞因子IL-1β、IL-18 的表达,以及阻碍GSDMD 的裂解和ASC 的寡聚来抑制TBI 后神经炎症和脑微血管内皮细胞的焦亡,从而减轻TBI 诱导的紧密连接蛋白丢失、血-脑脊液屏障损坏和脑水肿等不良并发症的程度[23]。上述研究均表明,炎症小体抑制剂在预防和治疗TBI 继发性脑损伤中存在潜在的应用价值,进一步明确了炎症小体的活化在TBI 发生、发展过程中起着重要作用。
另外,最近的研究发现敲除某些炎症小体相关基因也能达到减轻TBI 后中枢神经系统炎症的效果。Irrera 等[27]研究发现与野生型小鼠相比,在TBI 发生后24 h,NLRP3-/-小鼠的认知功能得到了明显保护,脑损伤较轻,脑溶解物中的炎症介质减少。有研究发现敲除NADPH 氧化酶2(NADPH oxidase 2,NOX2) 基因也可以通过减少ROS 的激活,抑制硫氧还蛋白相互作用蛋白与NLRP3 炎症小体的结合,从而抑制炎症小体的活化,降低IL-1β 等促炎细胞因子的表达,减轻TBI 后中枢神经系统炎症[28]。此外,Liu 等[29]发现不论在体内还是体外敲除Caspase-1 均有助于抑制TBI 后的炎症反应,改善TBI 小鼠预后。以上研究均表明,炎症小体可能是诱导TBI 炎症反应的关键因素,应用炎症小体特异性抑制剂或抑制某些炎症小体相关基因的表达可能对治疗TBI 和抑制神经炎症起关键作用。
在过去的几年中,神经炎症在神经退行性疾病发病机制中的作用越来越重要。由TBI 引起的神经炎症过程往往被认为是其他神经退行性疾病如肌萎缩侧索硬化症、阿尔茨海默病和帕金森病的危险因素,目前已经对相关生物标志物和TBI 后各种神经退行性疾病的预后生物标志物进行了广泛的研究,但结果不理想。越来越多的研究提示,NLRP3 和AIM2 炎症小体及其激活后释放的分子或许可被视为潜在的生物标志物和治疗靶点,在TBI 及其并发症的早期识别和患者预后的改善中发挥重要作用[30]。
5 结语
大量研究证实了NLRP3、AIM2 炎症小体在TBI 后引起神经细胞死亡和炎症反应中所起的核心作用。但目前对于NLRC4、Pyrin 等其他类型的炎症小体在TBI 中的研究报道相对较少,有待进一步探寻。未来的研究方向应更多关注不同炎症小体之间的交互作用以及经典激活途径与非经典激活途径之间的联系,结合炎症小体的分子结构和激活机制,进一步分析参与负性调控的相关因子和信号通路,这将有助于我们发现新的疾病干预靶点,研制出选择性更好、特异性更高的靶向药物,为TBI 后炎症的防治提供新的方向和线索,更加深入地揭示疾病的内在机制,从根本上改善TBI 患者的预后。

