白蛋白和中性粒细胞联合预后分级与晚期胃癌免疫检查点抑制剂治疗预后的关系
潘玉婷,司海燕,邓国超,闫欢,石悦,李艳艳,戴广海
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 肿瘤内科,北京 100853
胃癌(gastric cancer,GC) 是一种具有高度异质性且预后较差的恶性肿瘤[1-2]。在全球所有恶性肿瘤中,胃癌发病率位居第5,死亡率位居第4[3]。近期,一项随机对照、全球多中心、三臂设计、开放性的研究发现,晚期胃癌(advanced gastric cancer,AGC)一线使用免疫检查点抑制剂(immune checkpoint inhibitor,ICI)联合化疗可使生存获益[4]。纳武利尤单抗是目前中国首个且唯一被获批应用于晚期胃癌一线治疗的ICI[5]。但在临床实践中,我们观察到并不是所有胃癌患者接受ICI 治疗后都能获益。因此,寻找有效、实用、廉价的生物标志物识别免疫治疗可能获益人群,有助于提高AGC 患者的预后。已有研究证实外周血炎症指标与恶性肿瘤免疫治疗预后相关,如血红蛋白、衍生中性粒细胞-淋巴细胞比值、血小板-淋巴细胞比值[6-11]。此外,患者的营养状况也与癌症死亡率密切相关,1/3 的死亡原因是晚期肿瘤患者出现严重营养不良[12]。越来越多的研究证实将反映全身炎症的相关指标与反映营养状况的相关指标复合,可预测恶性肿瘤患者的预后,如白蛋白与C 反应蛋白的比值——炎症营养指数以及C 反应蛋白和白蛋白相结合的复合指标——格拉斯哥预后评分[13-14]。然而,这类指标在临床应用中是稀缺的且没有常规检测。Sun 等[15]发现白蛋白和中性粒细胞联合预后分级(albumin and neutrophil combined prognostic grade,ANPG) 是非小细胞肺癌患者预后的独立影响因素。但目前未见ANPG 在肿瘤患者免疫治疗中的研究。因此,本研究探讨ANPG与AGC 患者ICI 治疗预后的相关性。
资料与方法
1 资料 选取解放军总医院第一医学中心肿瘤内科2014 年12 月-2018 年11 月接受ICI 治疗的Ⅲ~Ⅳ期GC 患者临床资料。纳入标准:1) 具有使用纳武利尤单抗、帕博利珠单抗、特瑞普利单抗或信迪利单抗治疗记录;2)应用ICI 至少有2~ 3 个疗程,所有临床资料和数据可从电子病历中获取;3)免疫治疗前7 d 内具有全血细胞计数结果。排除标准:AGC 患者发生严重感染或并发血液系统疾病。
2 治疗方案和疗效评估 ICI 包括特瑞普利单抗(君实生物:1877.HK,688180.SH)、信迪利单抗(信达生物制药:CXSS1700038)、纳武利尤单抗(美国百时美施贵宝制药:JXSS1700015-6)和帕博利珠单抗(默沙东:S20180019)。使用纳武利尤单抗的患者14 d 为1 个疗程,每3 个疗程行CT/MRI扫描后进行疗效评估。使用特瑞普利单抗、信迪利单抗和帕博利珠单抗的患者21 d 为1 个疗程,每2 个疗程行CT/MRI 扫描后进行疗效评估。使用方案包括 ICI 单药治疗或ICI 联合治疗(包括联合化疗或联合靶向或抗血管药物治疗)。疗效评估:完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定疾病(stable disease,SD)和疾病进展(disease progression,PD)。客观缓解率(objective response rate,ORR) 定义为达到CR 或PR 的患者的百分比,疾病控制率(disease control rate,DCR) 定义为疗效评估为CR+PR+SD患者所占百分比。
3 ANPG 及分组 收集AGC 患者使用免疫治疗前7 d 内人血白蛋白和绝对中性粒细胞计数。人血白蛋白最佳Cut-off 取正常值的最高上限35 g/L,中性粒细胞绝对值最佳Cut-off 取平均值4.26 g/L。ANPG 为人血白蛋白与绝对中性粒细胞计数联合的复合指标。临床上通常认为低水平人血白蛋白(<35 g/L)和高水平中性粒细胞绝对值(≥4.26 g/L)是 ANPG 的两个危险因素/关键指标。据此将患者分为3 组:含有两个危险因素为ANPG 评分差组;含有1 个危险因素为ANPG 评分中组;不含有危险因素为ANPG 评分高组。由于ANPG 评分中组与ANPG 评分差组无进展生存(progression-free survival,PFS) 率没有统计学差异(图1),故将其合并为ANPG 评分中/差组。最终分为两组:ANPG 评分好组和ANPG 评分中/差组。评估两组总生存(overall survival,OS) 和PFS 的差异。PFS 定义为AGC 患者从开始使用免疫治疗到最后一次随访时间或肿瘤进展。OS 定义为从AGC 患者从开始使用免疫治疗到最后一次随访时间或生命结束。
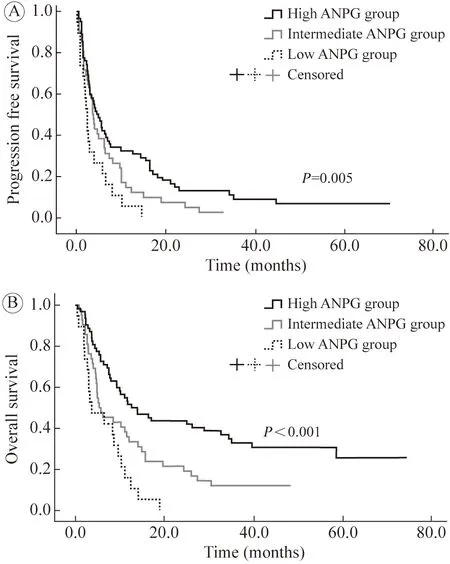
图1 用抗PD-1 抗体治疗的AGC 患者无进展生存(A) 和总生存(B)的生存曲线Fig.1 Kaplan-Meier survival curves for PFS (A) and OS (B) of AGC patients treated with anti-PD-1 antibodies
4 统计学分析 所有统计分析均使用SPSS26.0。连续变量以Md(range)表示。分类变量以例数(百分比) 表示。使用Kaplan-Meier 分析构建生存曲线,使用秩检验比较两组之间的生存差异。Cox 分析OS 和PFS 的独立影响因素。P<0.05 为差异有统计学意义。
结 果
1 患者一般情况 共纳入123 例接受ICI 治疗的AGC 患者。ANPG 评分好组62 例(50.4%),中位年龄为56 岁,男性49 例(79%);胃体/胃底癌27例(43.5%),贲门癌8例(12.9%),幽门癌27例(43.5%);ECOGPS评分为0~1分的患者60例(96.8%);30例(48.4%)有吸烟史;21例(33.9%)有肝转移,50例(80.6%)远处转移器官数目<3。ANPG评分中/差组61例(49.6%),中位年龄为59岁,男性49例(80.3%);胃体/胃底癌35例(57.4%),贲门癌13例(21.3%)例,幽门癌13例(21.3%);ECOGPS评分为0~1分的患者50例(82.0%);22例(36.1%)有吸烟史;32例(52.5%)有肝转移,39例(63.9%)远处转移器官数目<3。两组肿瘤位置(P=0.029)、肝转移状态(P=0.037)、远处转移器官数目(P=0.038) 和ECOG PS 评分状态(P=0.008)的差异有统计学意义。见表1。
2 治疗情况 ANPG 评分好组:48 例(77.4%)使用ICI 之前曾出现疾病进展,17 例(27.4%)一线使用ICI,45 例(72.6%) 在二线及二线后使用ICI;44 例(71.0%)接受了ICI 联合化疗,18 例(29.0%)未接受ICI 联合化疗。ANPG 评分中/差组:43 例(70.5%)在使用ICI 之前曾出现疾病进展;23 例(37.7%)一线使用 ICI,38 例(262.3%)在二线及二线后使用ICI;40 例(65.6%) 接受了ICI 联合化疗,21 例(34.4%)未接受ICI 联合化疗。见表1。

表1 AGC 患者基线临床特征(n,%)Tab.1 Baseline characteristics of the AGC patients (n,%)
3 疗效预后 疾病控制率:ANPG 评分好组达到51.6%,ANPG 评分中/差组达到44.3%,两组差异无统计学意义(P=0.415)。2) 客观缓解率:ANPG 评分好组达到27.4%,ANPG 评分中/差组达到21.3%,两组差异无统计学意义(P=0.430)(表2)。ANPG 评分好组中位OS 为12.7 个月,ANPG 评分中/差组为5.4 个月(P=0.001)。ANPG 评分好组中位PFS 为4.6 个月,ANPG 评分中/差组为3.3 个月(P=0.037)。见图2。
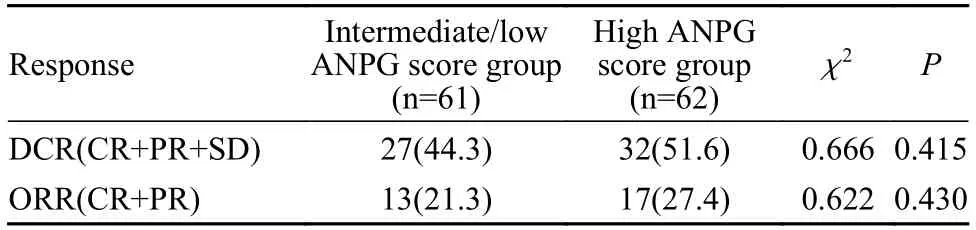
表2 两组的疗效评估(n,%)Tab.2 Comparison of efficacy between the two groups (n,%)
4 OS 的Cox 单因素和多因素分析 COX 单因素分析结果显示,ANPG 评分好组、免疫治疗前未出现疾病进展、ECOG PS 为0~ 1 分、肿瘤远处转移器官数目<3 个以及一线使用ICI 治疗有较长的OS。Cox 多因素分析结果显示,ANPG 评分好组、ECOG PS 为0~ 1 分和一线使用ICI 治疗与较长的OS 独立相关。ANPG 评分中/差组的死亡风险约是ANPG 评分好组2.3 倍(HR:2.302,95%CI:1.507~ 3.515,P<0.001)。ECOG PS≥2 分患者死亡风险约是0~ 1 分患者的2 倍(HR:1.995,95%CI:1.051~ 3.789,P=0.035)。使用免疫治疗在二线及二线后的患者死亡风险约是一线使用免疫治疗患者的1.7 倍(HR:1.671,95%CI:1.020~ 2.738,P=0.042)。见表3。
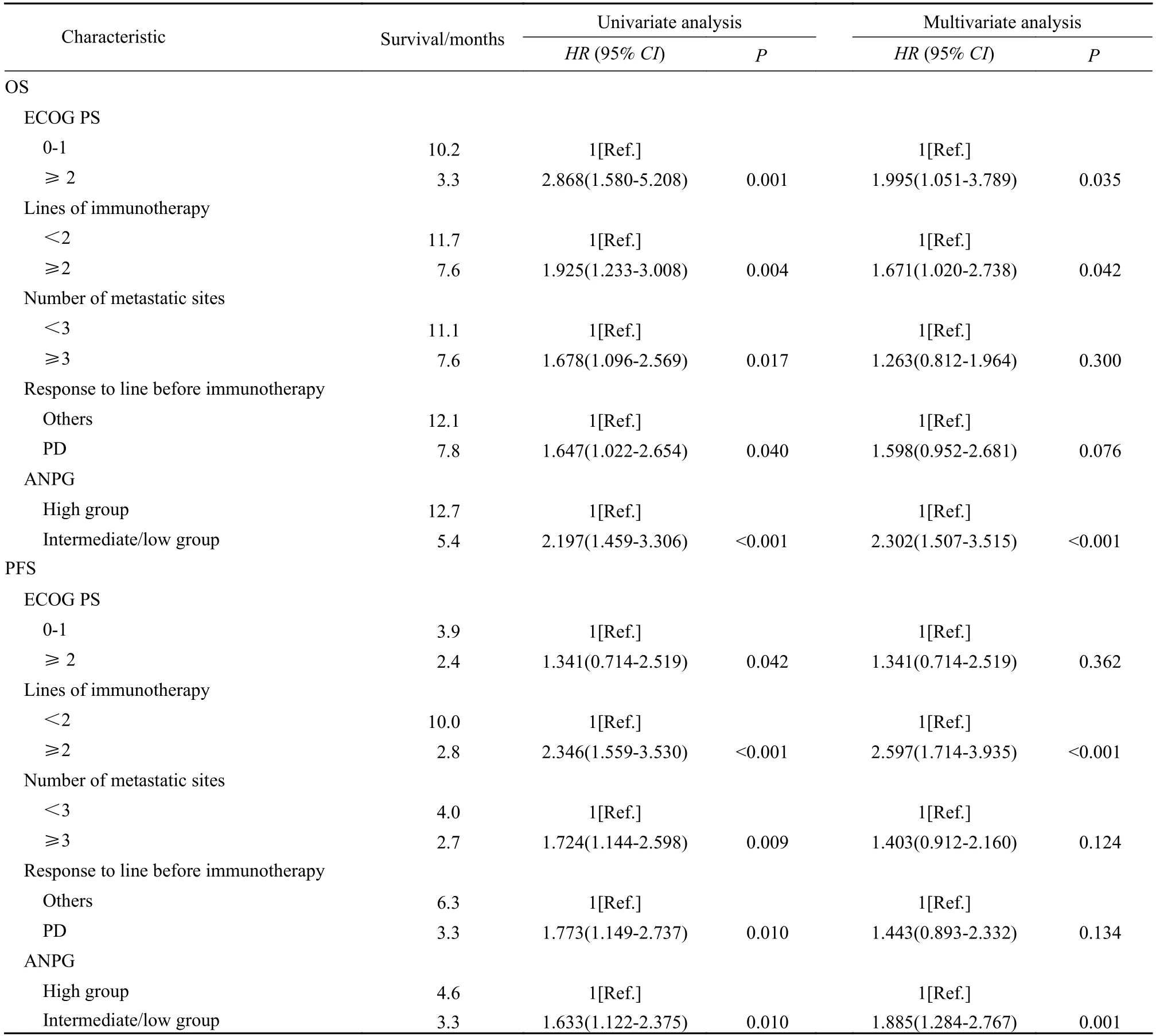
表3 影响AGC 患者总生存期和无进展生存期的单因素和多因素分析Tab.3 Univariate and multivariate analyses of factors associated with overall survival and progression-free survival of AGC patients
5 PFS 的Cox 单因素和多因素分析 Cox 单因素分析结果显示,ANPG 评分好组、免疫治疗前未出现疾病进展、ECOG PS 为0~ 1 分、肿瘤远处转移器官数目<3 个以及一线使用ICI 治疗有较长的PFS。Cox 多因素分析结果显示,ANPG 评分好组、一线使用ICI 治疗与较长的PFS 独立相关。ANPG 评分中/差组的死亡风险约是ANPG 评分好组1.9 倍(HR:1.885,95%CI:1.284~ 2.767,P=0.001)。使用免疫治疗在二线及二线后的患者疾病进展率约是一线治疗患者的2.6 倍(HR:2.597,95%CI:1.714~ 3.935,P<0.001)。见表2、图2。
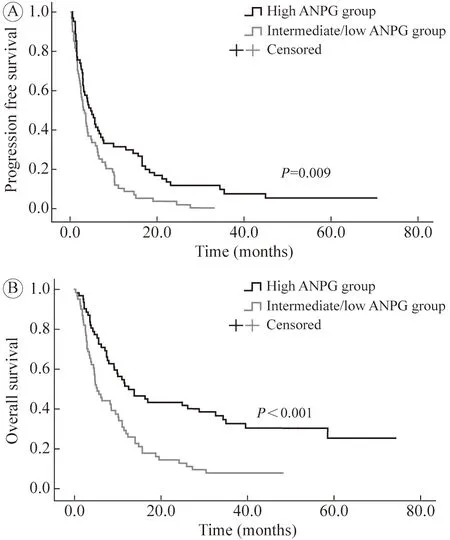
图2 用抗PD-1 抗体治疗的AGC 患者无进展生存(A) 和总生存(B)的K-M 生存曲线Fig.2 Kaplan-Meier survival curves for PFS (A) and OS (B) of AGC patients treated with anti-PD-1 antibodies
讨 论
免疫治疗在胃癌领域的地位逐年上升[16]。目前应用最广泛的生物标志物是基于免疫组化或基因检测的程序性死亡受体配体1[17]。其他有效的生物标志物包括肿瘤突变负荷、肿瘤浸润淋巴细胞、肿瘤特异性基因型和微卫星稳定性等[18-22]。然而,基于组织检测的生物标志物价格昂贵,不适合广泛适用于临床,且样本可能有偏倚。有报道称,反映全身炎性状态的血液指标和反映营养状况的血液指标与AGC 患者免疫治疗预后密切相关[6,8,14]。Sun 等[15]发现ANPG 是非小细胞肺癌患者预后的独立影响因素。但目前未见ANPG 在AGC 患者免疫治疗中的研究。ANPG 为人血白蛋白与绝对中性粒细胞计数联合的复合指标。我们发现ANPG 是AGC 患者OS 的独立影响因素,同时是PFS 的重要影响因素。多因素分析发现ANPG评分差组患者的死亡风险约是ANPG 评分好组患者的2.3 倍,疾病进展风险约是ANPG 评分好组患者的1.9 倍。我们还发现,一线使用ICI 治疗与较长的PFS 和OS 独立相关。而ECOG PS 为0~ 1分与较长的OS 独立相关,与PFS 无独立相关性。中性粒细胞作为机体的重要免疫细胞可以清除机体外来物,包括入侵的病原体以及突变的恶性肿瘤细胞。炎症反应与血管生成、癌细胞增殖和肿瘤远处转移有关[23]。淋巴细胞是机体免疫反应功能的重要组成部分[24]。中性粒细胞升高可抑制淋巴细胞的免疫攻击能力[25]。白蛋白是由肝代谢产生,人血白蛋白降低通常象征着肿瘤患者可能出现营养不良和恶病质。有证据表明,炎症反应可抑制人血白蛋白的合成,白蛋白的减少是肿瘤患者发生全身炎症的结果[26-27]。低白蛋白血症也被报道与肿瘤患者的低生存率相关[28]。这可能是因为肿瘤导致免疫力下降和营养不良。此外,由于缺乏白蛋白与药物的结合,化疗药物在血液中可能存在高残留和高毒性,这也会导致死亡率升高。
本研究存在的局限:1)作为临床回顾性数据收集,可能存在一些偏倚;2)患者在不同治疗线接受了不同的药物治疗;3)不同厂家生产的药物可能存在一些疗效上的差异。
综上,本队列回顾性研究表明ANPG 为AGC患者ICI 治疗后预测OS 的独立影响因素和PFS 的重要影响因素。免疫治疗前ANPG 评分好组使用ICI 后OS 可能获益。ANPG 的临床免疫治疗预后预测价值值得在一个大型前瞻性队列中被进一步验证。

