冰片对过氧化氢损伤后大鼠心肌微血管内皮细胞的保护作用
毛文军 蔡 薇
麝香保心丸是目前国内普遍用于治疗冠心病的中成药,有效组分包括人参提取物、人工麝香、冰片、肉桂、蟾酥、牛黄、苏合香7 种,通过合理的配伍,可起到“芳香温通,益气强心”的作用,具有抑制血管壁炎性反应,促进微血管新生的效用[1]。 冰片是麝香保心丸中具有挥发性的一种药材,冰片具有降低心率、减少心肌耗氧量、增加冠状动脉血流量的作用[2]。 有研究表明,冰片可作用于大鼠下丘脑,抑制交感神经兴奋性,减少儿茶酚胺类物质如肾上腺素及去甲肾上腺素释放入血,起到预防心血管疾病的作用[3,4]。
血管内皮细胞的损伤是心血管疾病最主要的病变基础,氧化应激反应是导致细胞损伤的关键,其主要机制是体内活性氮自由基(reactive nitrogen species,RNS)和活性氧自由基(reactive oxygen species,ROS)生成过多,机体代谢能力不足,失代偿引起体内氧化反应体系的失衡,导致细胞功能障碍[5,6]。 线粒体是生物体内能量代谢的主要细胞器,是生成活性氧自由基ROS 的主要部位,也是氧化应激反应损伤的主要靶点之一,线粒体损伤是导致心血管疾病、代谢综合征等多种疾病的重要机制[6]。 因此保护线粒体功能,减少氧化应激反应的损伤,有助于改善心血管疾病的预后。
过氧化氢(H2O2)是活性氧自由基ROS 及其衍生物的组分之一,过氧化氢含量升高可导致氧化应激反应[7]。 本实验通过建立H2O2导致的CMECs 氧化应激损伤模型,加入冰片干预处理,检测细胞内LDH、MDA、氧化呼吸链NADP + /NADPH、谷胱甘肽的含量,测定部分影响线粒体功能的基因mRNA 及蛋白的表达量,探究冰片对氧化应激损伤及线粒体功能的保护作用。
材料与方法
1.材料及试剂:大鼠心肌微血管内皮细胞CMECs 购自上海雅吉生物科技有限公司;天然冰片购自吉安聚鹏天然香料油有限公司;1001 内皮细胞培养基(endothelial cell medium,ECM)购自美国Sciencell 公司;cell counting kit-8(CCK-8)试剂盒、MDA(malondialdehyde)检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、GSH 和GSSG检测试剂盒、NADP + /NADPH 检测试剂盒均购自上海碧云天生物科技有限公司;DMSO、RNA 提取试剂盒购自北京索莱宝科技有限公司。 anti-FACL4 抗体[EPR8640](ab155282)、anti-Glutathione Peroxidase 4(GPX4)抗体(ab231174)、anti-β actin 抗体[mAbcam 8224]-Loading Control(ab8224)购自英国Abcam 公司。 反转录试剂盒PrimeScript RT reagent Kit(DRR037A)、SYBR Premix Ex TaqTM(DRR081A)
购自日本TaKaRa 公司。 PCR 扩增引物由上海生工生物工程股份有限公司合成。
2.CCK-8 法检测实验各组细胞的活力:在培养板每个孔中加入内皮细胞培养基100μl,预培养24h,加入10μl 待测物,于培养箱中培养4h,再于每孔中加入CCK-8 溶液10μl,静置于细胞培养箱4h,用酶标仪测定450nm 处各组细胞的吸光度(A)值。 本实验设定对照组细胞活力为100%,各实验组的相对细胞活力分别为该组与对照组A值的百分比。
3.过氧化氢损伤CMECs 模型的建立:首先将CMECs 分为5 组,其中1 组为对照组,其余4 组为H2O2损伤组,损伤组用浓度分别为200、400、600、800μmol/L 的 H2O2持续作用于 CMECs 12h, 用CCK-8 法检测各组细胞活力,确定本实验中合适的H2O2损伤浓度为400μmol/L。
4.冰片对CMECs 细胞活力的影响:将冰片溶解于0.1%DMSO 中,稀释到一定浓度。 实验分为对照组、0.1%DMSO 组及浓度分别为5、10、15、20、50μg/ml 的冰片组,分别作用12h 后,CCK-8 法检测各组细胞活力。
5.冰片对H2O2损伤后CMECs 细胞活力的影响:首先将CMECs 分为6 组,对照组为内皮细胞培养液培养36h;H2O2损伤组为用含400μmol/L H2O2的内皮细胞培养液培养36h;冰片治疗组为用含400μmol/L H2O2的培养液培养12h 后,再用含400μmol/L H2O2及不同浓度冰片的培养液培养24h,冰片浓度梯度分别为5、10、15、20μg/ml,同样用CCK-8 法检测各组细胞活力,确定冰片治疗浓度为15μg/ml。
6.分组:①对照组:用内皮细胞培养基培养CMECs 36h;②H2O2损伤组:在内皮细胞培养基中加入浓度为400μmol/L 的 H2O2,加入CMECs 培养36h;③冰片治疗组:含400μmol/L H2O2的培养基培养CMECs 12h 后,加入天然冰片,浓度为15μg/ml,继续培养24h。 然后检测各组的细胞活力,线粒体功能及氧化应激损伤相应指标。
7.LDH 的检测:将各组的培养液于96 孔培养板中离心5min,加入PBS 缓冲液稀释后的LDH 检测试剂,放入培养箱中孵育1h,再离心5min 取上清液。按照LDH 检测试剂盒说明书进行操作,根据相应公式计算得出结果。
8.MDA 含量检测:将各组CMECs 离心、收集细胞沉淀,冰浴中用PBS 缓冲液洗涤,冰浴条件下离心5min,取上清液。 根据MDA 检测试剂盒说明书的相应公式计算并得出结果。
9.NADP + /NADPH 的检测:在各组CMECs 中加入NADP + /NADPH 提取液,再加入细胞裂解液,冰浴条件下离心10min,收集上清液。 按照说明书进行检测,并计算得出相应结果。
10.GSH 及 GSSG 的检测: 将分组处理后的CMECs 经PBS 洗涤、离心、收集细胞沉淀,加入蛋白去除试剂M,用液氮及37℃水浴快速冻融连续两次,冰浴中静置5min,再离心10min 取上清液。 按照试剂盒说明书的公式计算出相应结果。
11.RT-PCR 检测:FACL4 上游引物:5'-AAGGAACAAAGGAGACTATG-3',下游引物:5'-TATTGCCAGTCTTTTAGCTTA-3';GPX4 上游引物:5'-GAGGCAGGAGCCAGGAAGT-3', 下游引物:5'-ACAGTGGGTGGGCATCGTC-3';β-actin 上游引物:5'-GGACCTGACTGACTACCTC-3',下游引物:5'-TCATACTCCTGCTTGCTG-3'。 用RNA 提取试剂盒提取CMECs 样本中的RNA,冰浴条件下配制RNA 反转录反应体系,反应液共10μl,反转录条件为:37℃15min,85℃5s,4℃保存。 冰浴条件下配制PCR 反应液共25μl,PCR 扩增程序为:95℃ 30s,60℃ 45s,40个循环,4℃保存。 以β-actin 为内参,计算mRNA的相对表达量。
12.蛋白免疫印迹:提取蛋白样本,经上样、电泳、转膜封闭后,分别加入对应抗体一抗孵育过夜,第2天室温下复温30min,二抗孵育1h,经显色及成像后进行条带分析。 采用相对定量法,以β-actin 为内参,目的蛋白的相对表达量为该蛋白条带灰度值与β-actin条带灰度值的比值。
13.统计学方法:应用SPSS 22.0 统计学软件对各实验组数据进行单因素方差分析,对差异显著的数据用最小显著差异法进行多重对比分析,实验数据以均数±标准差(x±s)表示,以P<0.05 为差异有统计学意义。
结 果
1.H2O2对CMECs 细胞活力的影响:各组浓度的H2O2干预CMECs 12h 后,CCK-8 法检测细胞活力的变化。 结果显示,H2O2导致CMECs 细胞活力降低,并与剂量呈相关性,H2O2浓度≥200μmol/L 时,细胞活力随H2O2浓度增加而降低,与对照组比较,差异有统计学意义(P<0.05,图1)。 本研究后续实验中选取的H2O2浓度为400μmol/L,损伤后细胞活力约为对照组的66%。

图1 不同浓度H2 O2 对CMECs 细胞活力的影响
2.冰片对CMECs 细胞活力的影响:用浓度分别为5、10、15、20μg/ml 的冰片作用于CMECs 后,各组细胞活力与对照组比较,差异无统计学意义,而冰片浓度为50μg/ml 时,细胞活力出现下降,与对照组比较,差异有统计学意义(P<0.05)。 0.1%DMSO 作用于CMECs后,细胞活力无明显改变。 本实验说明50μg/ml 冰片对CMECs 存在毒性不良反应,而0.1%DMSO 和5、10、15、20μg/ml 的冰片对细胞活力无明显毒性不良反应,后续实验中冰片均溶解于0.1%DMSO 中(图2)。

图2 不同浓度冰片及0.1%DMSO 对CMECs细胞活力的影响
3.冰片对H2O2损伤后CMECs 细胞活力的影响:H2O2损伤浓度为400μmol/L。 不同浓度冰片干预后,经H2O2损伤后的CMECs 活性较前明显升高,且冰片浓度为5、10、15μg/ml 时,细胞活力的上升程度与浓度呈正相关,当冰片浓度增至20μg/ml 时,细胞活力与15μg/ml 冰片浓度时基本相同,与对照组比较,差异有统计学意义;与H2O2组比较,差异有统计学意义(图3)。 后续实验中冰片治疗浓度为15μg/ml,相对细胞活力约为对照组的80%。

图3 不同浓度冰片对H2 O2 损伤后CMECs 细胞活力的影响
4.冰片对H2O2损伤后CMECs 内LDH 含量的影响:与对照组比较,H2O2损伤组的LDH 含量明显升高,约为对照组的4 倍,差异有统计学意义(P<0.05),而15μg/ml 冰片治疗组,CMECs 内LDH 含量明显降低,较H2O2损伤组下降约59%,差异有统计学意义(P<0.05,图4)。
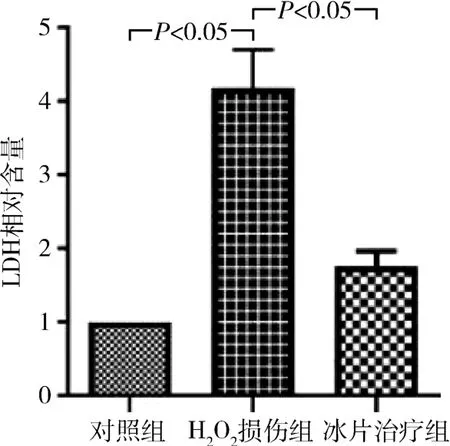
图4 冰片对LDH 含量的影响
5.冰片对H2O2损伤后CMECs 内MDA 含量的影响:与对照组比较,H2O2损伤组的MDA 含量明显升高,约为对照组的5.2 倍,差异有统计学意义(P<0.05);而冰片治疗后,细胞内MDA 含量明显降低,较H2O2损伤组下降约46%,差异有统计学意义(P<0.05,图5)。

图5 冰片对MDA 含量的影响
6.冰片对H2O2损伤后CMECs 内NADP + /NADPH 的影响:与对照组比较,H2O2损伤后CMECs内NADP + /NADPH 显著升高,约为对照组的6 倍,差异有统计学意义(P<0.05);而冰片治疗后,细胞内NADP + /NADPH 明显降低,较H2O2损伤组下降约52%,差异有统计学意义(P<0.05,图6)。
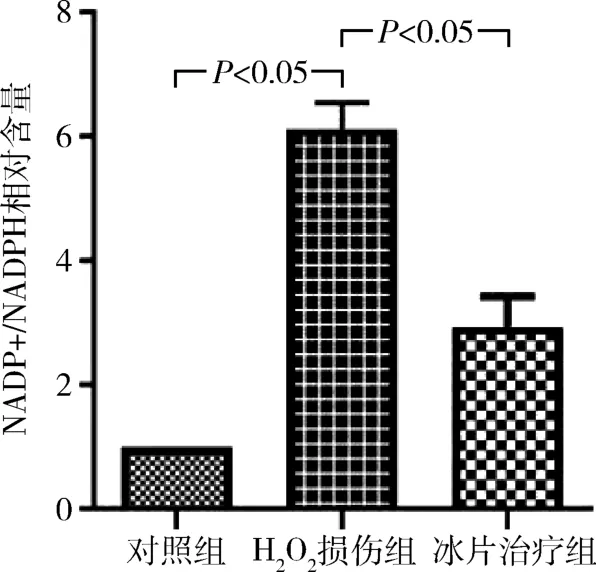
图6 冰片对NADP + /NADPH 的影响
7.冰片对H2O2损伤后CMECs 内GSH 及GSSG含量的影响:与对照组比较,H2O2损伤组的CMECs内GSH 含量显著降低,约为对照组的42%,差异有统计学意义(P<0.05,图7);GSSG 含量显著升高,约为对照组的4.6 倍,差异有统计学意义(P<0.05,图8);而冰片治疗后,CMECs 内GSH 含量较前明显升高,较H2O2损伤组提高约48%,差异有统计学意义(P<0.05,图7);GSSG 含量明显降低,较H2O2损伤组降低约33%,差异有统计学意义(P<0.05,图8)。

图7 冰片对GSH 含量的影响

图8 冰片对GSSG 含量的影响
8.冰片对H2O2损伤后CMECs 内基因表达的影响:与对照组比较,H2O2损伤后CMECs 内FACL4 mRNA 表达增加,约为对照组的2.75 倍,差异有统计学意义(P<0.05);冰片减少FACL4 mRNA 的表达,较H2O2损伤组下降约45%,差异有统计学意义(P<0.05,图9)。 与对照组比较,H2O2损伤组GPX4 mRNA表达减少,约为对照组的0.4 倍,差异有统计学意义(P<0.05);冰片治疗组GPX4 mRNA 表达增加,较H2O2损伤组增加约70%,差异有统计学意义(P<0.05,图10)。

图9 冰片对FACL4mRNA 表达的影响

图10 冰片对GPX4mRNA 表达的影响
9.冰片对H2O2损伤后CMECs 内蛋白表达的影响:FACL4 及GPX4 表达水平详见图11。 与对照组比较,H2O2损伤组FACL4 表达增加,约为对照组的3.5 倍,差异有统计学意义(P<0.05);冰片治疗组FACL4 表达减少,较H2O2损伤组下降约40%,差异有统计学意义(P<0.05,图12)。 与对照组比较,H2O2损伤组GPX4 表达减少,约为对照组的0.5 倍,差异有统计学意义(P<0.05);冰片治疗组GPX4 蛋白表达较H2O2损伤组增加约70%,差异有统计学意义(P<0.05,图13)。

图11 各组相关蛋白的表达

图12 FACL4 的相对表达水平

图13 GPX4 的相对表达水平
讨 论
冰片是麝香保心丸中有效成分之一,是一种小分子脂溶性单萜类物质,几乎不溶于水,因此将冰片溶于DMSO 中来增加溶解度,但DMSO 本身具有一定的毒性不良反应,本实验证明了体积分数为0.1%的DMSO 对细胞活性不会产生毒性不良反应,因此后续实验中冰片均溶解于0.1% 的DMSO 中。 关于冰片的毒性及安全性的研究数据尚不充分,本实验结果提示冰片浓度达到50μg/ml 时,CMECs 细胞活力出现下降,20μg/ml 与15μg/ml 的冰片对细胞活力的保护作用基本相同,因此后续实验冰片的治疗浓度选为15μg/ml。 H2O2作为常见的氧化剂,可通过增加细胞膜通透性引起细胞损伤。 有研究表明,适当浓度的H2O2引起细胞DNA 单链断裂而损伤,但这种损伤并不会引起细胞死亡,可通过碱基互补配对修复损伤[8]。 因此适当浓度的H2O2可诱导细胞氧化应激损伤同时保留部分细胞活力,本实验选用400μmol/L的H2O2作为CMECs 细胞损伤浓度。
线粒体是生物体内能量代谢的主要场所,呼吸链反应是产生活性氧自由基ROS 的主要渠道[9]。 NADPH 氧化酶作为线粒体呼吸链电子转运的主要催化酶之一,主要存在于心血管内皮细胞和平滑肌细胞中[10]。当氧化应激反应引起心肌细胞缺血再灌注损伤时,NADPH 氧化酶催化生成大量ROS,大量ROS 攻击细胞膜脂质双分子层,发生脂质过氧化反应,分解产生MDA,因此MDA 的含量可间接反映氧化损伤的严重程度,体现心肌损伤及心肌缺血的严重程度[11]。
LDH 是糖酵解过程中的一种关键酶,在人体心肌、骨骼肌、肝脏、肾脏等组织和器官中广泛存在,当心肌细胞严重损伤时,LDH 释放入血,LDH 的升高程度可反映心肌细胞损伤的严重程度,可作为急性心肌梗死的一个辅助检查指标。
铁死亡是一种依赖铁和ROS 的死亡方式,形态学特征表现为细胞核形态不变,线粒体体积减小,膜密度增加,外膜破裂,特点是脂质过氧化[12]。 谷胱甘肽过氧化物酶4(GPX4)是铁死亡核心调控子,是判断铁死亡的参考标志,GPX4 的作用机制为特异性催化谷胱甘肽,将有害的过氧化物转化为无毒性的脂质,从而减轻氧化应激损伤。 有研究表明,细胞内还原型谷胱甘肽GSH 的缺乏导致GPX4 失活,进一步导致铁死亡,加重氧化应激损伤[13]。
FACL4 基因编码脂肪酸辅酶A 连接酶4,FACL4基因在大脑等组织中高度表达,可编码产生多不饱和脂肪酸,在细胞膜磷脂代谢和维持细胞膜稳态中起着重要作用[14]。 有研究显示,FACL4 在原发性肝癌中高表达[15]。 FACL4 抑制剂TriacsinC 可作用于线粒体,使线粒体跨膜电位下降,引起线粒体膜通透性转运孔开放,进而释放caspase 活化物,激活caspase 途径,诱导肝癌细胞调亡。 本实验结果提示,在过氧化损伤的CMECs 中,FACL4 基因表达水平显著升高,可能与氧化反应损伤线粒体细胞膜有关。
综上所述,本实验的结果显示,CMECs 发生氧化应激损伤后,MDA 和LDH 含量明显升高,细胞内抗氧化剂NADPH 和GSH 的含量明显降低,而冰片治疗后,MDA 和LDH 含量降低,抗氧化剂含量较前升高,说明冰片可能通过增加NADPH、GSH 等抗氧化剂的活性,减轻细胞的氧化应激损伤,维持细胞内氧化还原平衡。另外,细胞氧化损伤后,FACL4 基因表达升高,GPX4 表达降低,冰片治疗可减少FACL4 基因的合成与表达,增加GPX4 基因合成表达,保护线粒体功能,维持细胞膜稳定,减轻氧化应激损伤。 关于冰片影响基因合成与表达方面的具体机制有待于进一步研究。

