基于高产γ-氨基丁酸的植物乳杆菌培养基优化
李 朔,李 潇,张晓黎,吴兴壮*
(1.沈阳农业大学 食品学院,辽宁 沈阳 110866;2.辽宁省农业科学院 食品与加工研究所,辽宁 沈阳 110161)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种重要的非蛋白氨基酸,主要是通过谷氨酸脱羧酶(glutamate decarboxylase,GAD)转化谷氨酸合成[1],广泛分布于自然界中。经科学研究证实,GABA作为交感神经系统的主要抑制性神经递质之一[2],不仅具有降低神经元活力、避免神经细胞过热[3]和降血压的作用[4],还可提高血浆生长激素浓度、脑蛋白合成速率以及抑制小气道源性肺腺癌等功效[5-6]。鉴于GABA在医药和食品领域中具有重要用途,随着“健康中国”上升为国家战略,功能食品行业正在进入一个黄金发展期。近年来,为了实现GABA的有益功能,人们将其作为生物活性因子已开发出富含GABA的奶制品[7]、调味品[8]、发酵腌制品[9]等众多功能性食品,展现出了广阔的发展前景。
由于GABA在生物组织中浓度很低,所以很难从自然生物中充分提取,且通过化学合成的GABA定向添加到食品中被认为是不自然和不安全的[10]。因此有必要寻找一种以自然和成本效益的方式生产和增加食品中的GABA。乳酸菌被公认为安全级(generally regarded as safe,GRAS)微生物,且被证实存在谷氨酸脱羧酶活性,具有转化谷氨酸生成GABA的能力[11],已受到国内外研究者的重点关注。周青[12]研究表明,在优化碳氮源及添加量的条件下,植物乳杆菌(Lactobacillus plantarum)WZ011能产生1.261 g/L的GABA。SHAN Y等[13]从传统发酵乳制品中成功筛选出一株高产GABA的植物乳杆菌(Lactobacillus plantarum)NDC75017并将其应用到酸奶发酵剂中发酵酸奶,结果显示不仅提高了酸奶中GABA的含量,同时制备的酸奶和对照酸奶在风味和质地没有显著性差异。林杨等[14]从吉尔吉斯斯坦地区特色乳制品中分离出一株戊糖乳杆菌(Lactobacillus pentosus)Z6,通过优化发酵工艺成功研制出了富含GABA和丰富营养物的乳酸菌发酵饮料。KWON S Y等[15]以水芹菜为主要原料,采用肠膜明串珠菌(Leuconostoc mesenteroides)与植物乳杆菌(Lactobacillus plantarum)复合发酵,并通过优化增加了水芹中GABA的含量,成功生产了这种同时富含葡聚糖和GABA的新型功能性水芹。
本课题组前期在东北酸菜中成功筛选并鉴定了一株产GABA的植物乳杆菌(Lactobacillus plantarum)LAG-1003,本研究通过单因素试验和响应面试验设计,进一步对其培养基组成进行优化,旨在提高菌株LAG-1003产GABA能力,为今后GABA商业化生产以及制备富含GABA的功能性食品提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌(Lactobacillus plantarum)LAG-1003:分离筛选自东北酸菜,现保藏于辽宁省农业科学院食品与加工研究所。
1.1.2 化学试剂
体积分数为95%乙醇、次氯酸钠、苯酚、硼砂、硼酸(均为分析纯):沈阳百盛化工有限公司;谷氨酸钠、小米糠(均为食品级):购于农科院市场;γ-氨基丁酸标准品(纯度99.9%):美国Sigma公司。
1.1.3 培养基
MRS液体培养基:西亚化学科技(山东)有限公司。
胰蛋白胨酵母膏葡萄糖盐(trypticase yeast extract glucose salt,TYG)培养基:葡萄糖10 g/L,蛋白胨5 g/L,酵母膏5 g/L,谷氨酸钠10 g/L,蒸馏水1 000 mL,pH值6.2。121 ℃灭菌15 min。
1.2 仪器与设备
SW-CJ-1FD型单人单面工作净化台、DGL-35X立式高压灭菌锅:上海力辰仪器科技有限公司;CJ50-3叠加式培养箱、TG16-WS台式高速离心机:无锡玛瑞特科技有限公司;756PC型紫外可见分光光度计:上海堪鑫仪器设备有限公司。
1.3 方法
1.3.1 菌株LAG-1003活化及种子液的制备
将4 ℃穿刺保藏的植物乳杆菌(Lactobacillus plantarum)LAG-1003菌株接种于25 mL的MRS液体培养基中,于33 ℃恒温活化培养24 h,后将活化后的菌株按5%的接种量转接至25 mL的MRS液体培养基中,于33 ℃恒温培养24 h,得到种子液。
1.3.2 菌株LAG-1003发酵液的制备
将培养24 h的植物乳杆菌(Lactobacillus plantarum)LAG-1003按照5%的接种量,接种于含有10 g/L谷氨酸钠的TYG发酵培养基中,在33 ℃条件下,培养48 h,即得菌株LAG-1003发酵液。
1.3.3 分析检测
(1)菌体生物量
菌株发酵培养过程中,以空白培养基作为对照,采用紫外可见分光光度计在波长600 nm处测量48 h培养液(OD600nm值)。
(2)γ-氨基丁酸含量的测定
采用Berthelot比色法对发酵液中的GABA含量进行测定[16-17]。分别配制质量浓度0、0.05 g/L、0.10 g/L、0.15 g/L、0.20 g/L、0.25 g/L、0.30 g/L的GABA标准溶液,并稀释5倍。以不加标准溶液为对照,取稀释后不同质量浓度的标准液0.5 mL,依次加入0.1 mL碳酸钠溶液(1.0 mol/L)、pH 9硼酸盐缓冲液(0.2 mol/L)0.5 mL、6%苯酚1 mL,混匀后放入冰浴中添加5.25%(有效氯)次氯酸钠溶液0.4 mL,待温度恢复到室温并保持6 min后放入沸水中对混合物加热10 min,随即在冰浴中冷却9 min,待出现蓝绿色后向混合物中加入2 mL体积分数为60%乙醇,并在630 nm波长下测定其光密度值(OD630mm值),并做三组重复样。以测定的OD630mm值(y)为纵坐标,GABA标准溶液质量浓度(x)为横坐标,绘制标准曲线。按照γ-氨基丁酸标准曲线回归方程(y=1.339 3x-0.008 1,相关系数R2=0.998 9)计算发酵液中γ-氨基丁酸含量。
1.3.4 培养基组成优化单因素试验
以TYG发酵培养基为基础进行单因素试验,以1%的丁二酸钠、果糖、葡萄糖、蔗糖、麦芽糖、可溶性淀粉作为唯一碳源,在确定碳源的基础上,固定碳源总量为1%,选取葡萄糖和丁二酸钠按照4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4的比例进行复配;再以1%的牛肉浸粉、蛋白胨、小米糠、胰蛋白胨、酵母膏作为唯一氮源或复配氮源(1∶1),酵母膏+牛肉浸粉、酵母膏+小米糠、酵母膏+蛋白胨、酵母膏+胰蛋白胨;选择总碳氮量范围为(1%~7%)、碳氮比例为1∶1、2∶1、3∶1、1∶2、1∶4、1∶5;分别添加5 g/L、10 g/L、15 g/L、20 g/L、25 g/L的谷氨酸钠。分别探究培养基成分对菌株LAG-1003 GABA产量以及生物量(OD600nm值)的影响。
1.3.5 发酵培养基响应面优化试验
根据单因素试验筛选的结果,采用Box-Behnken试验设计,以GABA产量(Y)为响应值,选择复合碳源添加量(A)、复合氮源添加量(B)、谷氨酸钠添加量(C)为试验的自变量因素,对菌株LAG-1003发酵产GABA的培养基组分进行优化。Box-Behnken试验因素与水平见表1。
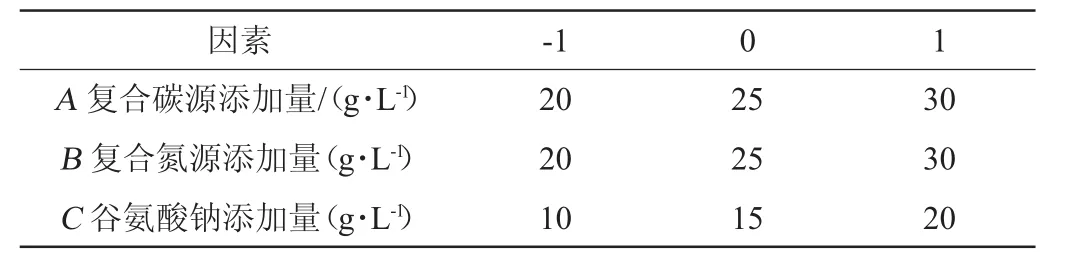
表1 Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Behnken experiments design
1.3.6 数据处理及分析
采用Origin 2021 软件进行图形绘制和IBM SPSS Statistics 26 进行单因素方差分析最小显著差异(least significant difference,LSD)t检验,每次试验数据均重复3次,采用“平均值±标准差”表示。
2 结果与分析
2.1 培养基组分优化单因素试验
2.1.1 碳源种类对菌株LAG-1003发酵的影响
为得到菌株LAG-1003最适发酵产GABA的单一碳源,试验以TYG发酵培养基为基础,将添加量为1%的丁二酸钠、葡萄糖、果糖、蔗糖、可溶性淀粉、麦芽糖分别添加到培养基中,探究6种不同碳源对LAG-1003菌株生长及合成GABA能力的影响,结果见图1。由图1可知,最佳碳源为葡萄糖时菌株生物合成GABA产量最高(2.47±0.06)g/L,且生长较好,与其他碳源的GABA产量均存在显著性差异(P<0.05)。果糖、蔗糖、可溶性淀粉虽然对菌株生长较好,但菌株生物合成GABA能力却较弱。同时观察到丁二酸钠作为单一碳源时,虽然菌株生长相对较差,但对菌株发酵合成GABA能力却相对较强,推测其对菌株催化底物向GABA转化过程中能够提高谷氨酸脱羧酶活性。此外,乳糖和麦芽糖虽然GABA含量相对较高,但考虑到使用麦芽糖、乳糖成本会较高。因此,选择葡萄糖与丁二酸钠作为最适碳源。

图1 碳源种类对菌株LAG-1003生物量及γ-氨基丁酸产量的影响Fig.1 Effect of carbon source types on biomass and GABA production of strain LAG-1003
2.1.2 复合碳源比例对菌株LAG-1003发酵的影响
为选出最优复合碳源比例,以TYG培养基为基础,固定碳源总量为1%,将葡萄糖与丁二酸钠按照4∶1、3∶1、2∶1、1∶1、1∶4、1∶3、1∶2比例进行复配,同时将单一碳源丁二酸钠和葡萄糖分别作为对照组进行比对,探究复合碳源对LAG-1003菌株发酵产GABA和生物量的影响,结果见图2。由图2可知,当葡萄糖与丁二酸钠的比例为3∶1时,菌株生物量及GABA合成量均较高,分别达到0.698±0.02、(2.60±0.02)g/L,与其他各组比例存在显著性差异(P<0.05),且与丁二酸钠、葡萄糖作为单一碳源时相比均存在差异显著(P<0.05)。随着丁二酸钠所占得比例增加,菌株生物量和发酵液中的GABA产量均较低,源于丁二酸钠作为有机碳源虽然能够提高GAD的活性增加GABA的产量,同时作为一种有机酸,其含量过多的积累会导致发酵液pH下降[18],从而不利于菌株生长和GABA含量增加。因此,选择葡萄糖与丁二酸钠比例为3∶1。
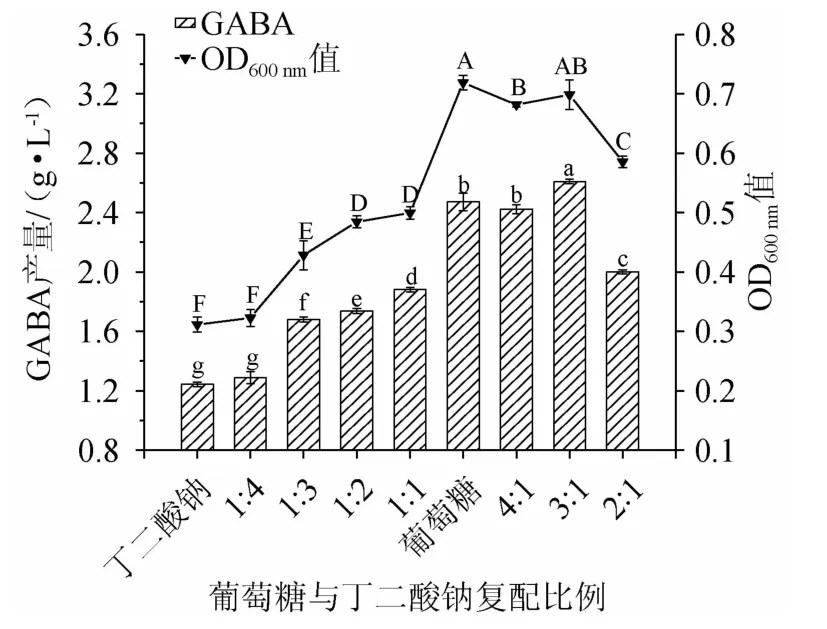
图2 葡萄糖与丁二酸钠比例对菌株LAG-1003生物量及γ-氨基丁酸产量的影响Fig.2 Effect of glucose and sodium succinate ratio on biomass and GABA production of strain LAG-1003
2.1.3 氮源种类对菌株LAG-1003发酵的影响
为得到菌株LAG-1003最适发酵产GABA的单一氮源,试验以TYG发酵培养基为基础,将胰蛋白胨、牛肉浸粉、酵母膏、小米糠、蛋白胨分别按照1%的量添加到培养基中,探究5种不同氮源对LAG-1003菌株生长及转化GABA能力的影响,结果见图3。

图3 氮源种类对菌株LAG-1003生物量及γ-氨基丁酸产量的影响Fig.3 Effect of nitrogen source types on biomass and GABA production of strain LAG-1003
由图3可知,当选择酵母膏作为唯一氮源时,菌株生物量及GABA产量分别达到0.818±0.03、(2.79±0.03)g/L与其他组均存在差异性显著(P<0.05)。黄桂东等[19]研究表明,酵母膏作为发酵培养基中的氮源时,对菌株生长及GABA合成能力远高于其他氮源,本试验结果与此结论相符。有研究表明,复合氮源对菌株生长及GAD活性具有促进作用[20],本试验在酵母膏作为氮源的基础上,复配其他氮源组成复合氮源进行下一步的研究。
2.1.4 复合氮源对菌株LAG-1003发酵的影响
以最佳氮源为基础,固定氮源总量为1%,将酵母膏与蛋白胨、胰蛋白胨、小米糠、牛肉浸粉分别按照1∶1的比例进行复配,同时将单一氮源酵母膏作为对照组进行比对,探究复合氮源对LAG-1003菌株发酵产GABA和生物量的影响,结果见图4。由图4可知,采用酵母膏与小米糠以1∶1复配时菌体生物量及GABA产量分别达到0.924±0.05、(2.99±0.02)g/L,均高于酵母膏作为唯一氮源的情况,并显著高于其他各组(P<0.05)。推测,酵母膏含有必需的生长因子能够促进菌体生长代谢,同时小米糠又被称为“天赐营养源”[21],两者共同促进菌体GABA的生物合成。此外也有研究表明小米糠本身含有谷氨酸脱羧酶,能够促进菌株本身的GAD活性,从而增加GABA的产量[22]。高爱同[23]将廉价小米糠作为培养基,在只加入合成底物的情况下,菌株依然能够产生较高的GABA。因此,酵母膏与小米糠最适复配比例为1∶1。
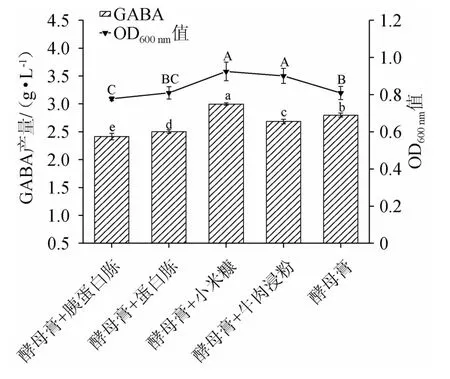
图4 复合氮源对菌株LAG-1003生物量及γ-氨基丁酸产量的影响Fig.4 Effect of compound nitrogen source on biomass and GABA production of strain LAG-1003
2.1.5 碳氮总量及比例对菌株LAG-1003发酵的影响
为选择最优碳氮总量及比例,选取碳氮总量范围为1%~7%,比例为1∶1、2∶1、3∶1、1∶2、1∶4、1∶5进行培养基优化,试验结果见图5。由图5可知,在不同的碳氮比下,菌体生物量及GABA产量随培养基碳氮总量的变化呈先增加后减少的趋势。这是因为碳氮总量的增加会明显提高菌株的生长及GABA产量,但碳氮总量太大会抑制菌株生长和GAD活性。在碳氮比例为1∶1、碳氮总量为5%时,菌体生物量及GABA产量均出现峰值,分别为1.35±0.04、(4.61±0.02)g/L。综合考虑,选取最适碳氮总量为5%、最适碳氮比例为1∶1。
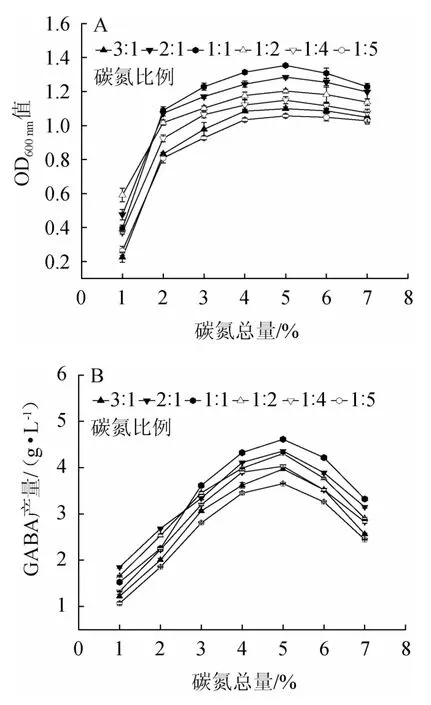
图5 碳氮总量及总碳氮比对菌株LAG-1003生物量(A)及γ-氨基丁酸产量(B)的影响Fig.5 Effect of contents and total carbon and nitrogen ratio on biomass (A) and GABA production (B) of strain LAG-1003
2.1.6 谷氨酸钠添加量对菌株LAG-1003发酵的影响
谷氨酸钠是使用具有GABA能力的菌株来生产GABA的主要合成底物,其添加量能够控制GAD的活性,进而影响GABA合成量[24]。在TYG培养基中添加5~25 g/L的谷氨酸钠,探究其对菌体生长及GABA合成的影响,结果见图6。
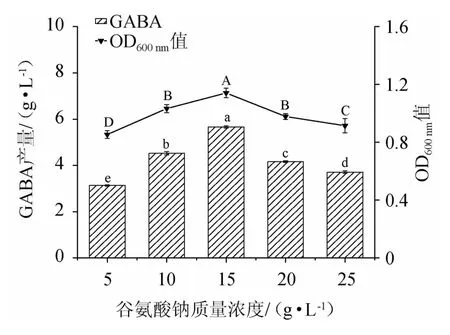
图6 谷氨酸钠添加量对菌株LAG-1003生物量及γ-氨基丁酸产量的影响Fig.6 Effect of monosodium glutamate addition on biomass and GABA production of strain LAG-1003
由图6可知,当谷氨酸钠添加量为5~15 g/L时,菌体生物量及GABA产量随谷氨酸钠添加量增加而增高;当谷氨酸钠添加量为15 g/L时,菌株利用底物生物转化GABA产量最高,为(5.661±0.05)g/L,且菌体生长情况最好,OD600nm值为1.142±0.03;随着谷氨酸钠添加量在15~25 g/L的增加不能有效的增加GABA合成以及促进菌体的生长,表明该菌株不能耐受高浓度的谷氨酸钠,这是因为高浓度的底物会增加细胞渗透压,干扰细菌代谢,影响GAD的活性[25]。因此,最适谷氨酸钠添加量为15 g/L。
2.2 发酵培养基优化响应面试验
在单因素试验基础上,选择复合碳源(葡萄糖与丁二酸钠比例为3∶1)添加量(A)、复合氮源(酵母膏与小米糠的比例为1∶1)添加量(B)、谷氨酸钠添加量(C)为自变量,以GABA产量(Y)为响应值(Y),Box-Behnken试验设计及结果见表2,方差分析见表3。
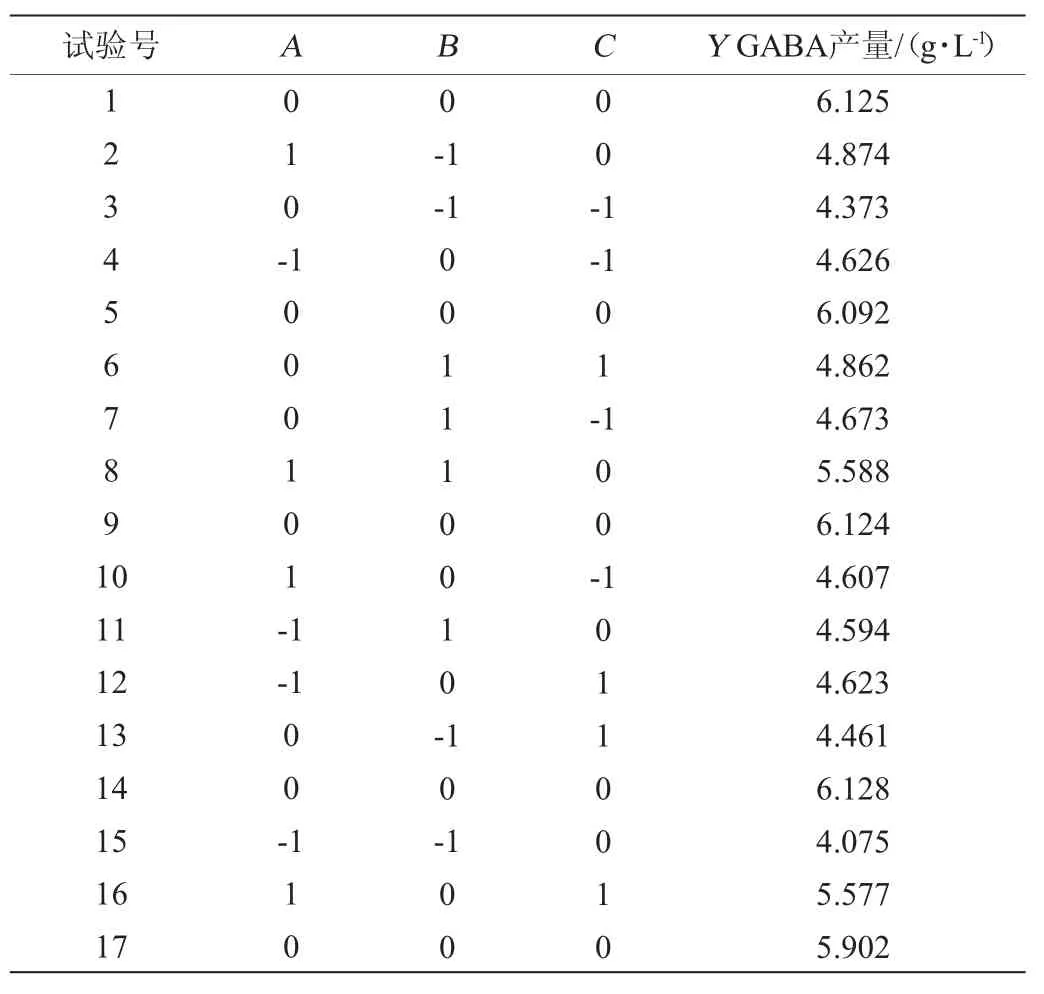
表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments
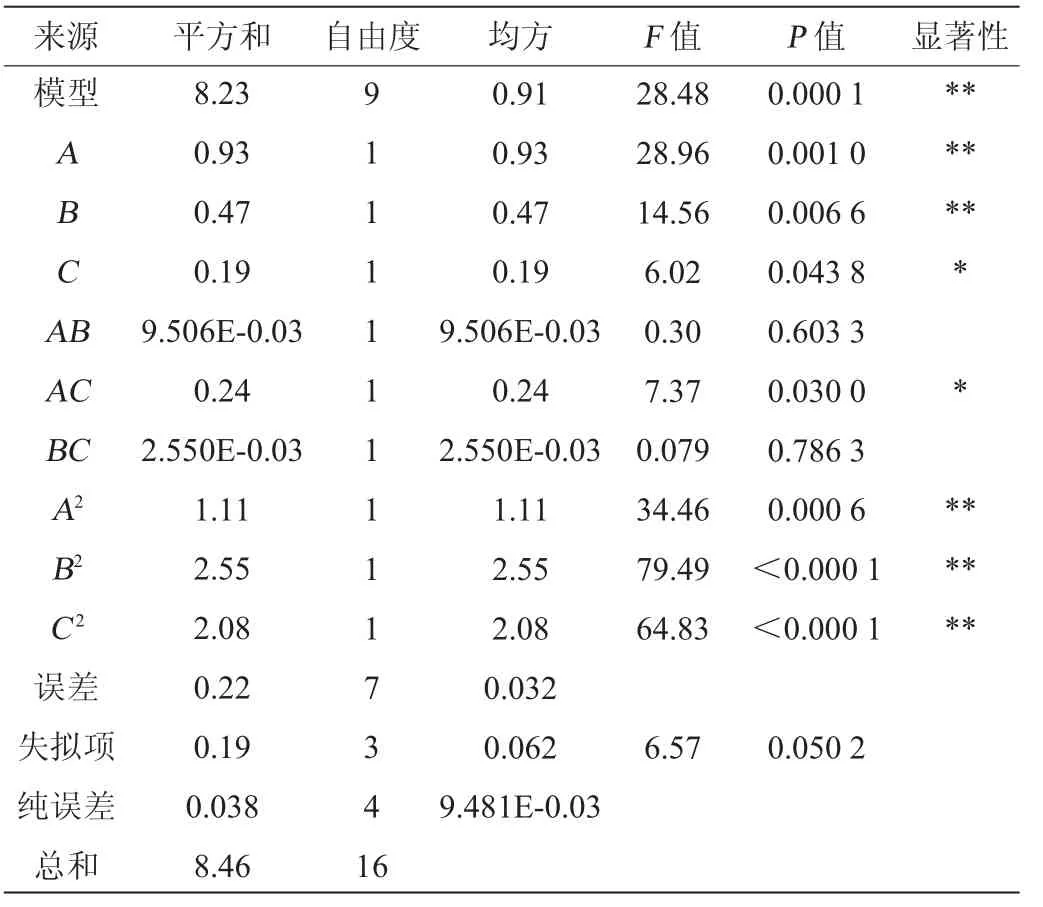
表3 回归模型方差分析Table 3 Variance analysis of regression model
据表2的试验结果,通过Design-Expert 8.0.6软件对试验结果进行二次回归拟合,得到各个因素对菌株LAG-1003发酵产GABA的二次回归方程如下:

由表3可知,回归方程模型项P=0.000 1<0.05,失拟项P=0.050 2>0.05,表明建立的二次的回归模型极显著且符合实际。该模型的决定系数R2为0.973 4,表明响应值的变化能够以97.34%用该模型解释,校正决定系数R2adj=0.939 2,变异系数(coefficient of variation,CV)3.49%,进一步说明了模型的预测值与实际值拟合程度较好。由P值可知,影响因子一次项A、B,二次项A2、B2、C2对GABA的产量影响极显著(P<0.01),交互项AC、一次项C对GABA产量影响显著(P<0.05)。其他项均不显著。由F值可知,可以确定三者对GABA产量影响顺序为复合碳源添加量>复合氮源添加量>谷氨酸钠添加量。
通过软件Design-Expert 8.0.6对回归方程进行分析,得各因素交互作用对结果影响的响应面及等高线见图7。由图7可知,AC响应面较陡峭,等高线越接近于椭圆形,说明AC交互项对结果影响显著,与方差分析结果一致。

图7 复合碳源、复合氮源及谷氨酸钠添加量对γ-氨基丁酸产量影响的响应面及等高线Fig.7 Response surface plots and contour lines of effect of interaction between compound carbon source,compound nitrogen source and monosodium glutamate addition on GABA production
通过软件Design-Expert V8.0.6对回归方程进行求解,得到最佳培养基组分为复合碳源(葡萄糖与丁二酸钠比例为3∶1)添加量25.81 g/L、复合氮源(酵母膏与小米糠比例为1∶1)添加量25.70 g/L、谷氨酸钠添加量15.64 g/L,在此条件下,GABA产量理论值为6.14 g/L。为了便于实际操作,将最佳培养基组分修正为复合碳源添加量26 g/L、复合氮源添加量26 g/L、谷氨酸钠添加量16 g/L,在此优化条件下进行6组平行验证试验,得到菌株LAG-1003的GABA产量实际值为6.15 g/L,与预测值相近,证明了用响应面优化得到的发酵培养基组分合理可靠。
3 结论
本研究通过单因素及响应面法优化了植物乳杆菌利用谷氨酸脱羧酶转化谷氨酸钠生成GABA的发酵培养基组成。结果表明,植物乳杆菌LAG-1003产GABA的最佳发酵培养基组分为复合碳源添加量26 g/L、复合氮源添加量26 g/L、谷氨酸钠添加量16 g/L。在此优化培养基条件下,33 ℃静置培养48 h,GABA产量为6.152 g/L,是优化前的2.91倍。

