油田采出水微生物菌株的筛选及适应性评价
朱 恒 李 毅 周文涛 程 翔
(1.中国石油长庆油田分公司油气工艺研究院;2.低渗透油气田勘探开发国家工程实验室;3.中国石油长庆油田分公司第八采油厂;4.中国石油长庆油田分公司第三采油厂)
0 引 言
在油田开采与开发过程中,随着注水驱油措施的广泛应用,大量的油田采出水被回注到油藏层位。回注能大幅度缓解采出水带来的环境压力,但是仍不可避免的对地层和土壤环境带来一定的影响[1]。微生物处理技术由于其成本低、对环境友好的特性在油田采出水处理工艺中得到广泛应用,但对油藏特性不同的采出水中微生物的影响还不清楚。
由于地层条件复杂,各区块采出水特征也不尽相同[2]。本文试验场站选择长庆油田位于陕西省定边县境内的姬嫄油区某联合站,该区块油藏埋藏深度1 680~2 200 m,含油饱和度60%,油藏温度45~60℃,矿化度30 000~90 000 mg/L,属于低孔特低渗油藏,采收率较低,含水量较大[3]。结合适合微生物生长的油藏条件[4]:油藏深度<2 438 m,温度<100℃,含盐量<105mg/L。由于水的矿化度为水中各种阴、阳离子的总和,水中的各类盐类一般是以离子形式存在,即可用含盐量的多少衡量矿化度的高低。可以看出该区块油藏条件适合微生物生长。
1 实 验
1.1 采出水水质
实验所用采出水由长庆油田定边某联合站提供,经过混凝、沉淀预处理后用于本实验研究。采出水的检测结果如表1所示。
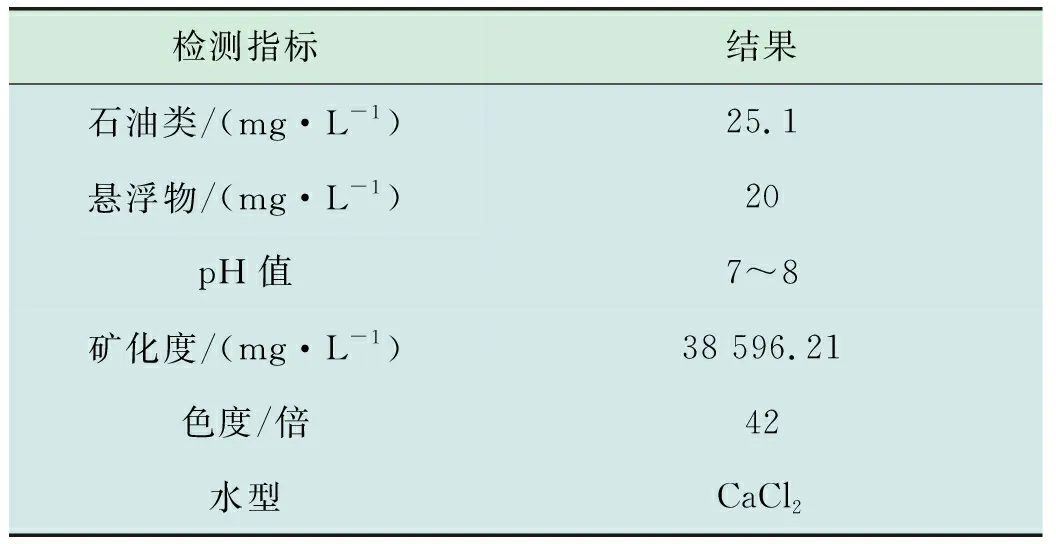
表1 采出水理化性质
1.2 实验材料
石油类是石油开采行业衡量采出水水质的重要指标,本文主要研究采出水微生物对石油类的降解,因此采用废钻井泥浆中原油降解菌[5]的培养基作为采出水原油降解菌的培养基,具体如下:
富集培养基:牛肉膏5.0 g、蛋白胨10.0 g、NaCl 5.0 g、蒸馏水1 000 mL,pH值7.0~7.2,配制固体培养基需加入2%的琼脂。灭菌条件:0.1 MPa,121℃,20 min。
无机盐液体培养基:NH4NO32.0 g、KH2PO40.5 g、K2HPO41.0 g、CaCl2·2H2O 0.02 g、MgSO4·7H2O 0.5 g、NaCl 5.0 g、蒸馏水1 000 mL,pH值7.0~7.2。灭菌条件:0.1 MPa,121℃,20 min。
选择培养基:无机盐液体培养基1 000 mL加备试采出水20.0 mL,pH值7.0~7.2,加入2%的琼脂。灭菌条件:121℃,0.1 MPa,20 min。
本文开展采出水降解菌富集和分离,具体过程为:
1)在无菌操作下,按10%的接种量吸取10 mL采出水加入到100 mL富集培养基中,置于恒温摇床(35℃,135 r/min)中培养3 d,培养液出现混浊。
2)按10%的接种量将1)中的培养液加入到50 mL已灭菌的无机盐液体富集培养基中,再置于恒温摇床(35℃,135 r/min)中培养3 d,获得新的培养液。
3)将2)获得的培养液按照2)步骤连续转接培养3次,得到目的菌占绝对优势的微生物混合培养液。
4)对上述步骤的富集培养物在固体培养基平板上进行划线分离,置于恒温摇床(35℃,135 r/min)中培养3 d。
5)选取湿润、圆整、表面光滑、边缘整齐、凸出且个体较大的菌落进行多次平板划线分离纯化,观察其菌落培养特征。
1.3 分析方法
首先从该区块采出水中富集、分离、筛选出以原油采出水为唯一碳源的微生物菌株,分别研究温度、酸碱性、盐度等条件对筛选菌株的影响,进一步通过室内试验初步研究各筛选菌株对采出水中石油类含量的降解率。
2 结果与讨论
2.1 油田采出水降解菌株的富集与分离
通过多次平板划线法对菌株进行富集分离,最终筛选得到5株菌株,分别编号为A菌、B菌、C菌、D菌和E菌,菌株形态特征见表2,可以看出,5种菌株的菌落特征在形态、大小、颜色、透明程度、表面和边缘特征及是否产生色素方面存在一定的差异。

表2 菌株的基本形态特征
参照《常用细菌系统鉴定手册》,对5种菌株种类进行初步鉴定。可以看出A、B和E菌株初步鉴定为肠杆菌属或其他革兰氏阴性菌,C和D初步鉴定为短杆菌属。
2.2 生长曲线测定
分别将5种菌株接种于1.2选择培养基(采出水为唯一碳源的液体培养基),置于恒温摇床(35℃,135 r/min)培养。每培养24 h取样一次,了解筛选菌株的生长状况,明确各菌株适宜的培养时间。结果如图1所示。

图1 5种菌株的生长曲线
由图1可见,5种筛选菌株的生长趋势基本较一致,在1~5 d内随着培养时间的增加而显著增长,随后生长趋势较为平缓。其中A、B、D 3种菌株均在10 d时O.D值达到最大;C和E菌株在9 d时O.D值达到最大;由于C和E菌株在10 d时的O.D值下降不明显,因此选择10 d作为培养菌株的最佳时间。
2.3 菌株适应性评价
2.3.1 温度适应性评价
将恒温摇床分别设置为25,35,45,55,65,75℃,将菌种接种于1.2选择培养基中,分别置于不同温度的恒温摇床(135 r/min)中培养10 d,测定各培养菌液的菌体生长情况。结果如图2所示。

图2 菌株在不同温度下的生物量
由图2可见,温度对5种筛选菌株的生长影响明显,随着温度的升高O.D值逐渐增大,都属于嗜温菌株;其中A、C、D和E 4种菌株在55℃ O.D值达到最大,B菌株在65℃ O.D值达到最大;由此可见,5种菌株均可在本实验区块的油藏温度下生长繁殖,A菌株更能适应该区块油藏温度。
2.3.2 酸碱度适应性评价
以1.2的选择培养基为基础,分别调节pH值为3.5,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0和9.0,将每一种菌株分别接种在不同pH条件的选择培养基上,置于55℃恒温摇床(135 r/min)培养10 d,测定各培养菌液的菌体生长量。结果如图3所示。

图3 菌株在不同pH值下的生物量
由图3可见,A菌株最适宜生长的pH条件为7.5,表现为O.D值可高达0.9,在pH值7.0~8.0之间的生长量明显高于其他菌株,在偏碱性环境下生长良好;B、C和E菌株最适宜生长的pH条件为7.0,在中性环境下能更好生长繁殖;D菌株在pH值为6.5条件下生长量最大,在偏酸性环境下生长良好。该区块油藏为偏碱性环境,更适合A菌株生长繁殖。
2.3.3 矿化度适应性评价
地层水中包括许多种盐类,其中90%以上为NaCl[6],因此本文选择使用NaCl来调节培养液盐度,探究矿化度对菌株生长的影响。以1.2的选择培养基为基础,使用NaCl溶液调节其盐度分别为0,1%,5%,10%,15%,20%,25%,30%,将每一种菌株分别接种在不同NaCl含量的液体培养基中,置于55℃恒温摇床(135 r/min)培养10 d,测定各培养菌液的菌体生长量。结果如图4所示。

图4 菌株在不同矿物度下的生物量
由图4可看出,5种菌在不同盐度的营养液中有比较统一的生长趋势,均呈现先上升后急速下降的趋势;在NaCl含量<1%时表现出比较明显的生长优势,当NaCl含量>15%时5种微生物几乎不能生长繁殖,可推断在很高的矿化度情况下会造成细菌的细胞内外渗透压差值过大。盐度可以用来衡量矿化度,因此5种菌株在矿化度<1×104mg/L时能很好的生长繁殖,矿化度>1.5×105mg/L时5种菌株不能生存,A菌株在矿化度<5×104mg/L时也有较好的生长趋势。该区块矿化度<105mg/L,适合5种菌株生长繁殖。
2.4 采出水降解菌株对原油的降解效果
为探究本文筛选菌株对原油的降解效果,将分离出来的菌株接种于以原油为唯一碳源的液体培养基中进行培养,观察其对原油的降解效果,实验设置条件见表3。图5为筛选的5种菌株的原油降解率。

表3 5种菌株的原油降解实验条件

图5 5种菌株对原油的降解率
从图5可看出,5株筛选的采出水降解菌株中,A菌株对原油的降解效果最佳,降解率为55.6%,其次为E菌株,其原油降解率为38.9%,而C和D菌株的原油降解效果则较差,降解率分别为8.9%和6.7%。A菌株可作为采出水降解菌菌株,以开展后续的研究工作。
3 结 论
1)通过富集培养、菌株的分离与纯化得到了 5 株不同的采出水降解菌株。
2)5种菌株均能适应该区块油藏温度和矿化度,A菌株生长繁殖最佳;该区块油藏为偏碱性环境,更适合A菌株生长繁殖。
3)A菌株对原油的降解率达到55.6%,可作为采出水降解菌菌株,需要进一步通过形态学特征、生理生化分析及16 s rRNA基因来开展菌株鉴定工作。

