Zn2+交联的海藻酸钠三维支架的理化特性及其与脊髓神经干/祖细胞的生物相容性研究
周军,唐志坚,吴雅奇,刘胜文,王煜
海藻酸钠是一种来自海藻细胞壁的高分子聚合物。在二价阳离子的作用下形成水凝胶(alginate hydrogel,AH)。AH 在制药、心肌和骨骼修复中广泛使用[1-3]。AH 与中枢神经组织有着良好的组织相容性,并被用于脊髓损伤(spinal cord injury,SCI)的研究。采用传统方法交联得到的AH 凝胶,其拓扑结构有一定随机性,常呈蜂窝或海绵状[4]。我们前期研究发现采用重力渗透二价阳离子(如Zn2+)的方法可以得到具有线性微管道结构的AH 三维支架,移植AH 后对SCI有一定的修复作用[5]。但是,AH三维支架的理化特性和生物学稳定性还需要进一步探索。
由于SCI后脊髓组织发生坏死,形成囊腔,脊髓神经环路被中断,而内源性的神经干细胞对损伤组织的修复作用有限,大部分参与形成胶质瘢痕,进一步阻止轴突的再生[6]。因此,外源性细胞移植成为治疗SCI 的重要方法之一。AH 三维支架作为移植细胞的载体可以有效修复组织的连续性,引导轴突再生。但是再生轴突为脊髓固有神经元纤维而非调节运动功能的皮质脊髓束,难以达到满意的功能恢复[7]。近年来研究发现,脊髓神经干/祖细胞(neural stem progenitor cells,NSPCs)具有更接近脊髓组织特征,既可以分化成神经元发出大量轴突,也可以促进皮质脊髓束在伤灶内的再生,重建神经功能[8]。本研究进一步明确Zn2+交联的AH三维支架的理化特性,并在体外条件下探索AH 三维支架与脊髓NSPCs 的生物相容性,为下一步的体内研究提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD 大鼠由华中科技大学同济医学院实验动物中心提供,同系交配后取孕14 d 的胎鼠。本实验经过同济医院实验动物伦理委员会批准。
1.1.2 主要试剂与材料 海藻酸钠粉末、明胶、氯化锌粉末及六亚甲基二异氰酸酯(hexamethylene diisocyanate,HDI)、多聚甲醛、BCA蛋白测定试剂盒均购于Sigma 公司;无菌去离子水及无菌磷酸盐缓冲溶液(phosphate buffer saline,PBS)购于Biosharp公司;不锈钢模具、Neurobasal 无血清培养基、B-27、神经营养因子(脑源性神经营养因子、碱性成纤维生长因子、血管内皮细胞生长因子、MDL28170)[9]、胰蛋白酶、Triton-100X及Tris缓冲盐溶液(Tris buffer saline,TBS)均购于gibco 公司;山羊血清、Tuj-1、Nestin 及Olig2 单克隆抗体、Alexa Fluor 488交联的荧光二抗、MTT增殖检测试剂盒购于abcam公司;浓盐酸、高氯酸、叔丁醇、干丙酮、浓硝酸均购于天津化工三厂。
1.2 方法
1.2.1 AH 三维支架的制备 将2 g 海藻钠酸粉末和0.2 g明胶溶于无菌去离子水,搅拌6 h(1000 r/min),配制成100 mL 海藻酸钠明胶(增加支架的稳定性)混合溶液,经聚醚砜膜(孔径0.2 μm)过滤后倒入圆柱形不锈钢模具(直径5.0 cm,高度4 cm)。室温下静置24 h去除气泡。将氯化锌粉末溶于无菌去离子水(浓度1 mol/L),经聚醚砜膜过滤后注入喷雾瓶,喷雾瓶口高于海藻酸钠明胶混合溶液的液面20 cm喷洒至模具装满氯化锌溶液。室温下静置48 h 后取出交联形成的AH 三维支架置于无菌去离子水中浸泡4 次(1 h/次)。切除支架顶部和底部无管道结构部分后将其置于500 mL 干丙酮溶液中浸泡4 次(1 h/次)。将AH 转移到0.1 mol/L的HDI-干丙酮溶液中固化4 h后置于干丙酮中浸泡洗涤4次(0.5 h/次)去除多余HDI。用吸水纸吸除AH 表面丙酮后置于70 ℃的500 mL 无菌去离子水中浸泡直至凝胶表面无气泡产生(留取部分样本用于残留离子测定)。将AH 置于0.1 mol/L 的盐酸中浸泡8 次(15 min/次)以去除多余的金属离子,再用无菌去离子水浸泡AH至溶液pH呈中性。将所得到的AH保存在75%酒精中备用。AH使用前,用无菌PBS洗涤3次(1 h/次)。
1.2.2 AH 三维支架结构稳定性的测定 将AH 置于震荡切片机上切割成5×5×5 mm大小的立方体并放在细胞培养皿中,加入3 mL 无菌PBS 没过AH 后在培养箱中孵育,每隔3天更换1次PBS,每次换液后,光镜下观察海藻酸钠AH的孔隙结构并用吸水纸吸出PBS后称重,孵育时间18周。
1.2.3 AH 三维支架离子残留测定 将尚未用盐酸浸泡洗涤的样本切割成5×5×5 mm 的立方体,冷冻干燥后称重,并置于2 mL浓硝酸中,120 ℃下加热至浓硝酸完全挥发,再次加入2 mL 浓高氯酸,加热至完全挥发。重复加入浓缩高氯酸直至残留物为无色,将其溶解于0.5 mol/L 硝酸溶液,光谱分析仪测定硝酸溶液中金属离子含量。收集经过0.1 mol/L盐酸浸泡不同次数后的AH,用无菌去离子水洗涤至中性,重复上述步骤,测定不同盐酸洗涤次数后,AH中残留金属离子含量。
1.2.4 AH三维支架内明胶蛋白含量测定(BCA法)将AH 三维支架置于干燥器(60 ℃)内烘干,将标准蛋白或干燥的支架并置于BCA 工作液(37 ℃)中震荡浸泡30 min,酶标仪(562 nm)测定吸光度。
1.2.5 AH 超微结构分析 将AH 放在震荡切片机上切割形成2×2×2 mm 大小的立方体,分别置于30%、50%、70%、90%和100%的乙醇中梯度脱水(10 min/浓度)后放在叔丁醇中浸泡5 min,经真空冷冻干燥48 h后涂覆10 nm金膜,扫描电镜下观察超微结构。
1.2.6 脊髓来源的NSPCs的分离和培养 将孕期14 d的SD 大鼠断颈处死,医用酒精浸泡,剪开腹部取出子宫,在无菌PBS 溶液中分离出胚胎。在冰上用无菌PBS 清洗3 次后置于培养皿中,显微镜下分离胚胎脊髓,剥除脊膜,PBS清洗3次,将脊髓剪成1×1×1 mm的组织块。用0.25%胰蛋白酶处理后过滤,离心得到NSPCs,重悬于含有2% B27 和神经营养因子的Neurobasal 培养基中。
1.2.7 AH 与NSPCs 共培养 将得到的NSPCs 悬液滴加到AH 支架(2×2×2 mm,细胞数~106/支架)的管道中或AH 支架切片(0.5×4×4 mm,细胞数~106/切片)上。将含有NSPCs 的支架或切片置于含有2%B27-Neurobasal 培养基的96 孔板中培养,在不同时间节点观察支架管道中细胞情况。
1.2.8 AH 对NSPCs 存活率影响的测定 NSPCs 在AH 切片上培养后,不同时间节点弃去培养基,PBS 清洗后每孔加入MTT溶液(5 mg/mL)20 μL,培养箱中孵育4 h 后弃去上清,孔内加入二甲基亚砜150 μL,振荡10 min后在酶标仪上测定每孔吸光值。
1.2.9 免疫荧光染色 将单独培养或与AH 共培养细胞用TBS 洗涤后于多聚甲醛中固定15 min,TBS 洗涤3 次,在含5%山羊血清/0.25%Triton X-100 的TBS 封闭1 h,TBS 洗涤3 次,含有1%山羊血清的一抗在4 ℃下孵育过夜,TBS 洗涤3 次后用荧光二抗在室温下避光孵育2 h,TBS 洗涤后荧光显微镜下观察结果并拍照。
1.3 统计学处理
本研究采用GraphPad Prism 8.0软件进行制图、数据数据处理和统计分析,符合正态分布以及方差齐性的计量资料以(±s)表示。
2 结果
2.1 AH三维支架的管道结构及理化特性
Zn2+与海藻酸钠水溶液交联形成AH,大体结构颜色呈半透明,弹性良好。光镜下,AH 内含有均一线性平行的微管道,管道分布均匀,管道直径为(93.26±6.24)μm,管道密度为(9.72±2.37)/mm2,管道孔隙率为(66.22±8.97)%。在扫面电镜下可见管道内部的微小突起。交联的AH支架经过8次洗涤后其所含Zn2+剂量低于0.1 nmoL/mg(0.08 nmoL/mg),明胶含量为(0.11±0.03)mg/mgAH干重,且支架的管道结构能够保持长期稳定,体外孵育18周后未发生明显降解反应,见图1。
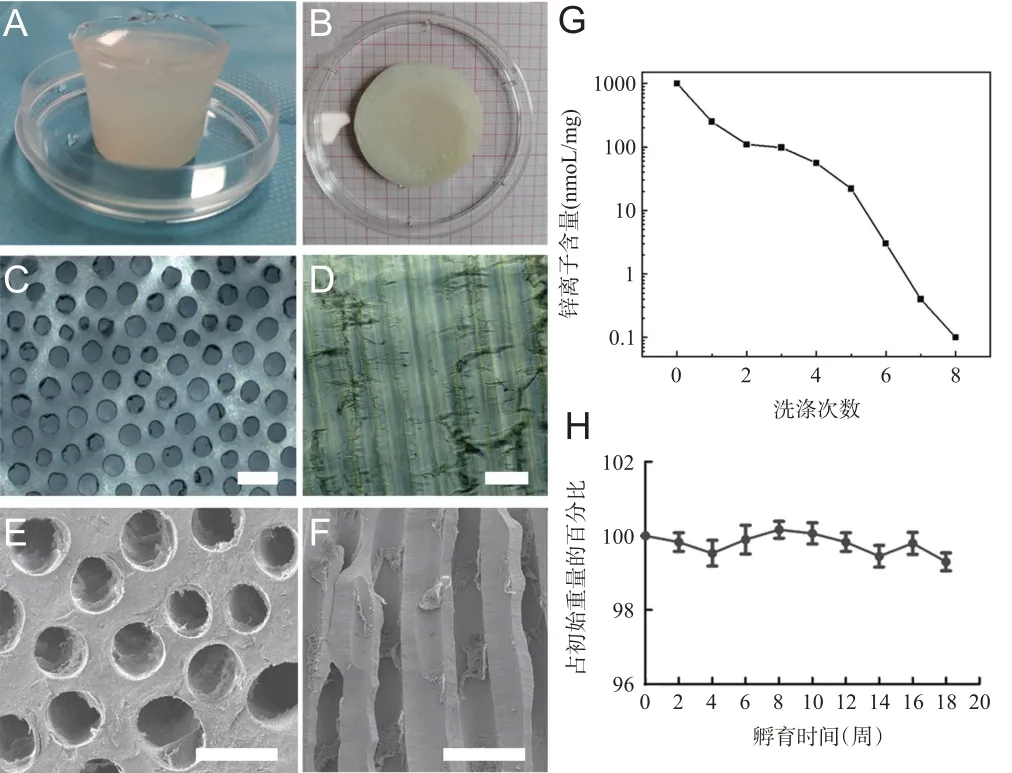
图1 AH三维支架的制备和理化特征
2.2 脊髓NSPCs具有良好的增殖和分化能力
胚胎源性的脊髓NSPCs 在含有神经营养因子的Neurobasal 培养基中培养后3 d内聚集成球,干细胞标记Nestin强阳性表达,1周后细胞球贴壁生长并分化成神经元,延伸出大量的Tuj-1(+)的突起,部分细胞分化成星形胶质细胞和少突胶质细胞,见图2。

图2 脊髓NSPCs的分离和鉴定
2.3 AH对NSPCs增殖和分化的影响
脊髓NSPCs在含神经营养因子的Neurobasal 培养基中贴覆于AH表面成球生长,1周后部分分化成神经元、星形胶质细胞和少突胶质细胞。其细胞存活率>90%,且随培养时间延长无明显变化。扫描电镜下可见NSPCs粘附于管道表面,并分化成神经元细胞,见图3。

图3 AH三维支架与NSPCs的生物相容性
3 讨论
本研究探索了Zn2+交联的AH 生物支架的理化特性和超微结构特征,证实了其拓扑结构的稳定性及其与脊髓NSPCs良好的生物相容性。
AH移植治疗SCI已经广泛用于动物实验的研究,其优势在于:填充SCI形成的囊腔,恢复脊髓结构的连续性;作为细胞的载体,减少移植细胞的用量;为移植细胞提供免疫屏障,防止或减少排斥反应;持续释放生物活性分子,并使其在局部发挥作用,提高治疗效率[10]。此外,AH内部的微管道结构还可以引导轴突呈接近生理状态的线性生长,使更多的再生轴突跨过伤灶进入正常脊髓组织建立突触联系[11]。
虽然藻酸盐形成的AH在不同的疾病模型中已有广泛的研究[3],但大多数采用的AH无固定的拓扑结构,其形态和结构受制备环境和技术的影响变异较大。常用的方法包括二价阳离子(如Ca2+)直接混合或三维打印[10],这些方法形成的AH 含有大量游离的二价阳离子。与这些方法相比,AH三维支架的制备条件更为苛刻。且制备过程中通过8次以上的盐酸洗涤后,Zn2+的检出浓度极低,从而避免过多的离子影响移植细胞的存活或对受体组织造成附加损伤[12]。此外,移植物拓扑结构能够保持较长时间的稳定性是神经轴突持续再生的重要前提[10]。因此,通过体外模拟降解实验发现,AH三维支架的管道结构能够保持稳定而不发生降解。
在慢性SCI的动物模型中,AH三维支架与脊髓组织有着良好的组织相容性,并促进少量的轴突再生,受体大鼠表现出了一定的功能恢复[13]。在急性SCI 的动物模型中,将骨髓间充质细胞[11]、施万细胞[5]和星形胶质细胞种植于AH 中移植到脊髓组织后,可见大量的轴突生长进入伤灶,通过增加神经营养因子的表达或正常脊髓内注射移植细胞,可以进一步诱导再生轴突进入脊髓组织。由于再生的轴突来自脊髓固有神经元,对肢体感觉和运动功能的恢复作用有限。因此,深入了解AH 的特性并优化移植策略才能进一步改善AH的治疗作用。
脊髓NSPCs 具有向脊髓神经元和胶质细胞分化的潜能,能很好的修复损伤的脊髓组织。移植脊髓NSPCs至SCI病灶后分化成的神经元可以形成类似脊髓灰质的板层结构,其发出大量的轴突与正常脊髓组织内的神经元胞体形成突触连接[14]。但脊髓NSPCs的细胞来源受到伦理学限制,难以满足大量SCI 患者的需求。NSPCs 联合AH 移植则可以减少细胞的用量,且AH的拓扑结构可以引导再生轴突的定向生长。在本研究的体外试验中,NSPCs 可以附着于AH 表面成球生长,增殖和分化成神经元、星形胶质细胞和少突胶质细胞。AH与NSPCs良好的生物相容性为进一步的体内研究奠定了基础。
综上所述,本研究使用Zn2+与海藻酸溶液交联制备的AH 三维支架,具有良好拓扑结构稳定性和对脊髓NSPCs 的生物相容性,为探索AH 三维支架联合NSPCs在体移植对脊髓损伤的修复作用提供了依据。

