高强度聚焦超声消融术联合不同药物治疗子宫腺肌病的临床疗效
董 欣,张亚琴,庞晓卿,秦丽欣,杨 茉,任 鹏,李晓雪
子宫腺肌病(adenomyosis,AM)是指具有生长功能的子宫内膜腺体和间质侵入子宫肌层内,在体内性激素的影响下局限或弥漫性生长的一种妇科良性疾病[1],主要症状为子宫增大、进行性痛经及月经量增多等,严重者可引起流产及不孕,严重影响患者的生活质量[2]。传统的药物治疗无法根治,容易复发[3],子宫切除术或病灶切除手术创伤较大,影响生育功能[4]。近年来,聚焦超声消融术(focused ultrasound ablation surgery,FUAS) 作为一种新型的无创技术得到快速发展,其安全性、有效性得到临床广泛的认可[5-7],但由于AM 病灶具有散在分布和界限不清的特点,所以单纯进行FUAS很难彻底清除病灶,复发的可能性较大。本研究通过探讨单纯FUAS治疗、FUAS联合左炔诺孕酮宫内缓释系统(levonorgestrel -releasing in uterine system,LNG-IUS)和FUAS联合地诺孕素(dienogest,DNG)三种方案治疗AM的临床效果,旨在为制定临床治疗方案提供依据。
1 对象与方法
1.1 对象 选取2018-01至2020-10在我院经MRI检查明确诊断的AM患者150例进行回顾性分析,均自愿接受FUAS治疗且依从性好。据术后应用药物不同分为:FUAS治疗组(A 组)、FUAS治疗+ LNG-IUS组(B组)和FUAS治疗+DNG组(C组),每组50例。本研究经医院伦理委员会批准。
1.2 入选和排除标准 入选标准:(1)符合《子宫腺肌病诊治中国专家共识》中子宫腺肌病诊断标准,并经MRI确诊;(2)有痛经、经期延长、月经量大等明显临床症状;(3)子宫肌壁单侧增厚为主、如前壁型、后壁型或局限性病灶(腺肌瘤);(4)MRI检查显示子宫内存在界线不清、信号强度低的病灶,T2加权像可有高信号强度的病灶,子宫内膜-肌层结合带变宽,>12 mm,且子宫肌壁厚度>30 mm;(5)在1年内局部病灶未接受过射频、介入等治疗;(6)2年内无生育要求者。排除标准:(1)合并阴道炎、盆腔炎、肿瘤等妇科或其他疾病;(2)月经期、哺乳期及孕产妇;(3)心脑血管、肝肾功能、造血功能、神经系统等严重功能不全;(4) 既往有结缔组织疾病; (5)存在麻醉禁忌证,依从性差,不能配合治疗。
1.3 方法 所有患者均进行FUAS治疗:采用重庆海扶技术有限公司研制JC-200型高强度聚焦超声肿瘤治疗系统,根据病灶范围制定消融计划,治疗功率350~400 W,以点辐照方式布点治疗病灶靶区。根据病灶和患者的反应来调整辐照参数,直至全部计划治疗区域出现满意的灰度变化,最后超声造影评价消融范围,满意后结束治疗。A组仅接受FUAS治疗;B组FUAS术后1周内在超声引导下放置LNG-IUS;C组FUAS术后3 d开始口服DNG,2 mg/次,1次/d,持续12个月以上。3组均连续观察12个月。
1.4 观察指标及疗效标准 分别在治疗前(T1)及治疗后3个月(T2)、6个月(T3)、12个月(T4) 时观察以下指标:(1)子宫体积、病灶体积,通过磁共振检查或超声检查结果进行测量并计算,子宫体积(cm3)=纵径×横径×前后径×0.523,病灶体积(cm3)=纵径×横径×前后径×0.523。(2)病灶消融率,腺肌病灶消融体积(cm3)=纵径×横径×前后径×0.523;消融率(%)=无造影剂灌注区体积/腺肌病灶体积×100%。(3)肿瘤标志物,采集静脉血放射免疫法检测患者血清糖类抗原125(CA125)水平。(4)痛经程度,采用视觉模拟(VSA)评分评价患者的痛经程度,0分为无疼痛;1~3分为轻度疼痛,可接受;4~6分为重度疼痛,勉强接受;7~10分为无法忍受,记录VAS分值。(5)贫血程度,检测静脉血血红蛋白(HB)的含量,评估贫血程度。(6)不良反应及并发症:骶尾部损伤、皮肤损伤、肠道损伤、阴道异常子宫出血、环异位、脱环、盆腔炎、头痛、便秘、恶心、潮热等。

2 结 果
2.1 一般资料比较 3组患者年龄、子宫体积、病灶体积和消融率差异无统计学意义(P>0.05,表1),具有可比性。3组共完成随访142例,A组入选44例,失访3例,行子宫切除术3例;B组入选48例,失访1例,行子宫病灶切除手术1例;C组入选47例,失访2例,未坚持服药1例。
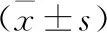
表1 3组子宫腺肌病患者一般资料比较
2.2 不同时间相关指标比较 与T1比较,3组患者T2-T4时,子宫体积、病灶体积均明显缩小,CA125水平明显降低,差异有统计学意义(P<0.05)。与A组比较,B、C组子宫体积、病灶体积T4时均明显缩小,CA125水平T3、T4时均明显降低,差异有统计学意义(P<0.05);且C组子宫体积T4时明显小于B组,CA125水平T3、T4时也明显低于B组,差异有统计学意义(P<0.05,表2)。
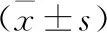
表2 3组子宫腺肌病患者不同时间点子宫体积、病灶体积、CA125水平的情况
2.3 VAS评分与HB数值比较 与T1比较,3组患者T2-T4时VAS评分均明显降低,HB均明显升高,差异有统计学意义(P<0.05);与A组比较,B、C两组VAS评分T4时明显降低,差异有统计学意义(P<0.05,表3),且C组VAS评分T4时明显低于B组,差异有统计学意义(P<0.05)。
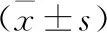
表3 3组子宫腺肌病患者不同时间点VAS评分与HB的情况
2.4 不良反应 3组均未发生皮肤损伤及肠道损伤等不良反应,未出现同床不适、潮热、恶心、呕吐等不适症状。3组均发生阴道不规则出血和骶尾骨疼痛,但差异无统计学意义,经对症处理6个月内消失。见表4。

表4 3组子宫腺肌病患者不良反应情况 (n;%)
3 讨 论
AM 是一种妇科常见的良性肿瘤,传统的治疗方式主要包括药物治疗或手术治疗[8]。药物治疗创伤最小,多以缓解临床症状、满足患者生育要求和帮助部分患者安全过渡到绝经期,免于子宫切除为目的,但长期服用药物,用量大,不良反应多,且停药后易复发[9]。子宫切除术对于有生育需求的育龄期妇女并不适合。有研究发现,FUAS 联合长期药物治疗在防治AM 复发方面具有一定的临床效果,但这些治疗措施的临床效果尚缺乏对比性的临床经验[10,11]。鉴于此,本研究比较了单纯FUAS 治疗、FUAS 联合LNG-IUS 和FUAS 联合DNG 治疗后患者子宫体积、病灶体积、CA125水平的变化,以及患者痛经程度和贫血状况的变化,探讨联合治疗方案对AM的治疗效果。
有研究表明,血清CA125水平可反映AM 病灶大小和范围,对AM 复发的监测具有重要价值,痛经缓解程度与血清CA125下降相关[12,13]。本研究结果表明,所有患者在FUAS 治疗后的12个月内,其子宫体积、病灶体积均较治疗前显著缩小,痛经程度和CA125水平明显降低,而且HB 明显上升,说明单纯FUAS 治疗和FUAS联合治疗方案均可以缓解痛经、贫血的临床症状,这也进一步证实了FUAS治疗AM 的有效性[3]。本研究还发现,C组治疗3个月后,子宫体积、病灶体积、CA125水平、VAS 评分明显低于A 组,在观察的12个月内子宫体积持续缩小,且CA125水平持续下降,并维持在正常水平。治疗后12个月,B、C两组子宫体积、病灶体积、CA125水平、VAS 评分明显小于A 组,说明FUAS 联合两种药物治疗在预防复发、缓解痛经方面均优于单纯FUAS 治疗。分析其原因可能与以下几点有关:(1)在预防复发方面,LNG-IUS 在宫腔内释放高浓度的左炔诺孕酮(LNG)能抑制子宫内膜中雌激素受体的合成[14],降低子宫内膜生长速度,从而降低病灶复发率;而DNG 则能同时抑制卵巢的内分泌功能以及子宫内膜细胞的增殖和纤维化的双重作用来降低子宫内膜的增殖速度,降低复发率,因此其效果更明显。(2)在缓解痛经方面,AM痛经的发生与异位病灶产生高浓度的前列腺素及炎症因子,导致的子宫痉挛性收缩有密切关系。宫腔放置LNG-IUS 后,局部释放的高浓度左炔诺孕酮可使异位的内膜蜕膜化和萎缩[15],还能降低子宫平滑肌对缩宫素的敏感性及兴奋性,降低子宫收缩的强度,减轻痛经的程度[14,15]; DNG不但可以通过降低内膜增殖速度,缓解由于纤维组织过度增殖和纤维化、瘢痕形成所引起的疼痛[16],还可通过抗炎和抑制新生血管形成发挥缓解疼痛的作用[17,18],作用更迅速更广泛。因此,FUAS 联合DNG治疗在缓解痛经和预防复发方面优于单纯FUAS 和FUAS 联合LNG-IUS。另外,由于DNG无蓄积性,对患者机体激素代谢影响较小,安全性较高[19],可以长期服用。但其价格较为昂贵,且部分患者依从性较差,提示临床制定AM 长期治疗方案时,除考虑患者年龄、子宫情况、卵巢储备功能、生育需求等因素外,还需要考虑患者经济状况、依从性等因素,尽量做到个体化和规范化治疗[10]。FUAS 联合LNG-IUS 组仅有2例在术后6个月发生脱环,其原因也与AM 患者在接受FUAS 治疗后,子宫体积逐渐缩小有一定的关系。
综上所述,FUAS治疗AM时,联合用药方式在防止复发、缓解症状方面效果更好,且以联合DNG药物治疗效果为佳,但不论选择何种治疗方式均应考虑到患者的依从性,以选择患者易于接受的治疗方式为前提。本研究还存在样本量较小、随访时间较短等问题,下一步将针对远期疗效及DNG对肝酶、血脂、血流变和骨密度影响等方面进行前瞻性研究。

