上尿路上皮癌肿瘤出芽与肿瘤相关中性粒细胞及患者预后的相关性研究
李光影 杨静
上尿路上皮癌(upper tract urothelial carcinoma,UTUC)是一种非常罕见的恶性肿瘤,且男性发病率高于女性[1]。目前对于治疗上尿路上皮癌的方法是肾输尿管切除、膀胱袖状切除加淋巴结清扫、术后膀胱灌注,但术后复发率高,预后较差。目前上尿路上皮癌评估预后的指标为脉管癌栓、远处转移等常规指标,这已不能满足临床医生对患者预后的评估,患者术后复发率及死亡率仍然较高,上尿路上皮癌需要更多可以提供早期诊断和评估预后的指标,因此探索上尿路上皮癌预后的特异性指标尤为重要[2]。
肿瘤出芽(tumor budding,TB)是指存在于恶性肿瘤的浸润边缘,散在的独个肿瘤细胞或≤4 个肿瘤细胞的细胞群。肿瘤出芽具有上皮-间充质转化的特点,它在恶性肿瘤早期的进展和转移中起着不可或缺的作用[3-4]。研究显示,肿瘤出芽还与结直肠癌、胃腺癌、食管癌、乳腺癌、胰腺癌等不良预后相关[5-10]。但是,肿瘤出芽在上尿路上皮癌中的研究鲜少,肿瘤出芽与上尿路上皮癌主要临床病理变化特征的关系,肿瘤出芽与上尿路上皮癌免疫微环境的关系,肿瘤出芽与上尿路上皮癌患者预后的关系都还未知。
在肿瘤微环境中,分布着一定数量的嗜中性粒细胞,它们在肿瘤微环境的维持及肿瘤进展中扮演了重要的“角色”[11]。肿瘤微环境中的嗜中性粒细胞通过分泌各种酶类物质、细胞因子及形成胞外网状结构等,促进肿瘤细胞的生长及侵袭,即肿瘤相关中性粒细胞(TANs)[12-13]。研究表明TANs 还与膀胱尿路上皮癌、结直肠癌等的进展有关[14-17]。但TANs 与上尿路上皮癌患者预后的关系,肿瘤出芽与TANs 之间的关系还不明确。本研究通过探讨肿瘤出芽与上尿路上皮癌主要临床病理特征,肿瘤出芽和TANs 之间的关系,肿瘤出芽和TANs 与上尿路上皮癌患者预后的关系,以期为评估上尿路上皮癌患者的预后提供可靠的指标。
1 资料与方法
1.1 一般资料 回顾性分析2016 年1 月-2020 年4 月锦州医科大学附属第一医院85 例手术切除上尿路上皮癌患者的临床资料,包括患者性别、年龄、肿瘤部位、pT 分期、组织学分级、肿瘤大小、脉管癌栓及神经侵犯等。纳入标准:(1)均经病理诊断为上尿路上皮癌;(2)所有患者术前均未接受放疗或化疗;(3)临床资料完整。排除标准:(1)合并膀胱癌;(2)既往有膀胱癌病史;(3)既往有其他肿瘤史;(4)术后30 d 内死亡。男51 例,女34 例;年龄45~89 岁,中位年龄为67 岁。所有患者术后均经电话的方式进行随访,术后第1 天开始随访,2 年内每3 个月随访1 次,2 年后每6 个月随访1 次,中位随访时间为23 个月(2~54 个月)。以患者复发、转移、死亡或随访截止日期2020 年10 月为截止点,在随访过程中失访或肿瘤未进展患者作为终点数据处理。本研究通过电话的方式获得了所有患者的知情同意,并得到了本院伦理委员会的批准。
1.2 方法
1.2.1 肿瘤出芽的判读 肿瘤出芽的评估标准参照2020 版结直肠癌诊疗指南中肿瘤出芽共识,定义为200 倍镜下存在于恶性肿瘤的浸润边缘,散在的独个肿瘤细胞或≤4 个肿瘤细胞的细胞群,分级标准为0~4 个肿瘤出芽为低级别、5~9 个肿瘤出芽为中级别、≥10 个肿瘤出芽为高级别[18]。在高倍镜视野(HPF)(×200)下,选取视野中最多数量的肿瘤出芽为最终数量。
1.2.2 免疫组织化学结果判定 使用购于Abcam 公司用于标记TANs 的CD66b 抗体,通过全自动免疫组化染色机染色经福尔马林固定常规石蜡包埋4 μm 切片制成的85 例患者的病理切片,被抗体标记的TANs 其主要着色于细胞膜和细胞质,呈黄褐色。由两名病理科医生经免疫组化染色联合HE切片观察TANs 数量,TANs 分为上皮TANs 和间质TANs,但是笔者发现上皮中的TANs 数量和肿瘤中心间质中的TANs 数量太少,所以笔者在400 倍镜下观察肿瘤浸润前沿间质TANs 数量,选取TANs最多的三个视野,求其平均值。浸润前沿(invasive tumor front,ITF)定义为肿瘤与正常组织或器官的交界区域,在肿瘤浸润边缘和邻近的非肿瘤性纤维脂肪基质之间的宽度约为1 mm[19]。
1.3 统计学处理 数据使用SPSS 21.0 进行处理分析,应用χ2检验分析肿瘤出芽水平与上尿路上皮癌临床病理特征的关系。采用Spearman 法探索TANs与肿瘤出芽的关系。Kaplan-Meier 进行生存分析,采用log-rank 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 上尿路上皮癌组织中肿瘤出芽及浸润前沿间质TANs 浸润情况 根据出芽共识,将85 例患者分为低-中级别出芽组和高级别出芽组。其中低-中级别出芽组72 例,高级别出芽组13 例。
在上尿路上皮癌浸润前沿间质中400 倍镜下观察到TANs 最多的三个视野并求其平均值,作为该病例TANs 的最终值,将所有病例的最终TANs数再平均,将平均值作为临界值(平均值为16),≤16 为低TANs 组,>16 为高TANs 组。上尿路上皮癌85 例患者,50 例为低TANs 组,35 例为高TANs 组。见图1。
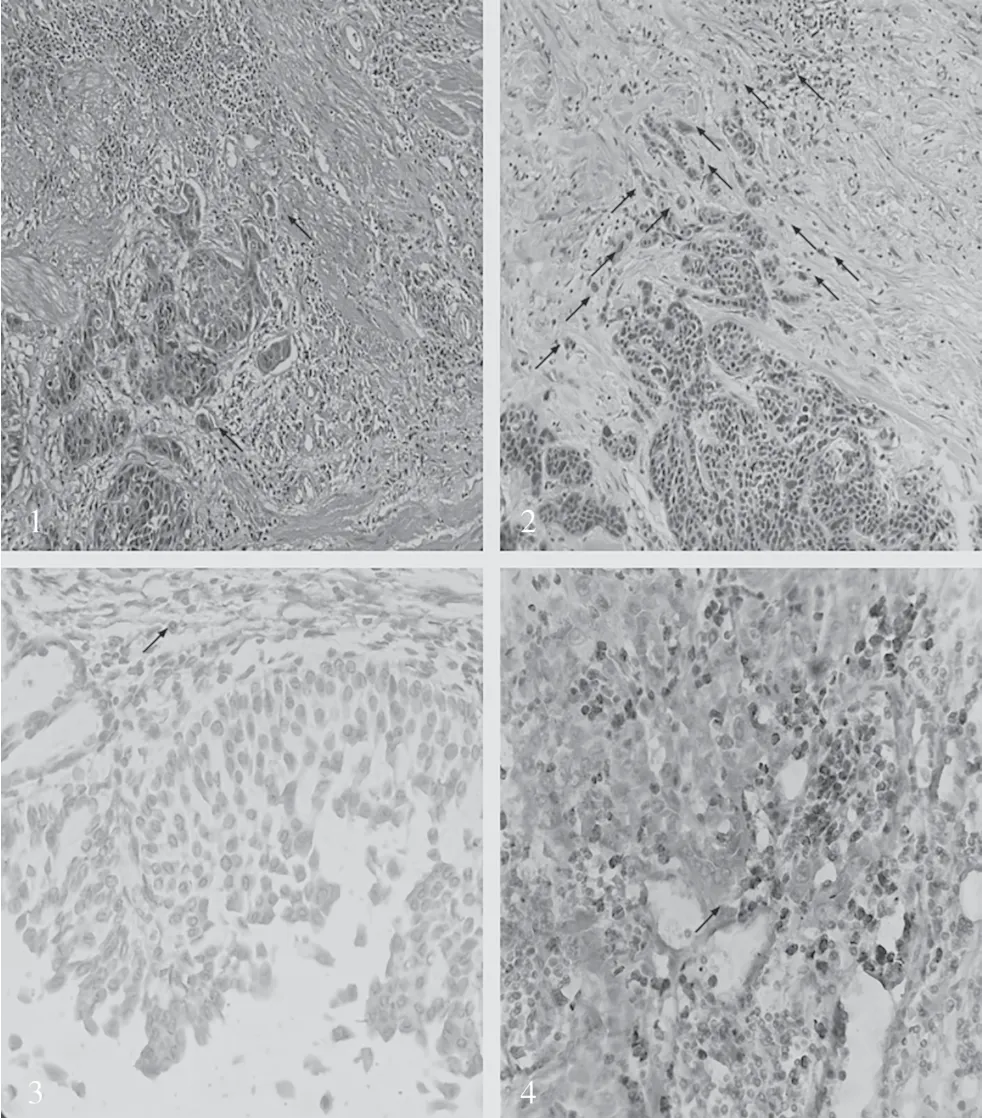
图1 镜下肿瘤出芽和TANs
2.2 上尿路上皮癌肿瘤出芽情况与上尿路上皮癌临床病理特征的相关性 通过对肿瘤出芽情况与上尿路上皮癌患者临床病理特征的研究发现,低-中级别出芽组和高级别出芽组患者的性别、pT 分期、肿瘤转移、脉管癌栓及神经侵犯情况比较,差异均有统计学意义(P<0.05)。低-中级别出芽组和高级别出芽组患者的年龄、肿瘤部位、组织学分级、肿瘤大小及复发情况比较,差异均无统计学意义(P>0.05)。见表1。
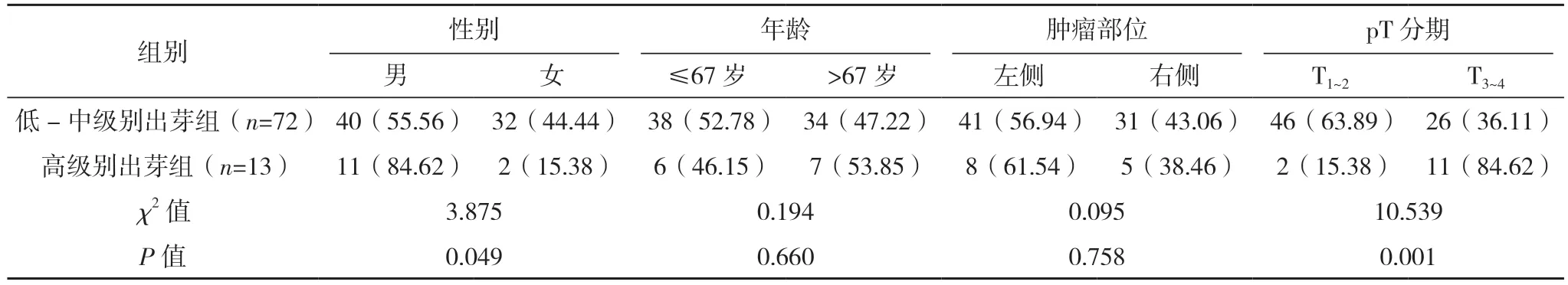
表1 不同肿瘤出芽级别与上尿路上皮癌患者临床病理的比较[例(%)]
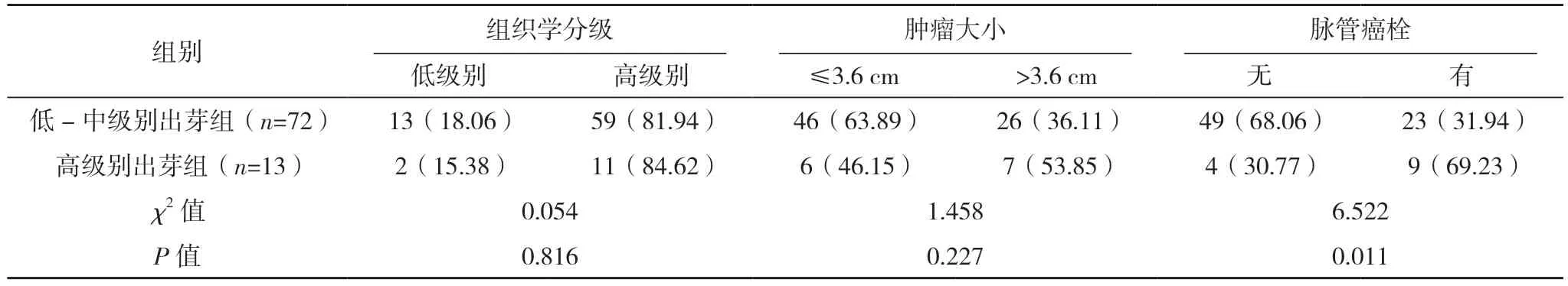
表1 (续)
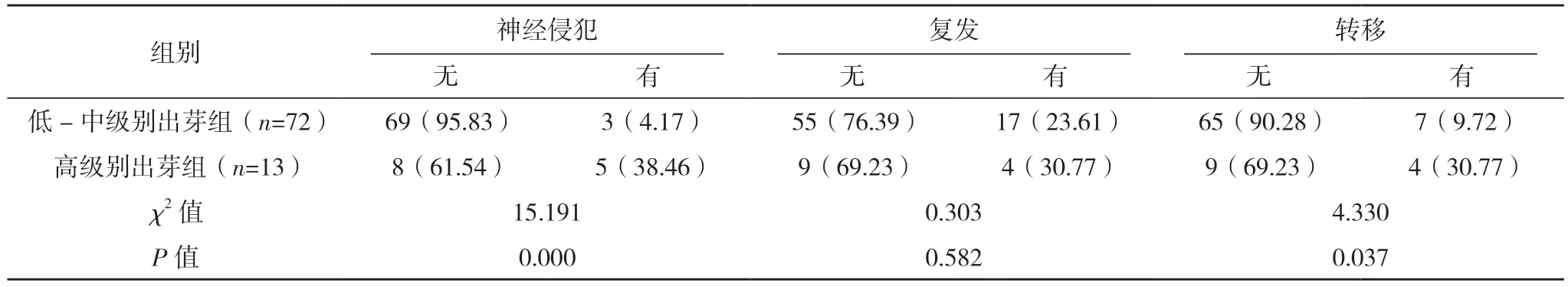
表1 (续)
进一步使用Spearman 法研究肿瘤出芽情况与TANs 水平之间的联系,发现肿瘤出芽情况与TANs的水平呈正相关(rs=0.215,P=0.048)。见表2。

表2 肿瘤出芽与TANs之间的关系(例)
2.3 上尿路上皮癌肿瘤出芽水平与患者预后的关系 经随访后,共有23 例患者死亡,其中低-中级别肿瘤出芽组中有16 例死亡,高级别肿瘤出芽组中有7 例死亡。进行生存分析后发现,低-中级别出芽组总存活率为77.8%(56/72),高级别出芽组总存活率为46.2%(6/13)。两组总存活率比较,差异有统计学意义(χ2=6.710,P=0.010),见图2A。共有31 例患者疾病进展,低-中级别肿瘤出芽组中有22 例疾病进展,高级别肿瘤出芽组中有9 例疾病进展。进行生存分析后发现,低-中级别出芽组无病生存率为69.4%(50/72),高级别出芽组为30.8%(4/13)。两组无病生存率比较,差异有统计学意义(χ2=10.334,P=0.001),见图2B。共有16 例患者因此病死亡,低-中级别肿瘤出芽组中有10 例因此病死亡,高级别肿瘤出芽组中有6 例因此病死亡。进行生存分析后发现,低-中级别肿瘤出芽组患者肿瘤特异生存率为86.1%(62/72),高级别肿瘤出芽组患者肿瘤特异生存率为53.8%(7/13)。两组肿瘤特异生存率比较,差异有统计学意义(χ2=7.809,P=0.005),见图2C。
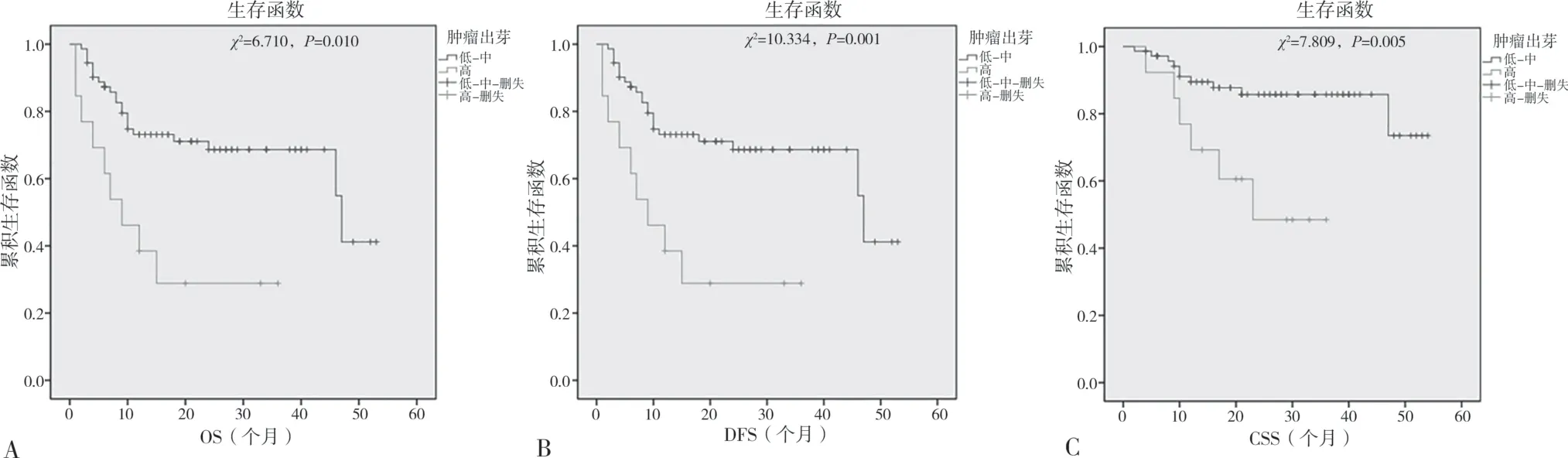
图2 Kaplan-Meier肿瘤出芽生存曲线图
2.4 上尿路上皮癌TANs 水平与患者预后的关系 经Kaplan-Meier 分析,低TANs 组36 例无疾病进展,无病生存率为72.0%(36/50),高TANs 组患者无疾病进展18 例,无病生存率为51.4%(18/35)。两组无病生存率比较,差异有统计学意义(χ2=8.113,P=0.004)。低TANs 组和高TANs 组总存活率、癌症特异生存率比较,差异均无统计学意义(P>0.05)。见图3。
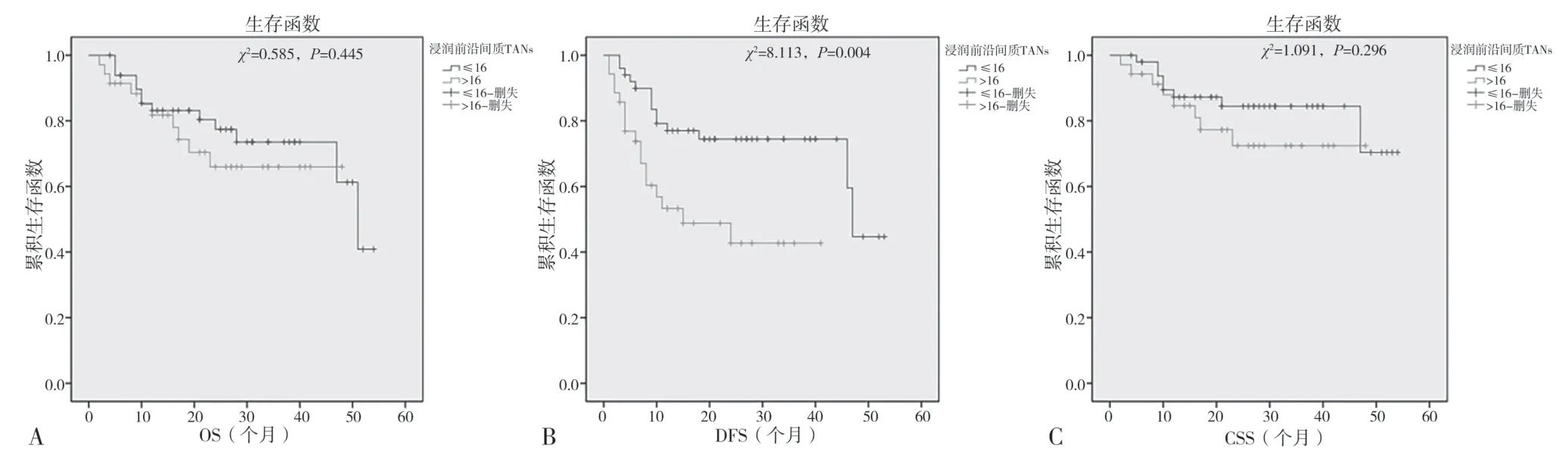
图3 Kaplan-Meier肿瘤出芽生存曲线图
3 讨论
本研究通过评估肿瘤出芽与上尿路上皮癌患者主要临床病理特征变化及预后之间的关系,发现相对于低-中级别出芽组,高级别出芽组患者多为男性、pT 分期较高、肿瘤容易转移、脉管癌栓及神经侵犯常见,预后较差;高TANs 水平患者的无病生存率低。笔者进一步研究了肿瘤出芽与肿瘤微环境中TANs 的关系发现,肿瘤出芽情况与TANs 水平呈正相关,即肿瘤出芽数量越多的患者TANs 水平越高,提示肿瘤出芽与TANs 之间可能存在某种关联,使之相互作用,进而影响上尿路上皮癌患者的预后。
既往研究证实,肿瘤出芽与结直肠癌、胃腺癌、食管癌、乳腺癌、胰腺癌等不良预后相关[5-10]。肿瘤出芽具有上皮间质转化的特征,它在恶性肿瘤早期的进展和转移中起着不可或缺的作用。而恶性肿瘤的转移不是单一的过程,是通过多种炎症细胞、细胞因子、各种信号通路等协作完成的,而这种协作又与肿瘤微环境息息相关。
目前有关上尿路上皮癌中肿瘤出芽的研究很少,仅有少数文献报道了肿瘤出芽与上尿路上皮癌临床病理特征及与患者预后的关系。Kawamura 等[20]发现高肿瘤出芽与辅助化疗状态、高病理T 分期、淋巴管浸润、淋巴结转移、肿瘤部位有关,多变量Cox 分析显示淋巴侵犯和高肿瘤出芽是尿路上皮癌复发的独立预测因子,高肿瘤出芽也是总生存率的独立影响因素。本研究收集了85 例患者临床资料及病理切片,发现肿瘤出芽与男性、高pT 分期、远处转移、多脉管癌栓和多神经浸润有关,但与年龄、部位、组织学分级、肿瘤大小及复发无关。
既往也鲜少有研究报道肿瘤出芽与上尿路上皮癌患者预后的关系,目前仅发现一篇,而其对肿瘤出芽的评估方法是在200 倍镜下,选取视野下最密集的肿瘤出芽数量,若TB 数量≥10 个为高肿瘤出芽,反之则为低肿瘤出芽,用这样的方法对肿瘤出芽与患者预后的关系进行评估[20]。本研究参照2020 版结直肠癌诊疗指南中肿瘤出芽共识,在显微镜下观察HE 病理组织切片,根据出芽共识对肿瘤出芽进行分级,分为低-中级别肿瘤出芽组和高级别肿瘤出芽组[18]。采用Kaplan-Meier 方法进行单因素生存分析和log-rank 检验,发现高级别肿瘤出芽上尿路上皮癌患者的预后较差,因此笔者推测肿瘤出芽可作为一个预测上尿路上皮癌患者预后的新指标。
笔者通过生存分析发现,上尿路上皮癌TANs作为肿瘤免疫微环境中的重要组成部分,与上尿路上皮癌患者预后相关,即较低的TANs 水平伴随着患者较高的无病生存期。近年来,肿瘤免疫微环境在肿瘤发生发展中的作用越来越受到重视。其中,间质内的TANs 是肿瘤免疫微环境的重要组成部分,是机体应对肿瘤产生反应的重要机制,TANs的数量能够在一定程度上反映机体对肿瘤的反应程度[21]。本研究发现上尿路上皮癌浸润前沿间质中的TANs 水平与患者较低的无病生存率有关,而既往无有关TANs 水平与上尿路上皮癌患者预后关系的报道。
在本研究中,笔者发现,肿瘤出芽的水平与浸润前沿间质TANs 的数量呈正相关,即肿瘤出芽数量越多的患者,浸润前沿间质TANs 数量越多,预后较差;肿瘤出芽越低的患者,浸润前沿间质TANs 数量越低,预后较好。提示上尿路上皮癌肿瘤出芽与浸润前沿间质TANs 相互作用,从而调控上尿路上皮癌的发展,影响患者预后。然而肿瘤出芽与TANs 之间的相互作用机制还未明确。有研究发现,肿瘤出芽的主要特征是上皮-间质转化,在肿瘤出芽上皮间质转化的过程中可引起肿瘤微环境的某些变化,如会产生和提高一些促肿瘤因子水平,如转化细胞生长因子、肝细胞生长影响因子、表皮生长因子等;而肿瘤微环境中的少氧状态、细胞因子、其他炎症细胞、炎症介质等又影响着肿瘤出芽的产生和上皮间质转化的过程[22-24]。而本研究发现在上尿路上皮癌中肿瘤出芽情况与微环境中的TANs 水平呈正相关,提示肿瘤出芽与TANs 之间可能通过某种信号通路、细胞因子联系在一起,但具体的细节还需继续深入探索。
综上所述,本研究发现上尿路上皮癌肿瘤出芽情况与浸润前沿间质TANs 呈正相关,表明了肿瘤细胞出芽和TANs 与上尿路上皮癌临床主要病理变化特征及预后的关系,为上尿路上皮癌诊治研究提供了潜在的指标。但肿瘤出芽与TANs 的判读尚缺乏统一标准,因此,两者是否能够用于临床还需更多的研究。

