长链非编码RNA在胶质瘤中的生物功能及临床意义
陈亮 许武
胶质瘤是神经系统(CNS)中最常见、最具侵袭性的恶性肿瘤,复发率高,死亡率高[1]。在世界范围内,每年有1 100 万人被诊断出患有癌症,2020 年这一数字达到1 600 万人[2-3]。然而,每年新诊断的胶质瘤患者约有20 万,且这一数字也呈逐年增加的趋势。2016 年,世卫组织建立了中枢神经系统肿瘤分子诊断的新概念,对弥漫性胶质瘤、髓母细胞瘤等胚胎肿瘤进行了重新分类,包括胶质母细胞瘤-IDH 野生型和IDH 突变型。弥漫性中线胶质瘤-H3 K27M 突变体;RELA 基因融合室管膜瘤;髓母细胞瘤-wnt 激活和sh 激活;C19MC 扩增多层菊簇胚胎瘤[4-6]。目前在手术切除、放疗、化疗等多模式治疗方面取得了一定的进展,但胶质瘤患者的总体生存率仍然偏低,特别是胶质母细胞瘤,其中位生存时间仅为14 个月左右[7]。
神经胶质瘤和其他肿瘤一样,是一种遗传性疾病。负责神经胶质瘤发展的基因分为两类:原癌基因和抗癌基因。一些致癌基因已经被发现,包括EGFR[8-10],bFGF[11-13]和PDGF[14-15]。一些抑癌基因也被发现,包括功能基因p53[16]、PTEN[17-18]、Rb[19]和e2f-1[20-21]。为了更好地理解和找到更有效的治疗方法,识别新的生物标志物和治疗靶点是很重要的。最近的研究表明,整个人类基因组中只有一小部分(2%)基因编码蛋白质,而大部分基因组是非编码基因[22]。根据核苷酸的长度,将lncRNAs 分为短非编码RNA 和长非编码RNA(lncRNAs)。虽然非编码RNA 不能直接翻译蛋白质,但它们在转录和翻译中发挥着重要作用。短的非编码RNA 在200个核苷酸范围内,包括微RNA、线粒体RNA、转移RNA 等。lncRNA 的长度超过200 个核苷酸,可通过表观遗传水平、转录和转录后修饰参与调控胶质瘤的发生发展,并发挥独特而重要的分子生物学作用[23]。
本综述拟对lncRNA 在胶质瘤中发生发展中的分子生物学机制做一个探讨,以及对lncRNA 的在胶质瘤研究中的临床意义做一个回顾和展望。
1 长链非编码RNA的生物学概述
人类基因转录组的复杂性推翻了传统上对RNA潜能的认识,大量的lncRNAs 逐渐被认识到在转录中发挥着极其重要的作用[24-25]。到目前为止,编码项目(GENCODE V26)已经保守地标记了近16 000个人类lncRNA 基因,这些基因产生超过28 000 种不同的转录本。此外,蛋白质编码基因也可以产生缺乏编码能力的转录变异,从而增加细胞中非编码转录本的数量。lncRNAs 是一种非蛋白质编码的转录本,其长度从近200 个核苷酸(NT)到超过100 kB 的不等[26]。根据lncRNA 不同的基因组位置和背景,可以将其分为五类:(1)正义性,由蛋白质编码基因的有意义链转录而来;(2)反义,由相反的mRNA 转录而来;(3)蛋白质编码基因内含子转录的内含子;(4)基因间,由基因间区域转录而来;(5)在正义转录和反义转录的起点或附近的双向、双向传输[27]。许多被鉴定的lnc RNA 定位于细胞核和细胞质[28]。在过去的几十年里,lncRNA 被认为是转录生物学噪音[29]。然而,最近的研究表明,lncRNAs 参与多种生物学过程,甚至可能在包括癌症在内的多种疾病的发生发展中发挥重要作用[30-31]。lncRNAs 主要通过三种机制调控胶质瘤细胞的基因表达:表观遗传调控、转录调控及与miRNA 的相互作用调控。(1)表观遗传调控:自从发现lncRNA 可以调控基因表达以来,研究者已经认识到lncRNA 可以在表观遗传水平调控基因表达。基因表达的表观遗传调控在胶质瘤的发病机制中起着重要作用。表观遗传学的定义之一是神经胶质瘤中的DNA 甲基化。多项研究表明,lncRNA 参与了促进胶质瘤发病的基因的表观遗传调控。例如,lncRMA-POU3F3 表达水平的改变可以调控POU3F3基因[32]的甲基化。最著名的lncRNA 表观遗传基因调控因子是HOTAIR。HOTAIR 间接沉默HOXD 基因涉及通过上调染色质修饰物,将复合体PRC2 转运到HOXD 基因簇,复合体三甲基化染色质沉默HOXD 基因的表达[33-35]。lncRNA Xist 可促进染色质表达,修饰DNA/RNA 和组蛋白状态[36]。(2)转录水平调控:lncRNA 也被证明可以通过与转录因子复合物来控制基因转录活性和修饰RNA 活性。例如,lncRNA TSLC1-as1 是反义抑癌基因TSLC1 的转录产物,该基因通过TSLC1 mRNA 沉默TSLC1的表达。TSLC1-as1 也与其他肿瘤抑制因子呈正相关,包括BRAF,而BRAF 与NF1、VHL、PIK3R1呈负相关[37]。除了复杂的转录因子外,lncRNAs还可能通过参与其他RNA 调控过程(包括基因剪接、RNA 编辑甚至蛋白质翻译)而导致胶质瘤。例如,lncRNA HULC 沉默降低了分子真核起始因子4E(eIF4E),从而调节其他抑制血管生成的蛋白[38]。(3)与miRNAs 的相互作用调控:一些lncRNA 可以与miRNAs 相互作用,从而阻止miRNAs 与其靶mRNA 相互作用。例如lncRNA NEAKT1 通过调节mir-449b-5p 促进胶质瘤的发生[39]。根据竞争内源性RNA(competing endogenous RNA,ceRNA)假说,lncRNAs 也可以影响控制micRNA 的靶基因的表达。在胶质瘤和正常组织中,一些lncRNAs 可以与miRNAs 相互作用,从而阻止miRNAs 与其靶mRNA相互作用。敲除lncRNA XIST 可通过上调Mir-152抑制人胶质母细胞瘤中的肿瘤干细胞[36]。研究人员发现,lncRNA 胶质瘤抑瘤基因CASC2 过表达显著降低了Mir-21 的表达,并且argonaute2 介导的CASC2 与Mir-21 之间存在相互抑制[40]。lncRNAmiRNA 交互作用见表1[41]。
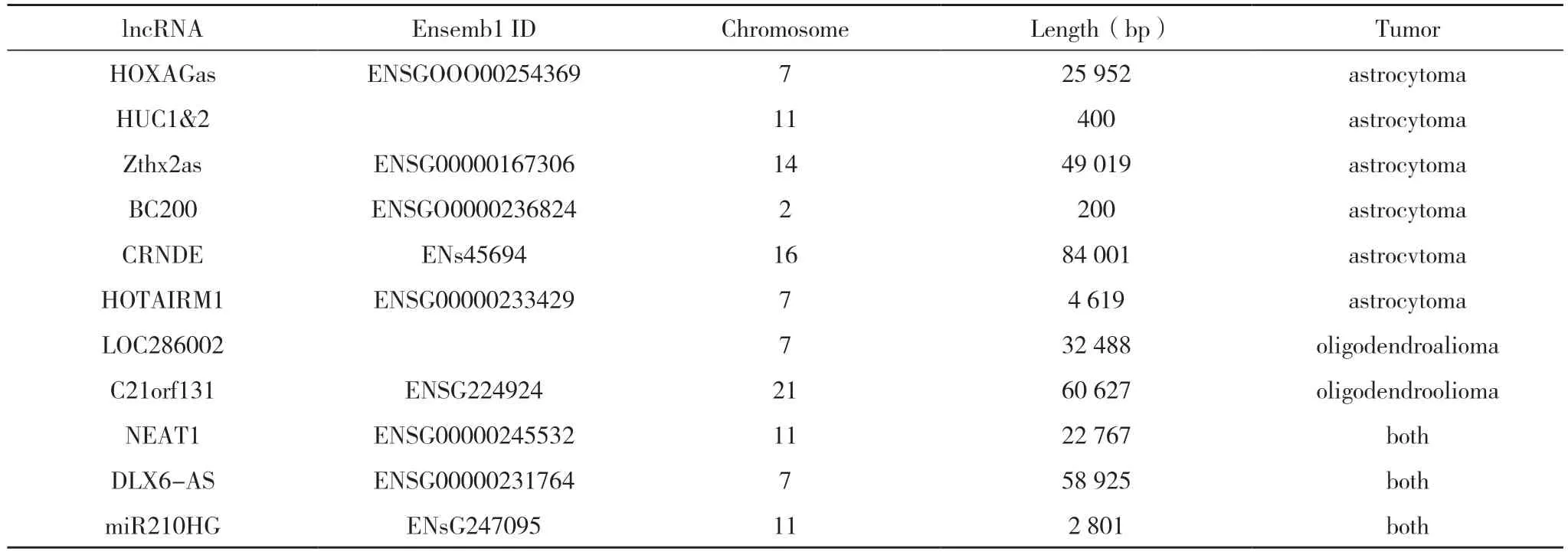
表1 lncRNA-miRNA交互作用机制
2 长链非编码RNA在脑胶质瘤中的分子生物学作用
lncRNAs 在肿瘤发生发展中发挥抑癌基因和癌基因的作用,从而影响肿瘤表型、临床病理表现和预后[42]。了解lncRNA 在胶质瘤中的主要生物学作用,对于充分了解胶质瘤的发生、发展和临床治疗具有重要意义。
2.1 长链非编码RNA 提高恶性脑胶质瘤的发生率及迁移、侵袭能力 H19 是通过诱导micRNA-675表达,促进胶质瘤细胞侵袭而上调的原癌基因[43]。POU3F3 作为一种高度保守的功能翻译调节因子,在脑胶质瘤的发展中显著升高[32]。它的两个目标基因lncRNA ASLNC22381 ASLNC20819 igf-1 基因,导致下游信号转导级联效应和igf-1 活性细胞增殖和生存能力通过绑定的igf-1 受体相关器,这个分子机制可能在神经胶质瘤的发生和发展中发挥重要作用[44]。一些lncRNA 可以与miRNA 相互作用,从而阻止miRNA 与其靶mRNA 相互作用。如lncRNA NEAKT1 通过调控mirror-449b-5p 促进胶质瘤发展[39]。Cao 等[45]发现lncRNA GHET1 过 表达促进了胶质瘤U251 细胞的生存、迁移和侵袭。过表达GHET1 后,上调前周期基因(cyclin D1、CDK4、CDK6)和转移前基因(MMP-9、vimentin)lncRNA GHET1 过表达通过下调Mir-216a 激活JAK2/STAT3和p53/survivin 信号通路促进胶质瘤进展。
lncRNA PVT1 是一个已被报道在许多肿瘤中高表达的致癌基因,包括人类胶质瘤、胃癌和非小细胞肺癌。lncRNA PVT1 的下调可负性调控Mir-424,抑制人脑胶质瘤细胞的活性、迁移和侵袭能力[46]。lncRNA tp73-AS1 表达增加与患者生存不良相关。下调tp73-AS1 抑制细胞增殖和侵袭过程,高迁移率组中Box1(HMGB1)的表达通过靶向mir-142在包括癌症在内的许多疾病中发挥重要作用[47-49]。mir-142 表达的降低与RAS 相关的C3 肉毒毒素底物1(Rac1)水平的升高相关,Rac1 激活多种细胞通路[50]。lncRNA ECONEXIN 在胶质瘤组织中上调,促进细胞增殖,吸附细胞转染Mir-411-5p 后改变拓扑异构酶2α(TOP2A)基因表达[51]。
2.2 长链非编码RNA 减缓或抑制脑胶质瘤恶性进展 lncRNA MEG3(母源表达基因3)随着胶质瘤的进展而下调。MEG3 过表达可抑制胶质瘤细胞的生长和增殖,促进细胞凋亡[52-53]。Wang 等[40]证实了CASC2 在人类胶质母细胞瘤中的低表达。其过表达可抑制胶质瘤细胞的增殖、迁移和侵袭,促进肿瘤细胞凋亡。此外,生物信息学、荧光素酶报告法和PULL DOWN 法分析了CASC2 与micRNA-21的内在关系,发现micRNA-21 以序列特异性的方式与CASC2 结合,并通过micRNA-21 产生负调控作用。lncRNA MDC1-AS 表达降低可通过MDC1 诱导细胞增殖,但具体机制尚不清楚[54]。TSLC1-AS1是肿瘤抑制基因肺癌1(TSLC1)的反义调控因子。因此,TSLC1 抑制细胞生长的确切途径尚不清楚[37]。此外,对ADAMTS9-AS2 的表达形式知之甚少,它在胶质瘤中表达下调,并与胶质瘤分级相关。结果表明,过表达ADAMTS9-AS2 可抑制细胞迁移和侵袭[55]。神经胶质瘤中长链非编码RNA 表达的上调和下调在生物进程中的影响见图1[56]。
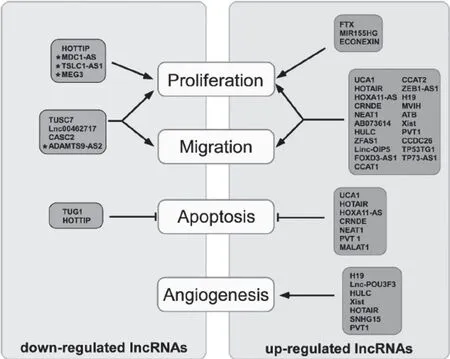
图1 lncRNA在胶质瘤分子生物进程中的表达及影响
3 研究lncRNA对于胶质瘤的临床意义
3.1 长链非编码RNA 作为诊断及治疗胶质瘤的靶点 许多lncRNAs 可以通过敲除或过表达某些基因,改变胶质瘤的表达水平,抑制胶质瘤的发生和发展。这些lncRNA 有望成为未来临床药物治疗的分子靶点。中国人群胶质母细胞瘤研究显示HOTAIR过表达与患者预后呈负相关,动物模型显示,抑制HOTAIR 可抑制胶质母细胞瘤多形性细胞的侵袭转移[57]。如果在细胞内敲除HOTAIR,就会发生抑制胶质瘤细胞发育的生物学行为,而这一过程可能受到micRNA-326 的调控[35]。TSLC1 是一种肿瘤抑制基因,通过下调甲基化作用在胶质瘤的发生发展中发挥重要作用。抑制或敲除TSLC1 可加速胶质瘤细胞的增殖和转移,而上调TSLC1 则相反。根据这些分子生物学作用机制,TSLC1 是一种潜在的临床分子治疗靶点[58]。关于外周血组织血液样本中循环lncRNAs 的诊断潜力的研究发现,在28 个肿瘤组织样本中,有80 例lncRNAs 的表达不同于正常组的10 例[59]。经过几轮筛选,根据观察到的变化及其与BMP1 的结合能力,选择miR210HG 作为进一步研究的材料。检测到稳定的miR210HG,所有血清样本均来自10 名胶质瘤患者和10 名健康志愿者。miR210HG 在胶质瘤患者血清中的表达水平普遍较高,在高危人群(WHO Ⅲ或Ⅳ)中表达水平也较高,作为胶质瘤的生物标志物,miR210HG 的敏感性为86.21%,特异性为72.41%。表2 总结了lncRNA 在胶质瘤中的潜在诊断标志物[60]。
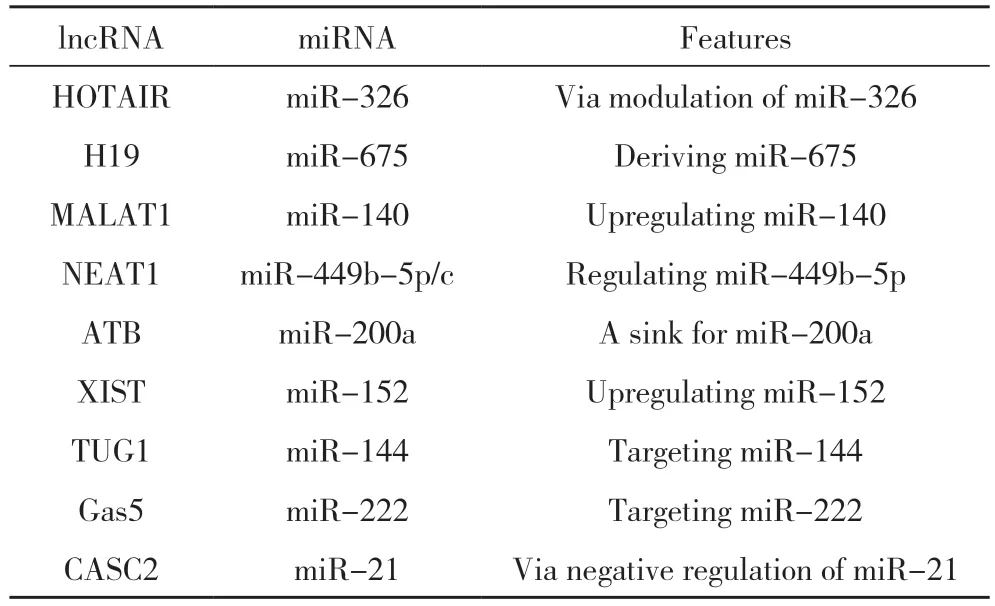
表2 lncRNA作为神经胶质瘤潜在诊断标记物
3.2 长链非编码RNA 与胶质瘤化疗耐药 化学疗法是治疗胶质母细胞瘤的一种常用的有效方法。然而,多药耐药(MDR)在很大程度上导致了化疗的无效[61]。替莫唑胺(Temozolomide,TMZ)是一种烷基化剂,是治疗胶质母细胞瘤的最常用的化疗药物[62]。Li 等[63]研究表明,在U251/TMZ 和U87/TMZ 细胞系中上调MALAT1,增强了细胞对TMZ的敏感性,下调了ZEB1 蛋白的表达。MALAT1 与MDR 相关蛋白表达、细胞活力和EMT 状态相反。在体内,MALAT1 过表达增强肿瘤对TMZ 的耐药性。KIAA0495/PDAM 在少突胶质细胞瘤中普遍低表达,动物实验证实该基因可诱导肿瘤细胞对顺铂产生耐药性,从而可以证实KIAA0495/PDAM 通路可能在少突胶质细胞瘤的分子发生发展中发挥着重要的作用。因此,可以根据该作用机制设计分子靶向治疗的靶点[64]。
3.3 长链非编码RNA 在胶质瘤放疗中的作用 放疗是胶质瘤的常规治疗方法,放疗的敏感性是影响胶质瘤治疗效果的关键。长链非编码RNA 作为调控各种生物过程的关键分子,在疾病的发生、发展和发病机制中发挥着重要作用。Aryankalayil 等[65]鉴定了几种辐射诱导的lncRNAs、已知的DNA 损伤反应和免疫反应。肿瘤蛋白53(tumor protein 53,P53)的长链非编码RNA 靶点、Trp53cor1、Dino、Pvt1 和Tug1 及P53 的上游调控因MEG3 辐射而发生 改变。Gm14005(Morrbid)和Tmevpg1 受不同时间点和剂量的辐射调节。这两种lncRNA 都具有作为血液辐射生物标志物的重要潜力。HMMR是一种在胶质母细胞瘤(GBM)中高度表达并促进GBM生长的癌基因。lncRNA 是否在GBM 中调控HMMR 尚不清楚。Li 等[66]发现HMMR 反义lncRNA HMMR-AS1 在GBM 细胞系中高表达,并稳定了HMMR mRNA。HMMR-AS1 的缺失可以降低HMMR 的表达。抑制细胞迁移、侵袭和间充质表型;在体内外抑制GBM 细胞的生长。此外,HMMR-AS1的表达通过降低DNA 修复蛋白ATM、RAD51 和BMI1 的表达降低了GBM 的放射敏感性,提示靶向HMMR-AS1 是GBM 治疗的一种潜在策略。lncRNA在胶质瘤放疗中具有双重作用。通过研究放疗抵抗的形成机制,不仅可以加强对肿瘤细胞中相关分子通路的了解,还可以找到有效的对策,从而提高胶质瘤放疗的临床效果。
3.4 长链非编码RNA 与胶质瘤患者预后的相关性 MALAT1 在胶质瘤患者中的表达水平高于健康成人。其表达水平不仅与胶质瘤的分级、大小呈正相关,而且与胶质瘤患者的总生存期呈正相关,可作为预测胶质瘤患者生存及预后的分子标志物[67]。其他可用于预测患者预后的分子标志物包括HOTAIR、HOXA11-AS 和NEAT1,其 中HOTAIR与胶质瘤的病理分级、分子分型和预后有关[33]。HOXA11-AS 是一种影响周期的lncRNA,从HOXA转录的5’端转录而来,可作为胶质瘤进展的分子标志物[68]。高级别胶质瘤中NEAT1 表达显著上调,且NEAT1 的表达与化疗后患者的生存有关[69]。Hu 等[70]发 现lncRNA AB073614 在65 例胶质 瘤标本中过表达,而在13 例非肿瘤标本中没有过表达。与低级别胶质瘤相比,高级别胶质瘤上调更多。Kaplan-meier 分析和log-rank 分析显示,AB073614表达与总生存期相关,是胶质瘤潜在的阴性预后生物标志物。此外,RP11-838n2.4 下调与TMZ 耐药及不良预后呈正相关[71]。Zhi 等[72]发现3 个肿瘤组织样本(WHO 分级Ⅱ~Ⅳ级)与3 个正常大脑样本相比,有59 个lncRNAs 存在差异表达,符合所选标准。用QRT-PCR 检测130 个星形细胞瘤和60 个正常癌旁组织的lncRNA。发现星形细胞瘤的高临床分期与高lncRNAs 表达水平ENST00000545440 和NR_002809 相关。NR_002809 高表达、BC002811、XLOC-010967 低表达与胶质瘤患者不良预后及生存显著相关。通过对低级别胶质瘤患者进行这些lncRNA 生物标志物检测,可准确应用该lncRNA 信号预测生存率,而无需再使用通常难以获得的正常脑组织。未来将在更大队列中进行具有综合临床信息的实验,以期验证lncRNA 信号的作用。
3.5 长链非编码RNA 与胶质瘤血管生成的相关性 恶性肿瘤的一个主要特征是肿瘤的血管化和连续血管生成[73]。胶质母细胞瘤是所有实体瘤中血管性肿瘤最多的,因此血管连续生成被认为是胶质母细胞瘤进展的最主要特征。虽然缺氧是最常见的血管形成的促进因素,但有证据表明,非缺氧机制可以驱动血管生成[74-76]。血管生成的主要作用是在氧气条件下降低血管内皮生长因子(VEGF)的表达。胶质母细胞瘤细胞缺氧反应的显著特点是缺氧诱导因子(HIF-1)和VEGF 的高水平表达[77]。转录因子HIF-1 调控约60 个基因参与厌氧糖酵解、代谢、血管生成、转移和EMT 通路[78]。而在常氧状态下,胶质瘤细胞的血管生成是通过激活PI3K/Akt/mTOR通路实现的。激活富含丝氨酸/精氨酸的剪接因子激酶1(SRPK1)通过调控Akt 磷酸化和VEGF 剪接与正常氧气条件下胶质瘤的血管生成相关[79]。lncRNA-pou3f3 可以装载到外泌体中,转移到内皮细胞中,诱导新血管的形成[32]。Lang 等[80]研究表明lncRNA-POU3F3 高表达可诱导bFGF、VEGFA、bFGFR 和Angio 基因的血管生成。lncRNA HULC 表达上调ESM-1 基因,诱导内皮细胞特异性分子1 的表达。ESM-1 被认为是血管生成的分子标记物。它由VEGF/PI3K 通路的表达激活[38]。
3.6 长链非编码RNA 与胶质瘤血脑屏障的调节 血液肿瘤屏障(blood tumor barrier,BTB)的存在是影响胶质瘤治疗效果的原因之一。这一过程依赖于紧密连接蛋白,如cloudin 和occludin,以及含有由细胞质支架组成的ZO 蛋白的多蛋白复合物的共同作 用[81-82]。Ma 等[83]研究发 现,lncRNA MALAT1的表达受到抑制,BTB 通透性增加,紧密连接蛋白表达降低。此外,MALAT1 是Mir-140 的作用靶点,同时也调控BTB 的通透性和紧密连接蛋白的表达水平。MALAT1 与Mir-140 的表达水平呈负相关。Ma 等[83]发现Mir-140 作用的另一个靶基因是NFYA 基因,它作为转录因子调控ZO-1、Occludin和Claudin-5 等的表达。lncRNA NEAT1 的低表达与Mir-181D-5p 的升高有关,Mir-181D-5p 的 升高反过来调控BTB 的通透性,并通过SOX5 调控ZO-1、Occludin 和Claudin-5 的表达[84]。lncRNA TUG1 表达下调后,BTB 通透性升高,BTB、ZO-1、Occludin、Claudin-5 表达降 低。lncRNA TUG1 受到与Mir-144 竞争紧密连接蛋白表达的调控,抑制热休克转录因子2(HSF2)的表达,HSF2 是紧密连接蛋白的转录因子,lncRNA TUG1、Mir-144 和HSF2 之间的关系也在动物模型系统中得到证实[85]。lncRNA HOTAIR 和XIST 的表达降低,mir-148b-3p 和mir-137 的表达增加,导致BTB 的通透性增加,紧密连接蛋白zo-1、zo-2 和occludin 的表达降低[86]。lncRNA MEG3 的差异表达通过PIWI1/MEG3/Mir-330/RUNX3 轴增加BTB 的通透性,从而影响胶质瘤细胞的分子发生发展[87]。以上这些研究提示lncRNA 作为调节血脑屏障的潜在基因靶点,应该得到临床更广泛的研究,为脑胶质瘤的治疗提供新的手段。
4 结语与展望
尽管现代手术和放射疗法取得了重大进展,但胶质瘤,尤其是胶质母细胞瘤,仍然是最致命的肿瘤之一,未来需要开发更有效的治疗方法。lncRNA有望成为一种有效的靶向治疗手段,利用所有非编码RNA 的完整网络参与胶质瘤的形成和进展,可以补充其他治疗机会,如免疫治疗、基因治疗等。lncRNA 在文献中已被广泛报道,但大部分lncRNA的功能未被报道,其在胶质瘤中的确切生物学作用也不甚了解。通过高通量基因组学、转录组研究和计算生物信息学分析等先进技术的应用,基于肿瘤生物学发现新的胶质瘤治疗靶点和用于患者分子诊断的新的生物标志物是至关重要的。
综上所述,lncRNA 可以成为胶质瘤重要的基因靶向治疗手段。随着RNA 干扰技术等现代技术的发展,lncRNAs 在胶质瘤分子进化中的确切作用将会继续被阐明,相信在不久的将来,lncRNAs 可能会彻底改变胶质瘤的诊断和治疗模式。

