非增生型糖尿病视网膜病变患者眼部血流动力学指标与中心视网膜厚度的关系△
韩秀香 刘加勇 王艳宾
糖尿病视网膜病变(DR)是糖尿病的常见眼部并发症之一,其主要病理特征是视网膜血管改变[1]。临床上根据疾病严重程度将DR分为非增生型DR(NPDR)和增生型DR,其中NPDR是DR的第一阶段,发病率约为15.06%[2]。NPDR主要表现为视网膜血管损伤、血管通透性增加、基底膜增厚及视网膜毛细血管周细胞丢失,长此以往可造成视力进行性下降甚至失明[3]。在DR发生发展过程中眼部血流动力学改变在其中发挥重要作用,血流参数的改变对DR患者具有早期预警和筛查作用[4]。有研究指出,视网膜厚度变薄是DR发生的保护因素,其机制可能与眼部血流动力学改变有关[5]。由于研究手段的限制,既往关于眼部血流动力学与NPDR患者中心视网膜厚度的相关性研究鲜有报道,而随着全数字化彩色多普勒超声诊断仪及OCT等精细化仪器的更新换代,使得上述研究成功的可能性大大提高。本研究采用眼部彩色多普勒超声诊断仪和OCT探讨NPDR患者眼部血流动力学指标与中心视网膜厚度的关系。
1 资料与方法
1.1 一般资料选取2019年8月至2021年10月在我院糖尿病视网膜病科就诊并确诊为NPDR的患者208例(208眼),其中男112例(112眼),女96例(96眼);患者年龄46~68(57.76±5.45)岁。
1.2 患者纳入和排除标准纳入标准:(1)2型糖尿病诊断依据参考文献[6]中的相关标准;(2)NPDR诊断依据参考文献[7]中的相关标准并经荧光素眼底血管造影检查确诊;(3)患者既往无眼部手术史及眼外伤史;(4)未患有高血压、心脑血管疾病、甲亢等其他影响眼部血流动力学改变的疾病;(5)具有正常的表达沟通能力;(6)入组前近1个月未服用影响血流动力学的药物。排除标准:(1)诊断为1型糖尿病或处于2型糖尿病增生期病变者;(2)合并颈部或脑部等明确的影响眼部血流动力学疾病者;(3)视网膜有明显水肿、渗出及出血等影响眼部血流动力学症状者;(4)合并严重的眼表疾病、全身免疫性疾病、器官功能障碍或恶性肿瘤者;(5)拒绝参与本研究或中途退出者。本研究经医院伦理委员会批准,遵循《赫尔辛基宣言》所要求的伦理学原则,患者均知情并签署知情同意书。
1.3 患者分组根据黄斑及周围视网膜正常厚度参考值[8]将所有患者分为中心视网膜厚度正常组(216.4~<304.5 μm)88例(88眼)、中心视网膜变薄组(<216.4 μm)56例(56眼)和中心视网膜增厚组(≥304.5 μm)64例(64眼)。
1.4 检查方法采用OCT测量患者中心视网膜厚度,眼部彩色多普勒超声诊断仪测得患者完整的眼部血流动力学指标;所有患者均行屈光度、眼压、裂隙灯、眼前节及眼底等常规眼科检查。采用OCT(德国Zeiss公司)测量患者黄斑中心区1~6 mm直径范围的中心视网膜神经上皮层厚度。测量方法:通过注视OCT系统设定的内视标,确定受检眼的黄斑中心注视点,进行线性扫描(间隔45°,中心为固定4 mm的扫描线和黄斑中心注视点)和图像采集(每眼采集4幅图像)。采用OCT测量患者视网膜神经上皮层厚度,测定位置选取黄斑中心注视点向两侧距中心注视点1.0 mm、>1.0~1.5 mm、>1.5~3.0 mm处鼻侧、上方、颞侧、下方各点。采用西门子Sequoia全数字化眼部彩色多普勒超声诊断仪测量患者眼动脉(OA)、视网膜中央动脉(CRA)及睫状后短动脉(PCA)的血流动力学指标。测量方法:探头频率10~13 MHz,按血流行走方向矫正多普勒角<20°,患者取仰卧位,双眼自然闭合,涂耦合剂,将探头放置于上眼睑行水平扫描,于偏鼻侧球后壁10~25 mm视神经暗区内测得OA血流频谱;在眼球与视神经暗区交界处向后2~3 mm处能探及CRA彩色图像并进行定位,测得CRA的各血流参数值;在视神经两侧距球后壁3~5 mm条带状低回声区(视神经)的鼻侧和颞侧测得PCA血流频谱。对三个部位血管的彩色图像进行定位,分别测得OA、CRA及PCA相关的血流动力学指标,包括收缩期血流峰值速度(PSV)、搏动指数(PI)和阻力指数(RI)。所有检查均由同一位经验丰富的医师在相同的初始条件下以相同的扫描方式操作完成,所有指标检测3次,取平均值。

2 结果
2.1 三组患者一般资料比较三组患者性别、年龄、糖尿病病程、体重指数比较,差异均无统计学意义(均为P>0.05)(表1)。
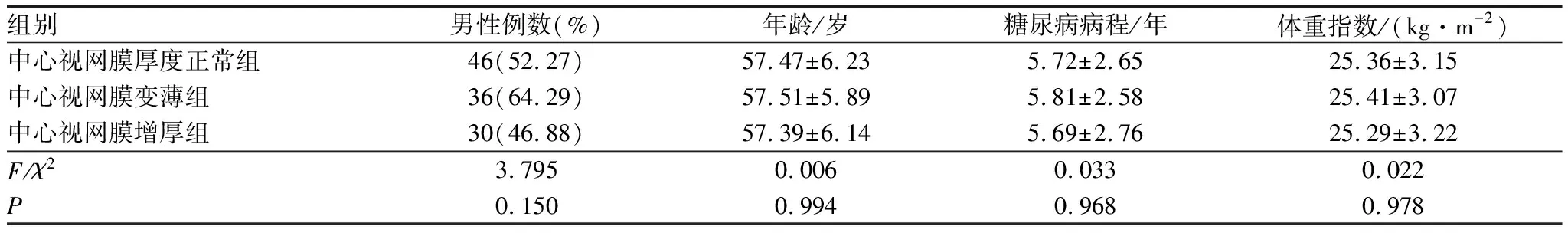
表1 三组患者一般资料比较
2.2 三组患者OA、CRA、PCA血流动力学指标比较三组患者OA、CRA、PCA血流动力学指标PSV、PI、RI比较,差异均有统计学意义(均为P<0.05);中心视网膜增厚组患者OA、CRA、PCA的PSV均小于中心视网膜厚度正常组,PI和RI均大于中心视网膜厚度正常组,差异均有统计学意义(均为P<0.05)。中心视网膜变薄组患者OA、CRA 的PSV、PI、RI均小于中心视网膜厚度正常组(均为P<0.05);PCA的PSV大于中心视网膜厚度正常组,PI、RI均小于中心视网膜厚度正常组(均为P<0.05)。中心视网膜增厚组患者OA、CRA、PCA的PSV均小于中心视网膜变薄组,PI和RI均大于中心视网膜变薄组,差异均有统计学意义(均为P<0.05)(表2-表4)。

表2 三组患者OA血流动力学指标比较
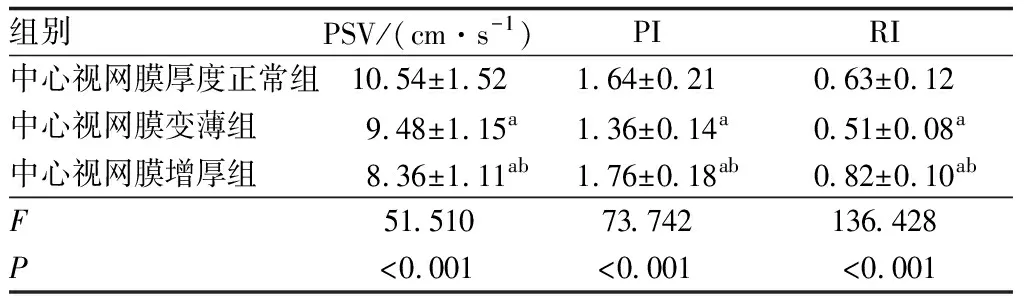
表3 三组患者CRA血流动力学指标比较

表4 三组患者PCA血流动力学指标比较
2.3 NPDR患者眼部血流动力学指标与中心视网膜厚度的相关性分析NPDR患者眼部OA、CRA、PCA血流动力学指标PSV与中心视网膜厚度均无相关性(均为P>0.05);OA、CRA、PCA血流动力学指标PI和RI与中心视网膜厚度均呈正相关性(均为P<0.05)(表5)。
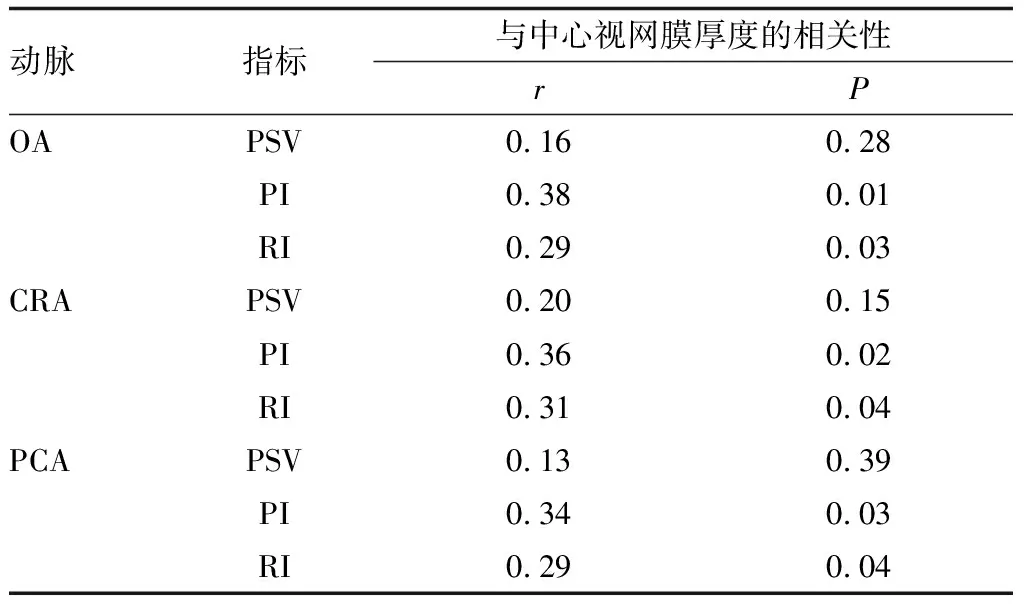
表5 NPDR患者眼部血流动力学指标与中心视网膜厚度的相关性
3 讨论
糖尿病患者长期慢性高血糖状态可引起眼部微小血管出现并发症。DR是糖尿病患者常见并发症之一,也是引起糖尿病患者失明的主要原因。DR的发病机制较为复杂,目前尚未完全明确,相关学者认为该病是多种因素综合作用导致的,如炎症反应、氧化应激反应、各种细胞因子失衡等共同造成视网膜血管通透性改变及新生血管形成,最终导致血-视网膜屏障破坏[9]。
既往研究显示,糖尿病患者的视网膜损伤主要由微血管的微循环阻滞引起。多数学者认为导致微循环阻滞的主要原因是微血管结构改变和高血糖,这两种因素共同作用使视网膜血流灌注受到严重影响,而增多的新生血管又将有效的血流量进行分流,导致眼部血流动力学发生改变[10-11]。球后血流动力学异常是DR发生发展的影响因素之一,在一定程度上可以反映视网膜病变的严重程度和进展。患者在出现DR前,眼部OA、CRA、PCA血流动力学参数已经发生变化,如PSV降低,血流阻力(RI、PI)增加[12]。目前部分研究[13-14]表明,在糖尿病早期,视网膜神经组织仍处于代偿期,神经元损伤仍在一定范围内,起支撑作用的细胞尚未大量死亡,其大体结构及功能无明显变化,视网膜厚度无明显改变,而随着近视度数增加和眼轴的增长,DR患者后极部视网膜明显变薄。产生上述改变的原因可能与视网膜血流灌注异常有关,即糖尿病患者视网膜动脉系统血流减少导致视网膜得不到充分的营养,视网膜神经组织萎缩变性,出现大量神经元损伤,导致视网膜厚度降低[15]。但这也只是个别研究者的推测,具体机制仍需进行更深入研究。
为了进一步研究眼部血流动力学指标与中心视网膜厚度的关系,本研究将收治的NPDR患者根据OCT测量结果分为中心视网膜厚度正常组、中心视网膜变薄组和中心视网膜增厚组,以方便观察不同中心视网膜厚度患者眼部血流动力学参数变化的差异性。研究结果显示,与中心视网膜增厚组相比,中心视网膜变薄组患者的OA、CRA、PCA的PSV升高而RI和PI减低,提示中心视网膜变薄患者的视网膜有相对较充足的血流。PSV的变化表明血流速度的变化或血管管径的变化。研究发现,在DR前期或早期患者CRA管径扩张,PSV轻度增加,这可能与组织缺血缺氧造成远端血管代偿性扩张及血流加速有关[16]。但也有研究发现,NPDR患者的CRA血流速度指标PSV减小[17]。可以看出,在有关糖尿病患者眼部血流情况的研究中,关于PSV的变化报道并不一致。RI和PI均可以反映血管的血流阻力状态,其值升高分别代表着远端血管阻力增加和舒张期血流减少及血管阻力增加,相较于PSV,PI和RI可以忽略检测角度引起的误差,测量重复性更好[18]。本研究相关性分析发现,PI和RI与中心视网膜厚度呈正相关性,说明在DR前期或早期,中心视网膜变厚会导致血管的顺应性下降,血管阻力增加。此外,中心视网膜增厚组患者OA、CRA、PCA的PSV均小于中心视网膜变薄组,PI和RI均大于中心视网膜变薄组(均为P<0.05),说明中心视网膜变薄患者视网膜的血流灌注相对于视网膜增厚患者得以改善,有效缓解了视网膜缺血缺氧状态,故视网膜变薄可能是DR的保护机制之一。
综上所述,NPDR患者中心视网膜厚度与眼部血流动力学指标关系密切,可在一定程度上影响患者眼部血流状态。本研究的局限性在于未对患者进行分层分析,接下来我们将纳入更多患者进行分层探讨,进一步阐释中心视网膜厚度影响眼部血流动力学的具体机制。

