基于高通量测序技术的贵州不同类型细菌型豆豉菌群多样性分析
王娜,陈万轩,张伟萍,张剑霜
(贵州师范大学 生命科学学院,贵州 贵阳,550025)
豆豉是一类以大豆为原料,经过浸泡、蒸煮后,在微生物作用下分解原料中的各种成分,产生的具有特殊风味的发酵制品[1],是我国特色食品之一,多产于四川、湖南、江西、贵州等地区,由于微生物种类的不同,豆豉可分为曲霉型豆豉[2]、毛霉型豆豉[3]、根霉型豆豉[4]和细菌型豆豉[5]。湖南、江西等地主要生产毛霉型豆豉与根霉型豆豉,贵州则以生产细菌型豆豉为主,一些贵州家庭通常将煮熟的大豆冷却至30 ℃左右,在密闭空间里让其自然发酵,待成熟至黄豆表面发白具有黏稠度的丝状物,再加入葱、姜、食盐及其他香辛料继续发酵成为一种特殊风味的豆制品[6-8]。
《中国药典》记载豆豉具有解表、除烦、宣郁、解毒等功效。除此之外,研究表明豆豉中分离出的大豆异黄酮[9]、豆豉溶栓酶[10]、豆豉低聚糖[11]等化学成分,具有降解蛋白、抗凝血、溶解血栓、助消化等多种药用功能。发酵过程中,豆豉在微生物分泌的蛋白酶、葡萄糖苷酶等的作用下,生产多肽、氨基酸、黄酮以及皂苷等多种活性物质,以此来发挥多种保健功能。陈怡等[12]对细菌型、毛霉型和曲霉型豆豉的抗氧化活性研究表明不同微生物发酵豆豉的抗氧化能力不同,豆豉中微生物种类与其化学组成的活性密切相关。
随着人们对微生物的认识,更多学者认识到微生物与食品不同风味的形成有重要联系,高通量测序技术使得食品微生物多样性研究得以发展[13-19]。聂黔丽等[20]对遵义细菌型自然发酵干豆豉菌群结构及风味品质分析表明,该细菌型豆豉的主要菌群为芽孢杆菌属(Bacillus),次要菌群为乳酸杆菌属(Lactobacillus),二者协同发酵出具有独特香味的遵义干豆豉;邓高文等[21]基于高通量测序技术对贵州水豆豉自然发酵前后、调味后发酵3个阶段的细菌菌群结构及多样性进行研究,并从水豆豉中鉴定出枯草芽孢杆菌、解淀粉芽孢杆菌和蜡样芽孢杆菌等产蛋白酶较高的菌株;董蕴等[6]利用高通量测序技术对6个细菌型豆豉细菌多样性进行了评估,并且建立了核心细菌类群与滋味品质相关性的网络图,得出葡萄球菌属(Staphylococcus)和乳酸杆菌属与豆豉酸味的形成呈正相关。然而,贵州豆豉微生物多样性的研究多限于单一豆豉或不同发酵阶段的微生物组成,而对贵州地区水豆豉、干豆豉和湿豆豉中的细菌组成差异少有报道。因此,本研究以贵州地区豆豉为研究对象,按DB 52/524—2007《豆豉》将其分为水豆豉、干豆豉、湿豆豉,利用高通量测序技术,探究3类豆豉中的细菌群落构成及其之间的差异,拟为贵州豆豉品质的标准化及其安全管理提供了理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 豆豉准备
湿豆豉SH1~SH2,实验室自制;SH3~SH4,贵阳市云岩区农贸市场(26°35′35″N, 106°45′20″ E),其工艺主要包括浸泡、蒸煮和自然微生物发酵,无辅料添加;干豆豉GH1~GH3分别采集自贵阳市乌当区农贸市场(26°37′59″ N, 106°45′46″ E)、贵州省遵义市湄潭县农贸市场(27°46′06″ N, 107°28′32″ E)、贵州省贵安新区党武镇农贸市场(26°23′36″ N, 106°35′52″ E),制作工艺包括浸泡、蒸煮和微生物发酵、烘炒(晾晒)以及少许盐分添加;WH1~WH3分别为贵阳老干妈风味食品有限责任公司、贵州遵义市红黄禄食品有限公司、贵州乡下妹食品有限公司所生产的商品化水豆豉,制作工艺包括浸泡、蒸煮和微生物发酵、加入凉开水继续发酵、添加盐分、香辛料等。取上述豆豉样品150 g左右,装入无菌采样管中,贮存于-20 ℃冰箱备用。
1.1.2 仪器与设备
5415D离心机、Realplex4S荧光定量PCR仪,德国Eppendorf公司;XP cycler PCR仪,杭州博日科技有限公司;2000c Nanodrop紫外-可见分光光度计,美国Thermo公司;Gel-Doc凝胶成像系统,美国Bio-Rad Laboratories公司;Q32866 Qubit2.0荧光计,美国Life Tech公司;2100核酸分析仪,安捷伦科技有限公司;NovaSeq 6000高通量测序仪,美国Illumina公司。
1.1.3 试剂
M0531高保真酶,杭州诺扬生物技术有限公司;A63881核酸纯化试剂盒,美国Beckman Coulter公司;AP-GX-250G DNA凝胶回收试剂盒,杭州爱思进生物技术有限公司;Q32851双链DNA高灵敏度荧光定量试剂盒,美国Life Tech公司;KK4824文库定量试剂盒,上海默瑞生物科技有限公司;FC-410-1003基因测序试剂盒,美国Illumina公司。
1.2 实验方法
1.2.1 DNA提取
将不同编号的豆豉样品搅拌均匀,根据DNA提取试剂盒说明书,结合SDS裂解液冻融法进行DNA提取,置于-20 ℃贮存,用1%琼脂糖凝胶电泳检测PCR产物,满足条带清晰则进行下一步。
1.2.2 测序方法
以豆豉总DNA为模板进行细菌16S rDNA V4区域扩增。引物采用正向引物(515F:5′-GTGCCAGCMGCCGCGGTAA-3′)和反向引物(806R:5′- GGACTACHVGGGTWTCTAAT-3′)进行扩增。条码序列采用特定的7 bp特定序列合成到序列中。DNA模板10 μL,高保真PCR试剂25 μL,前后F/R引物各3 μL(10 μmol/L),ddH2O 6 μL。配制好的PCR体系按照如下反应条件进行PCR扩增:预变性98 ℃ 30 s,接下来25个循环:变性98 ℃ 15 s,退火58 ℃ 15 s,延伸72 ℃ 15 s,终延伸72 ℃ 1 min。经过PCR扩增后,通过1%琼脂糖凝胶电泳检测文库大小,使用Qubit 2.0荧光定量仪测定文库浓度,随后在Illumina NovaSeq 6000 pair-end 2×150 bp平台进行双端测序。
1.2.3 下机数据处理
使用QIIME(v.1.8.0)软件对下机数据进行处理,拆分和截去条码序列和引物序列后使用Vsearch (v2.4.4)对每个样品的序列进行拼接,得到原始数据,同时去除长度<150 bp、平均质量值<20、含有不明确碱基以及含有>8 bp的单核苷酸重复序列等低质量序列,去除嵌合体序列,得到最终的有效数据,再默认以97%相似度以上序列聚类成操作分类单元(operational taxonomic units,OTU),使用默认参数挑选OTU的代表序列,基于SILVA128数据库对代表序列进行物种注释,进一步生成OTU列表,在各个分类水平上统计各样本的群落组成,所有样本中含量低于总序列0.001%的分类单元将被去除。
1.2.4 下机数据分析
序列数据分析主要使用QIIME和R包(v3.2.0)计算样品的各项数据指标。使用QIIME软件计算alpha多样性指数,通过Chao 1、Shannon、Coverage指数来比较每个样本的OTUs丰度、菌群多样性以及样本的文库覆盖率;Beta多样性分析是通过QIIME软件计算UniFrac距离度量,并绘制主成分分析图、聚类图比较样本间的微生物组成关系;微生物群落组成分析是基于R包中Kruskal方法比较样本间或组间各分类水平门、纲、目、科、属的菌群组成结构,通过绘制维恩图和门、属水平分类图进行分析。
2 结果与分析
2.1 序列丰富度及多样性分析
通过对OTU的聚类和注释的结果统计,得到不同分类水平上各个样本的微生物类群组成数量,如表1所示。本次测序10个样本共得到1 098 891条有效数据,884个OTUs。Shannon指数和Chao 1指数是衡量物种多样性和丰富度的指数。Shannon指数越高,表示物种多样性越大,Chao 1指数越高,表示物种丰富度越高。在10个豆豉样品中SH的Shannon指数介于3.19~4.90,GH介于3.64~4.77,WH介于3.2~5.80。SH的Chao 1指数介于276~393,GH介于372~456,WH介于379~577。经秩和检验发现,隶属于不同类型豆豉样品中的细菌类群在Shannon指数(P>0.05)、Chao 1指数(P>0.05)均不具有显著性差异,由此可见,贵州不同类型细菌型豆豉中的细菌多样性和丰富度较为均一。结果表明,GH、SH和WH虽然制作工艺有所不同,但GH、WH是在SH的基础上进一步干燥或加水后继续发酵而成,后续加工过程中可能并未掺杂入大量其他细菌,因此3类豆豉的细菌类群较为相似。
由图1可知在测序深度达到4 000条左右时,所有的Shannon稀释曲线均已进入平台期,说明细菌微生物多样性不会随之增加,表1中,每个样本的有效序列数均达到100 000条,并且Coverage指数均>0.999,说明测序数据量足够大、样本的文库覆盖率广,可以反映样品中绝大多数的微生物物种信息。因而本研究的测序深度可以满足后续分析要求。

表1 样品16S rDNA测序情况及分类情况Table 1 Sequencing and classification of 16S rDNA samples

图1 Shannon指数稀释曲线Fig.1 Shannon index curve
2.2 样品中共有和独有的OTU聚类与统计
对测序获得的有效数据进行聚类分析,以97%相似度以上的序列聚类成OTUs,并根据不同类型豆豉绘制维恩图(图2)。由图2可知,SH、GH、WH中含有的OTUs分别是480、591、766,说明WH样本中的细菌种类略多于GH和SH。SH和GH样品中相同的OTUs有391个,SH和WH样品中相同的OTUs有397个,GH和WH样品中相同的OTUs有402个,说明三者微生物种群具有极大的相似性。3种豆豉样品中共有的OTUs有337个,说明这些微生物在豆豉发酵过程中可能起着重要作用。

图2 三种豆豉中的OTUs维恩图Fig.2 Venn analysis of OTUs of three kinds of Douchi
2.3 细菌门水平上的分布特征
如图3所示,10个送检样本共注释了5个门类:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)以及极少数未被定义的其他门类。3类豆豉细菌组成在门水平上高度相似,其中厚壁菌门和变形菌门为主导菌门,对两个菌门的相对含量进行秩和检验,发现在3组之间存在显著性差异(P<0.05),厚壁菌门在GH和WH中占绝对优势,相对丰度分别为93.8%、80.8%,变形菌门在GH为5.4%,在WH中为18.2%,而在SH中主要菌门为变形菌门,次要菌门为厚壁菌门,相对丰度分别为53.8%、46.1%。由此可见,尽管厚壁菌门和变形菌门作为3组豆豉的主要菌门,但其相对含量有明显差异,分析原因是GH和WH在后发酵过程中经过晒干、加水以及等方式处理,改变了菌群生长环境,使其更适合厚壁菌门细菌生长,进而改变了豆豉中的微生物菌群结构。

图3 基于门水平3种豆豉样本的相对丰度比较Fig.3 Comparative analysis of relative abundance of bacterial groups in three kinds of Douchi at phylum level
2.4 细菌属水平上的分布特征
2.4.1 属水平分类
基于属水平上的分类学注释结果,对3种豆豉中最具优势的10个属绘制分类图,如图4所示,GH中主要的细菌类群为芽孢杆菌属、变形杆菌属(Proteus)、葡萄球菌属、普罗威斯登菌属(Providencia)以及短芽孢杆菌属(Brevibacillus),丰度逐个降低;SH中依次为芽孢杆菌属、普罗威斯登菌属、变形杆菌属、特斯布斯菌属(Trabulsiella)与短芽孢杆菌属;WH则主要由芽孢杆菌属、四联球菌属(Tetragenococcus)、魏斯氏菌属(Weissella)、不动杆菌属(Acinetobacter)、肠球菌属(Enterococcus)、变形杆菌属、短芽孢杆菌属和葡萄球菌属组成。GH、SH和WH中均以芽孢杆菌属为优势菌属,其平均相对丰度分别为93.0%、74.3%、42.3%,秩和检验结果显示,3类豆豉中芽孢杆菌属相对丰度无显著性差异(P>0.05),表明芽孢杆菌属细菌类群在3种类型豆豉的制作过程中较为恒定。此外,由图4可知,4个SH样本以及3个WH样本间的菌属组成存在一定差异性,可能原因为SH1、SH2是自制食品,而SH3、SH4样品购买自当地生鲜市场,推测不同存放环境对此类发酵产品细菌群落有一定的影响。
2.4.2 属水平细菌聚类分析
从物种和样品两个层面进行聚类分析,样本先按照彼此之间组成的相似度进行聚类,再根据不同属的相似度进行聚类,聚类结果纵向依次排列,可以了解样品之间的关系以及属水平上的群落构成。如图5所示,共展示60个属,同类型豆豉间的菌属组成相似。WH中芽孢杆菌属和四联球菌属占比最多,属优势菌属,GH中芽孢杆菌属、变形杆菌属居多,而在SH中芽孢杆菌属、普罗威斯登菌属占比最多,且除样本WH1之外,其余9个样本均是芽孢杆菌属相对丰度最高,说明芽孢杆菌属为豆豉中的主导菌属,这与图4结论相同。10个样本组可分为3个聚类,WH2、WH3为一类,GH1、SH3、SH4为一类,GH2、GH3、SH1、SH2和WH1为一类,由此也说明每一类豆豉样本间的细菌组成并不完全相同,均存在一定程度的差异,10个豆豉样本收集至贵州各地,因此可分析豆豉制作过程中微生物的组成与环境有一定的关联性。

图4 基于属水平3种豆豉样本的相对丰度比较Fig.4 Comparative analysis of relative abundance of bacterial groups in three kinds of Douchi at genus level

图5 细菌在属水平上的聚类热图Fig.5 Clustering heatmap of bacterial groups at genus level
2.5 主成分分析与相似性分析
主成分分析方法是一种通过降维处理展现样本特定的距离分布的方法,不同颜色代表不同类型的豆豉样本,距离远近反应样本的相似性大小。相似性分析方法主要用于分析高维数据组间相似性,为数据间差异显著性评价提供依据。由图6可知,主成分分析PC1解释度为23.95%,PC2解释度为22.66%,从样品分布上看,SH1、SH2、SH3与SH4相聚较近,说明SH样品菌群组成相似,相对来说更加稳定,GH1和GH3分布集中,但GH2与前两者相差较远,说明GH菌群结构相似,但环境对GH中的细菌也有一定的影响,WH1、WH2和WH3分布零散,三者的菌群组成差异相对较大,表明WH在制作过程中,微生物种类更易受到环境影响,且WH的细菌种类十分丰富。总体上看,SH与GH距离较近,与WH距离较远,说明SH与GH较WH更为相似。此外,相似性分析结果表明,三类豆豉间的菌群差异大于组内菌群差异(R>0),且差异显著(P<0.05)。
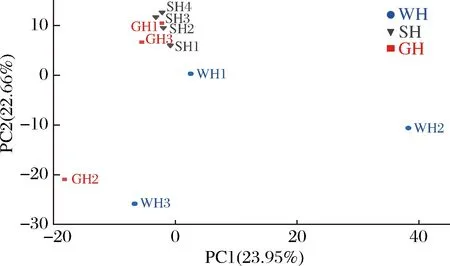
图6 豆豉样品的主成分分析Fig.6 Principal component analysis of Douchi samples
3 讨论
微生物是影响发酵豆制品高质量生产的关键因素,大量研究表明细菌在豆豉形成过程中发挥重要作用。有研究者针对细菌多样性及动态变化进行研究,来探究微生物在豆豉不同发酵阶段的影响;通过对微生物多样性与豆豉中分解的化学成分展开分析,研究了豆豉药用、保健成分与微生物的关联;针对微生物多样性与代谢物之间的相关性分析,探索微生物对豆豉中的酸味、香味形成的影响等。越来越多的研究表明不同微生物协调作用,影响着豆豉产品的形态,风味与营养价值功效。
本研究中,对贵州不同地区豆豉的细菌结构展开分析,比较了3类豆豉间的细菌组成相关性与差异性。共分析注释了5个门类,96个属类,在门水平上,厚壁菌门和变形菌门为优势菌门,这与邓高文等[21]研究结果一致,表明厚壁菌门和变形菌门可能是所有豆豉制品中的两大关键门类,在不同种类豆豉独特风味的形成中发挥主要作用。属水平上,芽孢杆菌属是主要菌属[22-23],其在干豆豉中的丰度最高,占比为93.0%,在水豆豉中丰度最低,占比为42.3%,同时还鉴定到变形杆菌属、葡萄球菌属、普罗威斯登菌属、魏斯氏菌属、不动杆菌属、短芽孢杆菌属、葡萄球菌等相对丰度排名前十的优势菌,这些细菌在豆豉发酵过程中均发挥了重要作用,在这之中水豆豉几乎包含了所有排名前十的优势菌属,细菌群落多样性最高,种类繁多,而干、湿豆豉菌属种类相对较少,多样性相对较低,并且通过主成分分析、热力图等对3种豆豉的关系远近进行可视化分析,表明水豆豉关系相对较远,干豆豉与湿豆豉关系较近。这些结论拟为贵州豆豉制品标准化及安全管理提供了参考价值。
4 结论
本研究基于高通量测序技术分析了贵州水豆豉、湿豆豉和干豆豉间细菌组成及差异,3类豆豉的细菌组成有极大的相似性,均以芽孢杆菌属为主导菌属。从菌落关系上看,水豆豉相较于干豆豉与湿豆豉有较高的物种多样性及细菌群落丰富度,水豆豉细菌群落结构复杂,湿豆豉与干豆豉的微生物组成亲缘关系更近。在后续研究中,我们将结合传统分离培养、代谢组分析等方法进一步探究3种不同豆豉风味的形成原因。

