基于HSP60、HSP90 表达探讨续断种子方对少弱精子症模型大鼠精液质量的影响
张亚光,王权胜,黄子彦,陈 露,宋吉祥,林自立
(1.广西中医药大学研究生院,广西 南宁 530001;2.广西中医药防治医学分子生物重点实验室,广西 南宁 530023;3.广西中医药大学第一附属医院男科,广西南宁 530023)
热休克蛋白(heat shock protein,HSP)是存在于细胞内的一类伴侣蛋白分子[7],在生理条件和应激状态下,HSP 可作为分子伴侣参与细胞蛋白的折叠、组装、转运以及删除错误蛋白[8]。HSP 在男性生殖中发挥重要作用,HSP 家族中,HSP60 参与睾丸的发育和精子发生,HSP90 可调控生精细胞的分裂和精子发生并保护精子免受氧化损伤[9,10]。前期研究表明,续断种子方可抑制生精细胞凋亡和提高生精细胞氧化损伤后的修复能力,从而提高精子质量,促进精子发生[11,12],但其潜在机制仍有待进一步研究完善。因此本研究基于少弱精子症大鼠睾丸组织中HSP60、HSP90 表达和精子质量分析,探究续断种子方治疗少弱精子症的部分作用机制。
1 材料与方法
1.1 实验动物及分组
40 只SD 雄性大鼠,SPF 级,体重200~220 g,购买自湖南斯莱克景达实验动物有限公司,动物许可证[SCXK(湘)2019-0004],本实验通过广西中医药大学动物伦理委员会批准。适应性喂养1 周,随机取10 只作为空白对照组,其余30 只造模成功后按照随机数字表法分为模型对照组、左卡尼汀组和续断种子方组,每组各10 只。
1.2 实验药物
环磷酰胺粉针剂(Baxter 公司,进口药品注册证号:H20160467);左卡尼汀口服液10 mL:1 g(东北制药集团沈阳第一制药有限公司,国药准字H19990372);续断种子方颗粒药物组成:续断、杜仲、菟丝子、枸杞子、女贞子、骨碎补、牛膝、党参、白术、怀山药各15 g 组成(免煎中药,由江苏省江阴市天江药业有限公司生产,药品许可证号:1203002)。
1.3 主要试剂与仪器
HSP60 一 抗,Affinity 公 司,批 号:AF0184;HSP90 一抗,批号:Ab203126,购于美国Abcam 公司。精子质量检测系统(北京伟力新世纪科技发展有限公司);半自动轮转切片机(Thermoshandon Finesse E);石蜡包埋机(Leica EG1150H+C);倒置相差显微镜(Olympus BX43)、台式冷冻离心机(Eppendrof 5430R)。
1.4 造模及给药
少弱精子症模型参照参考文献[13]进行制备,除空白组外,其余大鼠均采用腹腔注射40 mg·kg-1·d-1环磷酰胺的方法造模,连续注射1 周。造模成功后,中药组按人体等效剂量将药物配成水溶液灌胃给药,给予10 g 生药量/(kg.d)续断种子方,西药组给予左卡尼汀口服液0.1 g·kg-1·d-1,正常组和模型组每天给予等量生理盐水,连续给药8 周。
1.5 精液分析
末次给药24 h 后,给予实验大鼠腹腔注射5%水合氯醛进行麻醉,迅速取出大鼠左侧附睾,并除去脂肪组织和筋膜,用生理盐水洗去血液,称重并置于2 mL 生理盐水的平皿中剪碎、混匀,放37 ℃恒温水浴箱中孵育20 min,轻轻摇晃,待精子得到充分离出后,按照WHO《人类精液检查与处理实验室检查手册》标准参数运用精子计数板对精子浓度及精子活力进行检测。
1.6 HE 染色
取各组取大鼠睾丸组织放置于10%的中性福尔马林中固定24 h 后,常规石蜡包埋、石蜡切片机连续切片,常规脱蜡进行苏木精伊红(HE)染色后封片,光学显微镜观察形态变化并拍照。
1.7 免疫组化检测阳性蛋白表达
取睾丸组织石蜡包埋切片、严格按照试剂说明,采用通用免疫组化法进行,封片后镜检。正常情况下,染色后阳性细胞HSP60 和HSP90 细胞胞浆和细胞核可被染成黄色或棕黄色。应用Image Pro Plus 软件进行分析阳性细胞HSP60 和HSP90免疫组化图片,计算阳性细胞面积。
1.8 Western Blot 检测蛋白表达
取睾丸组织于液氮中研磨粉碎,加入蛋白裂解液,并于冰水中裂解0.5 h~1 h,用超声粉碎仪使其充分裂解,重复5 次;4 ℃12 000 r/min 离心10 min,取上清液,加蛋白上样缓冲液,煮沸10 min,电泳、转膜、封闭,加入一抗4 ℃孵育过夜,放入TBST 中震荡洗涤,加入二抗孵育1 h,用TBST 洗膜,最后在膜上滴加化学发光液,在成像系统进行曝光成像,应用Image-Pro Plus 软件对蛋白条带进行分析。
市政工程,所有分组固定工人的组织,每个组在都有固定的施工工序,在工作方式上对重复性和衔接性有比较高的要求,这就需要在施工过程中不断协调相关施工方案,根据实际运行的实际情况及可能出现的问题和各方面的操作来进行班组工作的衔接,必须保证工程的完整性和协调性,工作人员才能在质量上不断提升,在工作效率上不断提高。
1.9 统计学处理
运用IBM SPSS Statistics 25 软件进行相关数据分析,数据以(±s)表示,组间比较采用单因素方差分析,两组间比较采用LSD 检验,应用Graph-Pad Prism 9.0 软件进行统计图绘制,P<0.05 表示差异有统计学意义。
2 结果
2.1 一般表现
实验过程中空白对照组大鼠精神活动、饮食、体重、毛色等均正常;造模后的各组大鼠则在不同程度上表现出精神萎靡、饮食减少、体重下降、毛色不泽、反应迟钝等症状,在经药物干预1 周后,以上症状出现好转。在实验给药过程中共有3 只大鼠死亡(模型对照组1 只、左卡尼汀组1 只、续断种子方组1 只),最终剩余37 只大鼠被纳入本研究。
2.2 精子质量对比
经检测,与空白对照组相比,其余各组大鼠精子浓度及活动度均明显下降,差异具有统计学意义(P<0.01),其中模型对照组检测到少量精子且活动率低下;与模型对照组相比,左卡尼汀组和续断种子方组精子浓度及活动率均有明显提高,差异具有统计学意义(P<0.01);左卡尼汀组与续断种子方组相比较,差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠精子质量比较(±s)Tab 1 Semen quality comparison of rats in each group(±s)
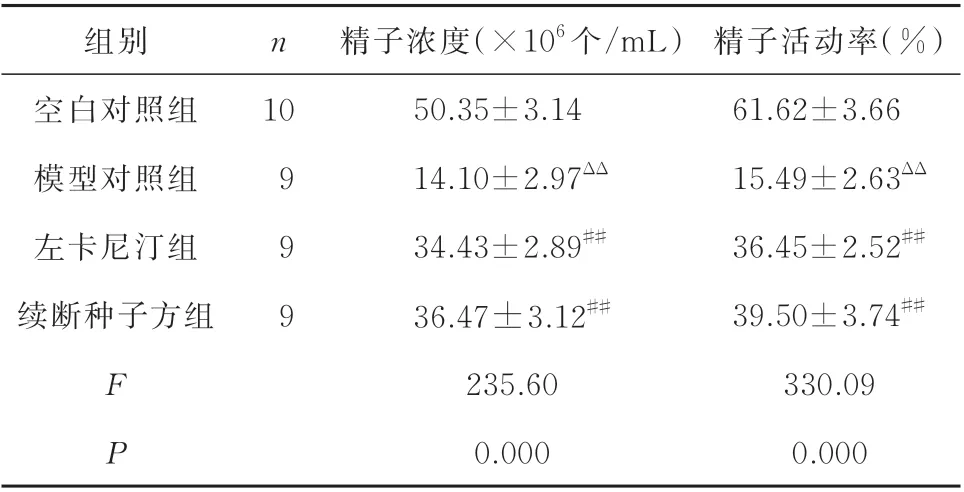
表1 各组大鼠精子质量比较(±s)Tab 1 Semen quality comparison of rats in each group(±s)
注:与空白对照组比较,ΔΔP<0.01,与模型对照组比较,##P<0.01。
组别空白对照组模型对照组左卡尼汀组续断种子方组n 精子活动率(%)61.62±3.66 15.49±2.63ΔΔ 36.45±2.52##39.50±3.74##330.09 0.000 10 9 9 9 F P精子浓度(×106 个/mL)50.35±3.14 14.10±2.97ΔΔ 34.43±2.89##36.47±3.12##235.60 0.000
2.3 各组大鼠睾丸组织形态学分析
光学显微镜下可见空白对照组大鼠睾丸曲细小管呈圆形或卵圆形,分布规则,无萎缩、退化,生精上皮较厚,生精细胞层次丰富,排列整齐、致密,管腔内可见大量精子。模型对照组大鼠曲细小管明显萎缩退化且排列不规则,生精上皮呈大量空泡状,支持细胞变性,间质细胞内炎性浸润明显,间质细胞增生,上皮细胞散在排列,大量脱落变性,精子少见。与模型对照组相比,左卡尼汀组和续断种子方组以上病变得到明显改善,生精小管结构相对规整,排列有序,较模型对照组致密,支持细胞与间质细胞明显增多,生精上皮较模型组增厚,层次丰富,管腔内可见大量精子。见图1。
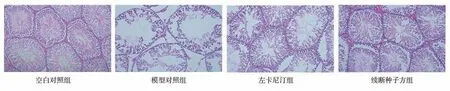
图1 光镜下各组大鼠睾丸组织HE 染色切片(HE 染色,200×)Fig 1 Pathological results of testis in each group(HE,200×)
2.4 各组大鼠免疫组化法检测分析
染色后阳性细胞HSP60 和HSP90 细胞胞浆和细胞核可被染成黄色或棕黄色,相对于空白对照组,模型对照组HSP60 和HSP90 表达明显降低(图2B、图3B);左卡尼汀组和续断种子方组经药物干预后相对于模型对照组HSP60 和HSP90 表达得到明显提高(图2C、图2D;图3C、图3D)。

图2 免疫组化检测各组大鼠睾丸HSP60 的表达(免疫组化,200×)Fig 2 Expression of HSP60 in testis of rats in each group(IHC,200×)
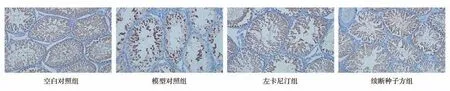
图3 免疫组化检测各组大鼠睾丸HSP90 的表达(免疫组化,200×)Fig 3 Expression of HSP90 in testis of rats in each group(IHC,200×)
2.5 各组大鼠Western Blot 检测分析
与空白对照组相比,模型对照组HSP60 和HSP90 在睾丸组织中的表达水平降低,差异具有统计学意义(P<0.01),与模型对照组相比左卡尼汀组和续断种子方组HSP60 和HSP90 在睾丸组织中的表达均有明显提高,差异具有统计学意义(P<0.01),左卡尼汀组和续断种子方组差异无统计学意义(P>0.05),(表2、图4)。
表2 各组大鼠睾丸组织HSP90 和HSP90 的表达(±s)Tab 2 Expression of HSP90 and HSP90 in testicular tissue of rats in each group(±s)
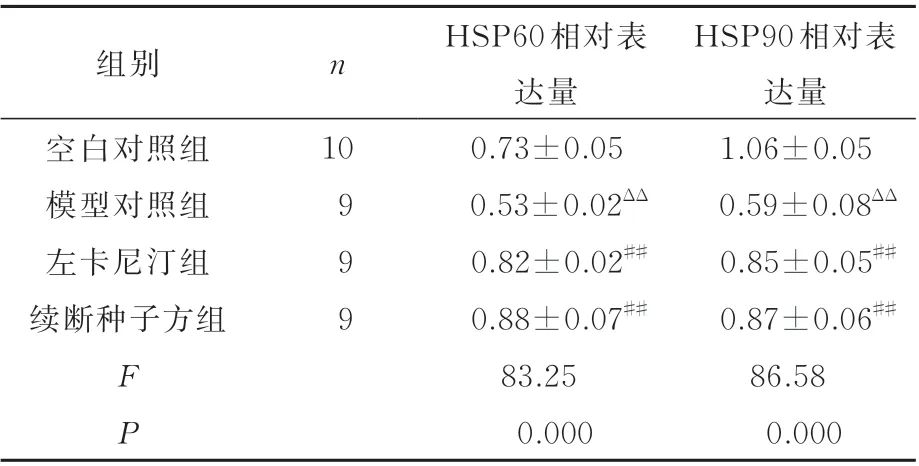
表2 各组大鼠睾丸组织HSP90 和HSP90 的表达(±s)Tab 2 Expression of HSP90 and HSP90 in testicular tissue of rats in each group(±s)
注:与空白对照组比较,ΔΔP<0.01,与模型对照组比较,##P<0.01。
HSP90 相对表达量1.06±0.05 0.59±0.08ΔΔ 0.85±0.05##0.87±0.06##86.58 0.000组别n空白对照组模型对照组左卡尼汀组续断种子方组10 9 9 9 FP HSP60 相对表达量0.73±0.05 0.53±0.02ΔΔ 0.82±0.02##0.88±0.07##83.25 0.000
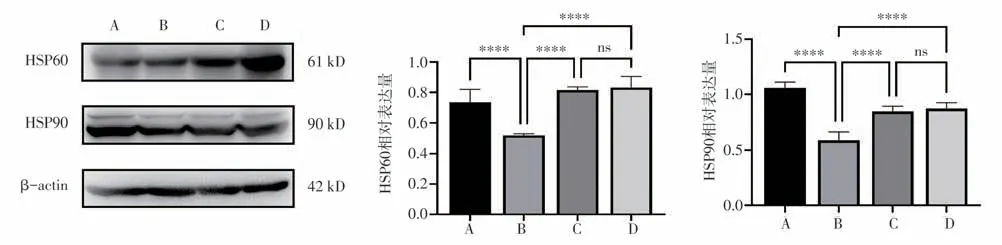
图4 Western Blot 检测HSP60 和HSP90 在睾丸组织中的表达Fig 4 Expression of HSP60 and HSP90 in testis(Western Blot)
3 讨论
少弱精子症是导致男性不育症的主要原因,以精子数量减少和精子活力减弱为主要临床表现。导致少弱精子症的常见病因有男性生殖系感染、内分泌因素、精索静脉曲张、隐睾症等等[14]。临床上西医主要针对病因治疗少弱精子症,多以雌激素受体拮抗剂、左旋肉碱、抗氧化剂等为主,但是疗效不确切以及在治疗过程中存在诸多不良反应,在临床应用中常具有局限性[15,16]。中医无少弱精子症病名,根据其临床症状表现一般认为属精少、精薄、无子等范畴,中医药在治疗的过程中积累了丰富的经验,而且具有费用低廉、副作用少等优点。据相关研究发现,中药复方改善精子质量的效果优于化学药物[17]。
中医认为少弱精子症与肝、脾、肾三脏密切相关,主要以肾虚为主,另外兼有肝郁、脾虚、血瘀、湿热等,因此在治疗的过程中在补肾的同时兼顾疏肝、健脾、活血、祛湿等[18]。本课题组在临床及科研的过程中治疗应用以通为用、和营生精的续断种子方,在临床治疗中也确已取得了较好疗效[19,20]。“续断种子方”源于明代医家岳甫嘉所著《医学正印》。方中续断、人参两者合用具有补肾健脾、补血生精;菟丝子、枸杞子、女贞子合用可补肝肾、益精血;牛膝、杜仲、骨碎补、红藤补肾生精、活血通络。现代药理研究,续断具有抗氧化作用[21];淫羊藿中的淫羊藿苷可增加生精小管厚度和精子数量,淫羊藿生物碱可提升动物性欲且明显增加精子活力和活率[22];杜仲、牛膝可抑制大鼠睾丸的氧化应激和细胞凋亡等,进而改善精子质量[23,24]。菟丝子和枸杞子都具有改善生殖功能的作用[25],枸杞子中的枸杞子多糖可显著修复受损的生精细胞,菟丝子含有的菟丝子黄酮可以促进下丘脑-垂体性腺轴功能、抑制生精上皮细胞凋亡,同时具有抗氧化损伤作用[26-28]。诸药合用,共奏益肾健脾、活血生精通络之功效。
HSP60 是一种高度保守伴侣蛋白,具有促凋亡和抗凋亡的双向调节作用[29]。在精原细胞有丝分裂的过程中HSP60 的表达量明显上调,这也显示精原细胞有丝分裂活性与HSP60 表达量呈现相关性,同时,相关研究也表明睾丸中HSP60 表达水平越低,生精能力相应越差[30-32]。HSP90 在细胞中含量丰富,占细胞蛋白总含量的1%~2%,参与精子的发生和获能,相关研究显示HSP90 缺失可造成精子减数分裂停滞和睾丸萎缩[33-36]。本研究结果显示模型大鼠在经过药物干预后,HE 染色结果可见,与空白对照组相比,模型组对照组大鼠曲细小管明显萎缩退化且排列不规则,生精上皮呈大量空泡状,支持细胞变性,间质细胞内炎性浸润明显,间质细胞增生,上皮细胞散在排列,大量脱落变性,精子少见。续断种子方干预后以上病变得到明显改善,生精小管结构相对规整,排列有序,较模型组致密,支持细胞与间质细胞明显增多,生精上皮较模型组增厚,层次丰富,管腔内可见大量精子。免疫组化和Western Blot 检测显示,模型大鼠经续断种子方干预后HSP60、HSP90 表达量显著增加(P<0.01)。精子质量检测结果显示,与空白对照组相比,模型对照组精子浓度和活动率明显降低(P<0.01)。经续断种子方干预后,模型大鼠精子浓度及活动率均有明显提高(P<0.01)。
综上所述,续断种子方促进少弱精子症模型大鼠精子发生的机制可能是通过上调HSP60 和HSP90 的表达量,从而抑制生精细胞的凋亡、改善精子发生微环境和精子质量,相关潜在机制仍有待进一步研究。
作者贡献度说明:
张亚光:指标检测、分析数据、撰写论文;黄子彦:建立模型、指标检测;陈露:建立模型、指标检测;宋吉祥:建立模型、取材;林自立:建立模型、取材;王权胜:研究总负责人、指导老师。
所有作者声明不存在利益冲突关系。

