自体造血干细胞移植一线巩固治疗恶性血液病17例的临床分析
韦中玲,蒋艺枝,王 玉,黄来全,黄 君,黄 辰,黄东平
(皖南医学院第一附属医院 弋矶山医院 血液内科,安徽 芜湖 241001)
造血干细胞移植是目前治疗恶性血液病的主要方法之一。自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)存在不需要供者、不受患者年龄限制、没有移植物抗宿主病(graft versus host disease,GVHD)并发症、治疗费用相对较低等优势,更容易被患者接受。临床上对于部分恶性血液病采用ASCT作为一线巩固治疗方案,其疗效明显优于单纯化疗,能大大延长患者的生存期。本文回顾性分析了弋矶山医院血液内科2017年1月~2020年10月对17例初诊恶性血液病患者进行ASCT作为一线巩固治疗,取得良好疗效。现报道如下。
1 资料与方法
1.1 研究对象 回顾性分析2017年1月~2020年10月进行ASCT的17例恶性血液病患者的临床资料。所有纳入患者均符合《血液病诊断与疗效标准》第3版诊断标准的临床资料完整的初诊恶性血液病患者[1]。排除标准为复发/难治恶性血液病患者,心、肾或其他器官严重功能异常、合并其他恶性肿瘤、前6个月内发生过卒中或颅内出血者。
1.2 干细胞动员 恶性淋巴瘤(NHL)、多发性骨髓瘤(MM)和急性淋巴细胞白血病(ALL)患者采用依托泊苷(VP-16)联合重组人粒细胞集落刺激因子(G-CSF)动员方案;急性髓系白血病(AML)采用大剂量阿糖胞苷(Ara-C)联合G-CSF动员方案。采集的外周血干细胞进行总的有核细胞(TNC)和CD34+细胞计数,并留取1 mL采集物进行免疫分型或微小残留病(MRD)检测。干细胞回输当天记为移植第0天,移植后天数以“+”表示。
1.3 ASCT预处理方案 NHL采用BVC±R、BEAM±R方案预处理;MM采用大剂量美法仑±硼替佐米预处理;AML采用BU/CY方案预处理。Ph阳性ALL采用TBI/CY方案预处理。
1.4 ASCT并发症预防及处理 所有患者药浴后进入无菌层流病房。给予前列地尔、肝素、熊去氧胆酸预防肝静脉闭塞综合征(VOD)。移植后+1d开始给予阿昔洛韦预防疱疹病毒。移植后给予G-CSF 5 μg/(kg·d)促进干细胞植入,给予重组人促血小板生成素(TPO)15 000 μ/d促进血小板植入。移植后患者出现发热时给予积极完善病原学检查,经验性抗感染治疗。移植后每周给予人免疫球蛋白支持治疗。给予辐照红细胞和血小板输注支持治疗。
1.5 造血干细胞回输及植入 预处理结束24 h后行自体外周血干细胞回输。以移植后中性粒细胞计数(ANC)连续3 d超过0.5×109/L的第1天计为中性粒细胞植入时间,移植后血小板不依赖输注连续7 d超过20×109/L的第1天计为血小板植入时间。
1.6 随访 以干细胞回输当天为随访开始时间,所有患者随访至2021年12月31日。通过电话回访或门诊复查方式进行随访和记录。无进展生存(progression-free survival,PFS)为患者进行ASCT后至疾病进展或无疾病进展至随访截止的时间;总生存(overall survival,OS)为患者进行ASCT后至死亡或者至随访截止的时间。
2 结果
2.1 基本资料 17例恶性血液病患者中男11例,女6例;中位年龄51岁(25~63岁,IQR=15.5岁)。NHL8例:弥漫大B细胞淋巴瘤(DLBCL)3例,结外NK/T细胞淋巴瘤(ENKL)2例,外周T细胞淋巴瘤非特指型(PTCL,NOS)1例,套细胞淋巴瘤(MCL)1例,T淋巴母细胞淋巴瘤(T-LBL)1例;MM 5例;急性白血病4例:AML 3例,Ph阳性ALL 1例。
2.2 移植前疗效 所有患者经过化疗在ASCT前均取得部分缓解(PR)以上疗效。患者基本资料和移植前治疗经过及疗效见表1。
2.3 自体造血干细胞动员和采集 所有患者均一次动员获得成功。TNC中位数为6.46(2.88~19.95)×108/kg,CD34+细胞中位数为2.95(1.44~46.95)×106/kg。干细胞采集物进行免疫分型或MRD检测,结果为阴性。
2.4 干细胞植入和移植相关并发症 所有患者未发生输注相关不良反应,输注的TNC中位数为4.66(0.63~12.80)×108/kg,CD34+细胞中位数为2.5(1.18~4.25)×106/kg(表2)。干细胞植入率100%,中性粒细胞植入中位时间为+11(+9~+35)d,血小板植入中位时间为+14(+9~+69)d;预处理化疗主要出现恶心、呕吐、腹泻等胃肠道反应,口腔黏膜炎和各部位的感染。无移植相关死亡病例。1例患者出现毛细血管渗漏综合征,经过利尿、糖皮质激素等治疗后症状消失。
2.5 生存和预后 随访截至2021年12月31日,17例患者中12例生存(10例无病生存,2例复发后挽救化疗者现存活),5例复发死亡。3年OS率为67.97%(12/17)、PFS率为57.35%(10/17),详见表2、图1。

表1 17例患者基本资料和移植前治疗经过及疗效
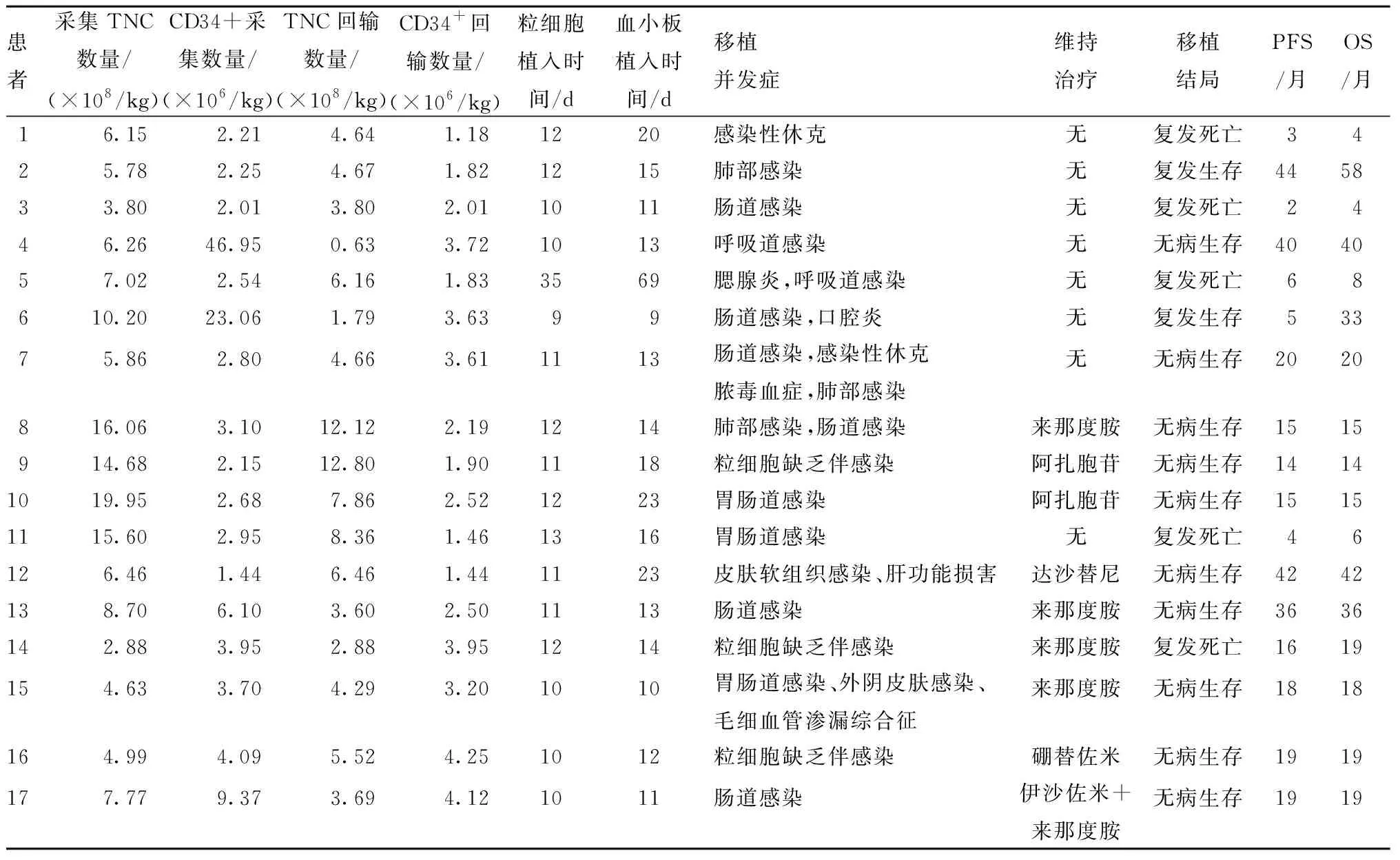
表2 17例患者输注干细胞计数、干细胞植入、移植并发症、结局和生存情况
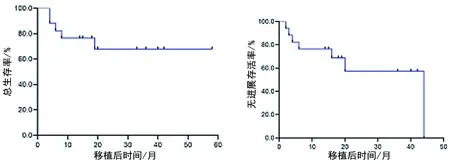
图1 17例患者移植后OS和PFS的生存曲线
3 讨论
与异基因造血干细胞移植相比,ASCT具有无GVHD等严重并发症、非复发死亡率低等优点。随着支持治疗和抗感染治疗的进步,ASCT已经广泛用于恶性血液病的治疗[2]。
对于高复发风险的初诊恶性淋巴瘤,ASCT是一种非常重要的治疗手段[3]。曹琳琳等[4]对74例恶性淋巴瘤患者进行ASCT的分析结果发现移植后存活患者比例为81%,2年的OS为78.5%,2年的PFS为75.8%。Le等[5]研究发现移植后进行维持治疗可进一步提高淋巴瘤疗效。本研究8例淋巴瘤中,有3例患者移植后复发死亡,移植后生存率62.5%,较文献报道偏低,可能与样本数量偏少,且死亡患者中有1例皮肤NK/T细胞淋巴瘤和1例T淋巴母细胞淋巴瘤均属于高危淋巴瘤,需要进行异基因造血干细胞移植,患者放弃异基因造血干细胞移植而要求ASCT,最终导致自体移植后早期复发。未进行移植后维持治疗的2例患者在移植不到3年时出现复发。与相关报道一样[6-7],笔者也认为淋巴瘤需要在ASCT后进行维持治疗。
有研究认为早期进行ASCT能明显增加MM患者疗效[8]。但移植后复发是需要关注的一个重要问题[9-10]。Binod等[11]对2 528例进行一线自体外周血造血干细胞移植巩固治疗的MM患者按照遗传学高危核型、移植前克隆浆细胞超过10%、血浆白蛋白<35 g/L、标危染色体核型四个因素制定预后评分系统,发现低、中、高三个危险度分组3年的PFS(58%vs.49%vs.31%,P<0.001)和OS(88%vs.81%vs.64%,P<0.001)均有显著性差异。干细胞采集物中的骨髓瘤细胞污染也可能导致疾病复发率增高[12]。本研究对所有骨髓瘤患者干细胞采集物均进行了MRD检测,结果均低于1×10-4。分析唯一1例于移植后16个月复发患者发现其存在疾病分期晚、染色体核型高危,且移植后维持治疗中来那度胺不耐受未能正规维持治疗等不良因素。
预后中等和预后良好急性白血病患者往往在获得分子生物缓解或遗传学缓解后选择ASCT来增加疗效,从而降低非复发死亡。刘瑜等[13]对19例急性白血病患者进行自体移植后分析发现,共存活10例患者,其余9例患者因疾病复发死亡。庞爱明等[14]分析认为急性白血病进行ASCT联合移植后维持治疗能够提高患者DFS和OS。本组4例中除1例患者移植后3个月复发,其余3例患者进行移植后维持治疗,目前均无病生存。
综上所述,ASCT治疗恶性血液病临床安全,疗效肯定,并且需要进行造血干细胞移植后维持治疗来巩固移植的疗效,降低复发率。本研究入组样本数较小,有待扩大样本量、增加随访时间后进一步证实ASCT在恶性血液病治疗中的疗效。

