反应体系混匀与否对新型冠状病毒实时荧光逆转录聚合酶链反应检测结果的影响
杨志,秦冬梅*,周波,肖光军
(1.大英县人民医院,四川 大英 629300;2.遂宁市中心医院,四川 遂宁 629000)
自2020年1月11日初步判定“不明原因病毒肺炎”的病原体为一种新的冠状病毒以来[1],新型冠状病毒(SARS-CoV-2)逐渐在全球范围内大流行,且不断变异,世界卫生组织已发布多个需要关注的变异株(VOC)和需要留意的变异株(VOI)。2021年11月9日在南非第一次被检测出、并逐渐成为世界各地流行的优势毒株的奥密克戎(Omicron)变异株正是属于VOC,初步证据表明其对人群再感染风险增高[2];另外,已接种新冠疫苗的病例分类以无症状感染者为主[3]。以上双重因素使病毒可能会更快速且隐匿地传播,增加了及早发现并迅速控制疫情的难度。因此,当前疫情防控压力仍然巨大,不可松懈。
2021年8月国家卫生健康委员会临床检验中心举办的新型冠状病毒德尔塔变异株核酸检测室质评活动中,有来自31 个省(市、自治区)的共8 488 家实验室参加[4],这些实验室为全面落实“外防输入、内防反弹”的防控策略和“及时发现散发病例和聚集性疫情”提供了有力保障[5]。然而在上述实验室中,属于新建的比例很高,工作人员缺乏核酸检测实践经验的比例也相应很高,但是新型冠状病毒核酸检测结果的准确性对疫情防控来说至关重要,故任何可能对结果准确性造成影响的因素都值得探讨。实时荧光逆转录聚合酶链反应(RT-PCR)是我国检测新冠病毒核酸时使用比例最高的方法[4],其反应体系(扩增试剂和核酸样本的混合液)是需要先混匀再瞬离后上机检测,还是直接瞬离后上机检测,《全国临床检验操作规程》[6]和试剂说明书等相关资料均未对此给出明确的答案,亦未见相关报道。本研究探讨了上述操作差异对检测结果的影响,以指导实验室《标准操作规程》的编写,从而规范人员操作,保证新型冠状病毒核酸检测结果的准确性。
1 材料与方法
1.1 仪器与试剂
1.1.1 试剂及耗材
两种新型冠状病毒核酸检测试剂盒(荧光PCR法):试剂1由圣湘生物科技股份有限公司提供,试剂2由达安基因股份有限公司提供。8联PCR管(0.2 mL,光学平盖)则由帝恩生物科技(香港)有限公司提供。生理盐水由四川美大康佳乐药业有限公司提供。
1.1.2 仪器
全自动医用PCR分析系统(Gentier96E)由西安天隆科技有限公司提供,快速混匀器(XK80-A)由江苏新康医疗器械有限公司提供,掌上离心机(D1008E)由大龙兴创实验仪器(北京)股份公司提供。
1.2 样本来源
以试剂盒中的阳性对照为试验样本,其中样本1为试剂1的阳性对照,样本2为试剂2的阳性对照。
1.3 方法
1.3.1 试剂1的检测方法
用生理盐水对样本1进行系列稀释,制备成含不同初始模板数量的试验样本:高浓度试验样本(1∶1)、中浓度试验样本(1∶10)和低浓度试验样本(1∶100),每个浓度水平均设置混匀组和未混匀组,每组各8 孔。用试剂1进行检测,观察每个浓度水平两组的检测结果,以阈值循环数(Ct)表示。观察每个浓度水平两组检测结果的差异。两组试验按下文1.3.3的处理方法。试验参数:样本量20 μL、试剂量30 μL。循环条件:逆转录50 ℃,30 min;预变性95 ℃,1 min;扩增95 ℃ 15 s,60 ℃ 30 s(采集荧光),循环45 次。
1.3.2 试剂2的检测方法
用生理盐水对样本2进行系列稀释,制备成含不同初始模板数量的试验样本:高浓度试验样本(1∶1)、中浓度试验样本(1∶10)和低浓度验样本(1∶100),每个浓度水平均设置混匀组和未混匀组。每组8 孔,用试剂2进行检测,观察每个浓度水平两组检测结果(以Ct值表示)的差异。两组试验按下文1.3.3的处理方法。试验参数:样本量5 μL、试剂量20μL。循环条件:逆转录50 ℃ 2min;预变性95 ℃2 min;预扩增95 ℃ 5 s,60 ℃ 35s,循环10次;扩增95 ℃ 5 s,65 ℃ 35 s(采集荧光),循环32 次。
1.3.3 混匀组与未混匀组的处理方法
混匀组的处理方式:将样本加入装有扩增试剂的8联管,盖严管盖,先用掌上离心机离心5 s(将管壁液体集中于管底),再用快速混匀器振荡10 s,最后用掌上离心机离心15 s,立即用PCR分析仪进行扩增分析。未混匀组的处理方式:将样本加入装有扩增试剂的8联管,盖严管盖,用掌上离心机离心15 s,立即用PCR分析仪进行扩增分析。每对混匀组和未混匀组平行进行,其所用样本、试剂均为同批同瓶,耗材批号相同,仪器设备为同一台。
1.4 统计学方法
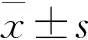
2 结 果
2.1 试剂1各浓度水平混匀组与未混匀组的检测结果比较
用试剂1检测时,每个浓度水平混匀组与未混匀组的检测结果见表1;两个靶基因各浓度水平的组间结果比较,差异均无统计学意义(P>0.05)(见表1)。

表1 试剂1混匀组与未混匀组Ct值比较
2.2 试剂2各浓度水平混匀组与未混匀组的检测结果比较
用试剂2检测时,每个浓度水平混匀组与未混匀组的检测结果见表2。各浓度水平的两组结果进行比较,结果显示高浓度两个靶基因和中浓度N基因的组间差异有统计学意义(P<0.05),其余组间差异无统计学意义(P>0.05)。对有统计学意义的组间差异进一步分析,结果显示各组间的均值之差在0.5以内则在临床可接受范围,即可认为这些组间差异无临床意义(见表3)。

表2 试剂2混匀组与未混匀组Ct值的比较
3 讨 论
新型冠状病毒核酸检测结果是确定新冠肺炎确诊病例和无症状感染者的关键依据[5],其准确性的重要性不言而喻。我国普遍使用实时荧光RT-PCR法,在检测核酸时具有操作简便、效率高、特异性强等优点[8],但样本的质量、检测人员的操作、仪器设备的状态、试剂的质量、核酸污染、非特异性扩增等众多因素都会影响检测结果[9]。为了规范实验室工作人员的操作,以提高人员之间和实验室之间检测结果的准确性和可比性,本研究初步探讨了反应体系混匀与否对新型冠状病毒实时荧光RT-PCR检测结果的影响。
本研究结果显示,对于逆转录时间较长的实时荧光PCR试剂(试剂1)而言,其检测高、中、低浓度水平的样本时,各混匀组与非混匀组检测结果的差异均无统计学意义(P>0.05),说明其反应体系混匀与否对检测结果无影响;而逆转录时间较短的试剂(试剂2)在检测不同浓度水平的样本时则表现出一定差异:部分组间结果的差异具有统计学意义(P<0.05),但进一步分析发现,这些组间的结果差异在0.5以内。而实时荧光PCR试验的样本初始模板量X与Ct值的关系如下:
logX=-Ct×log(1+E)+logYCt
其中,E表示扩增效率,YCt表示荧光扩增信号达到阈值时扩增产物的量[10]。
根据以上关系,可以计算出当Ct值偏差<0.5时,logX差异不足0.15(假设扩增效率E为1),满足分子诊断领域对总允许误差(TEa)的要求(靶值±0.4对数值)[11],陈培松等[7]认为偏差小于1的Ct值可视为一致。因此可以认为试剂2检测不同浓度水平的样本时,反应体系混匀与否对检测结果亦无影响。对于两种试剂所表现出的细微差异,可能与液体间的扩散特性有关,试剂和样本加在一起后,即使不通过振荡混匀,两者也可通过液体间相互扩散而自然达到混匀状态,但自然混匀与温度、时间等因素有关:在一定范围内,温度越高、时间越长则两者混匀越充分。两种试剂的逆转录温度均为50 ℃,较高的温度有利于样本与试剂自然混匀,但两者在此阶段的时长差别显著,可能是造成它们表现不同的原因之一。试剂1的逆转录时间为30 min,试剂2为2 min。对于试剂1来说,除去自然混匀所需的时间,此阶段剩余的时间仍然足够长,两组反应体系反应的充分程度几乎无差别,所以组间结果无差异;而对于试剂2,因其此阶段时间太短,未混匀组反应体系反应的充分程度可能不及混匀组,所以组间结果有细微差异。至于试剂2在检测不同浓度样本时所表现出的差异,则可能与检测系统的精密度随分析物浓度降低而降低这一规律有关,即对于低浓度样本,其检测结果的精密度相对较差[12],掩盖了操作差异引起的结果偏差。从表1和表2也可以看出,随着样本浓度降低,检测结果的精密度变小(标准差变大)。
综上所述,本研究认为:在用实时荧光RT-PCR法检测新型冠状病毒核酸时,反应体系是否预先混匀对于检测结果无影响。因此在工作中反应体系不必进行瞬离前的混匀操作,可以减少操作步骤,提高工作效率,其效果在大规模核酸检测时会显得更明显。
本研究的局限性在于:样本来自于试剂盒的阳性对照,可能与临床样本存在差异;两种试剂来自于不同厂家,两者除了逆转录时长不同,样本与试剂的体积亦不同,因此两种试剂表现出的细微差异不能充分说明是由逆转录时长不同造成的,亦可能与样本试剂体积有关。本研究所选用试剂种类较少,结论是否适用其他相同方法的试剂盒还有待验证。

