苹果多酚通过调控Keap1/Nrf2通路减轻脂多糖诱导的大鼠急性肺损伤*
汤建华, 詹旭莉, 冯 平, 张志华△
(1河北北方学院附属第一医院药学部,河北 张家口 050051;2河北北方学院附属第一医院呼吸科,河北 张家口 050051)
急性肺损伤(acute lung injury,ALI)是多种因素导致肺组织发生病理改变的临床综合征[1]。该疾病的临床表现是急性发作、进行性低氧血症和胸部X光片上的双侧肺浸润[2]。尽管为寻找潜在的治疗策略付出了相当大的努力,但保护性通气策略、限制性液体管理和抗生素应用仍是ALI 患者唯一可用的治疗选择。然而,这些措施在降低ALI 患者的高死亡率方面效果有限[3]。因此,进一步探索ALI的潜在治疗方法是必要且紧迫的。苹果多酚(apple polyphenols,AP)是一种从未成熟苹果中提取的化合物,其具有抗氧化和抗炎特性[4]。据报道,AP 能够改善大鼠低氧性肺动脉高压[5]。提示AP 对肺具有保护作用。而AP 对脂多糖(lipopolysaccharide,LPS)诱导大鼠ALI 的影响鲜有报道。Kelch 样环氧氯丙烷相关蛋白 1(Kelch-like epichlorohydrin-associated protein 1,Keap1)/核转录因子 E2 相关因子 2(nuclear factor-E2-related factor 2,Nrf2)通路被认为是最关键的内源性抗氧化应激通路之一,是炎症相关疾病的重要靶点[6]。相关研究表明,激活Keap1/Nrf2 通路可减轻LPS 诱导的小鼠 ALI[7]。而 AP 能否通过调控 Keap1/Nrf2 通路对LPS 诱导大鼠ALI 发挥作用尚不明确。因此,本研究主要探究AP 对LPS 诱导大鼠ALI 的影响以及其作用机制。
材料和方法
1 动物
72 只体质量为 140~160 g 的 6 周龄 SPF 级雄性SD 大鼠购自广州锐格生物科技有限公司,生产许可证号为SCXK(粤)2021-0059。所有动物实验得到本院动物伦理委员会的批准。
2 主要试剂
AP、Nrf2抑制剂ML385购自上海源叶生物公司;LPS 购自北京伊塔生物公司;地塞米松(dexamethasone,DEX)购自北京索莱宝科技公司;大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)ELISA试剂盒购自上海广锐生物公司;丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自上海远慕生物公司;细胞核蛋白提取试剂盒购自上海联硕生物公司;兔源1 抗Keap1、Nrf2、血红素氧合酶1(heme oxygenase-1,HO-1)、GAPDH、histone、辣根过氧化物酶标记的山羊抗兔Ⅱ抗均购自Abcam。
3 主要方法
3.1 ALI 大鼠模型的构建 参照文献[8]复制ALI 大鼠模型,简言之,利用1%戊巴比妥钠麻醉大鼠,将大鼠固定于手术台上,剪开皮肤,暴露气管,向气管内缓慢注射5 mg/kg LPS以构建ALI模型。
3.2 动物分组及给药处理 按照随机数字表法将72只大鼠随机分为对照(control)组、模型(model)组、低剂量AP(low-dose AP,AP-L)组、高剂量 AP(highdose AP,AP-H)组、DEX 组、AP-H+ML385 组,每组12只。AP-L组、AP-H 组[9-10]、DEX 组[11]大鼠分别腹腔注射25 mg/kg AP、100 mg/kg AP、5 mg/kg DEX,而APH+ML385组[12]大鼠需同时腹腔注射100 mg/kg AP 和30 mg/kg ML385,control 组、model组大鼠腹腔注射等量的生理盐水,每天腹腔注射给药1 次,持续给药14天。末次给药1 h 后,除control 组外,其它组大鼠均采用向气管内注射5 mg/kg LPS 的方法构建ALI 模型,control 组大鼠的气管内注射等体积的生理盐水,造模24 h后,麻醉大鼠,收集每组大鼠肺泡灌洗液用于细胞总数、中性粒细胞数的检测,收集每组全部大鼠血清用于TNF-α、IL-6 水平的检测。肺泡灌洗液、血清收集完毕后,处死大鼠,收集大鼠肺组织,分为3部分(每部分包含每组4 只大鼠肺组织),一部分用于HE 染色,一部分用于肺组织湿重(wet weight,W)/干重(dry weight,D)比的检测,剩余一部分用于氧化应激指标、RT-qPCR、western blot实验检测。
3.3 肺泡灌洗液中细胞总数、中性粒细胞数的检测 向大鼠气管内注射1 mL 预冷的PBS 灌洗肺泡,重复灌洗3 次,肺泡灌洗液的回收率达75%,将肺泡灌洗液在 4 ℃下以 250 ×g离心 10 min,收集细胞沉淀,将细胞沉淀用PBS 悬浮,利用细胞计数板计数总细胞数。将细胞沉淀涂片,进行瑞氏染色后对中性粒细胞进行计数。
3.4 ELISA法检测大鼠血清中TNF-α和IL-6水平严格按照试剂盒说明书检测大鼠血清中TNF-α 和IL-6水平。
3.5 HE 染色检测各组大鼠肺组织病理损伤情况将各组大鼠的右侧肺组织在4%多聚甲醛中固定过夜。经包埋、切成4 μm 厚的切片后进行HE 染色。在光学显微镜下观察肺组织病理损伤,并进行病理评分,评分标准[13]:0 分为无病理损伤;1 分为≤25%的肺组织存在病理损伤;2分为>25%且≤50%的肺组织存在病理损伤;3分为>50%且≤75%的肺组织存在病理损伤;4分为>75%的肺组织存在病理损伤。
3.6 大鼠肺组织W/D 的检测 称量各组大鼠新鲜右侧肺组织质量记录为湿重,称量后将大鼠肺组织放入60 ℃烘箱中烘烤48 h 后再称量质量记录为干重,计算肺组织W/D比。
3.7 大鼠肺组织中SOD、GSH-Px 活性、MDA 含量、ROS 水平的检测 干重严格按照试剂盒说明书检测大鼠肺组织中 SOD、GSH-Px 活性、MDA 含量。DCFH-DA 荧光探针检测大鼠肺组织中ROS 水平,记录各组的荧光强度值,结果以相对于control 组荧光强度值表示。
3.8 RT-qPCR 检测肺组织中Keap1 和Nrf2 mRNA的表达 使用TRIzol 试剂从肺组织匀浆中分离总RNA。将 RNA 逆转录为 cDNA 后,以 cDNA 为模板进行 RT-qPCR 反应。以 GAPDH 为内参照,通过 2-ΔΔCt法计算基因相对表达量。GAPDH 的正向引物序列为5′-CATTCTTCCACCTTTGAT-3′,反向引物序列为 5′-CTGTAGCCATATTCATTGT-3′;Keap1 的正向引物序列为 5′-ATCGCTGCTGTCTCTGTA-3′,反向引物序列为 5′-GTTCTGCTGCCTCTTCTG-3′;Nrf2 的正向引物序列为5'-CCAACACACGGTCCACAGCT-3',反向引物序列为5'-TCCGTCGCTGACTGAAGTCAA-3'。
3.9 Western blot 检测肺组织中 Keap1、Nrf2 蛋白的表达 RIPA 裂解液提取肺组织匀浆总蛋白用于Keap1、GAPDH 蛋白的检测;细胞核蛋白提取试剂盒提 取的肺组织匀浆中的核蛋白用于Nrf2、histone 蛋白的检测。简言之,将蛋白质经定量、电泳、转膜、封闭后,将膜分别与Ⅰ抗 Keap1(1∶2 000)、GAPDH(1∶1 000)、Nrf2(1∶2 000)、Histone(1∶1 000)在 4 ℃下过 夜孵育,再在37 ℃下与Ⅱ抗(1∶1 000)共孵育2 h。加入ECL 试剂观察蛋白条带显色情况,经Quantity-One软件量化蛋白灰度值。
4 统计学处理
使用GraphPad Prism 8 进行统计分析,所有数据以平均值±标准差(mean±SD)表示。单因素方差分析用于比较多组之间的差异,进一步两组间的比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 AP 对各组大鼠肺泡灌洗液中细胞总数和中性粒细胞数的影响
与contrl 组比较,model 组大鼠肺泡灌洗液中细胞总数和中性粒细胞数升高(P<0.05);与model 组比较,AP-L 组、AP-H 组和 DEX 组大鼠肺泡灌洗液中细胞总数和中性粒细胞数降低(P<0.05);与AP-L 组比较,AP-H 组和DEX 组大鼠肺泡灌洗液中细胞总数和中性粒细胞数降低(P<0.05);与AP-H组比较,APH+ML385组大鼠肺泡灌洗液中细胞总数和中性粒细胞数升高(P<0.05),见表1。

表1 AP 对各组大鼠肺泡灌洗液中细胞总数和中性粒细胞数的影响Table 1. Effects of AP on the total number of cells and the number of neutrophils in the bronchoalveolar lavage fluid of rats in each group(×105 mL-1. Mean±SD. n=12)
2 AP对各组大鼠血清TNF-α和IL-6水平的影响
与 control 组比较,model 组大鼠血清中 TNF-α 和IL-6 水平升高(P<0.05);与model 组比较,AP-L 组、AP-H 组和 DEX 组大鼠血清中 TNF-α 和 IL-6 水平降低(P<0.05);与AP-L组比较,AP-H 组和DEX 组大鼠血清中TNF-α和IL-6水平降低(P<0.05);与AP-H 组比较,AP-H+ML385组大鼠血清中TNF-α和IL-6水平升高(P<0.05),见表2。

表2 AP对各组大鼠血清中TNF-α和IL-6水平的影响Table 2. The effect of AP on the levels of TNF-α and IL-6 in serum of rats in each group(ng/L. Mean±SD. n=12)
3 AP对各组大鼠肺组织病理损伤的影响
HE 染色结果显示,control 组大鼠肺组织结构正常,肺泡腔清晰可见,肺泡壁薄,未见炎性细胞浸润;model组大鼠肺组织结构异常,肺泡腔出血、渗出,肺泡壁增厚,可见大量炎性细胞浸润;与model组比较,AP-L 组、AP-H 组和DEX 组大鼠肺组织病理损伤减轻,病理评分降低(P<0.05);与AP-H 组比较,AP-H+ML385 组大鼠肺组织病理损伤严重,病理评分升高(P<0.05),见图1。
4 AP对各组大鼠肺组织W/D的影响
与 control 组比较,model 组大鼠肺 W/D 升高(P<0.05);与Model组比较,AP-L组、AP-H组和DEX组大鼠肺W/D 降低(P<0.05);与AP-L 组比较,AP-H 组和DEX 组大鼠肺W/D 降低(P<0.05);与AP-H 组比较,AP-H+ML385组大鼠肺W/D升高(P<0.05),见图2。

Figure 1. The effect of AP on the lung tissue pathological damage score of rats in each group(HE staining,scale bar=50 μm). Black arrow:alveolar space;red arrow:alveolar wall. Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs AP-L group;▲P<0.05 vs AP-H group.图1 AP对各组大鼠肺组织病理损伤评分的影响
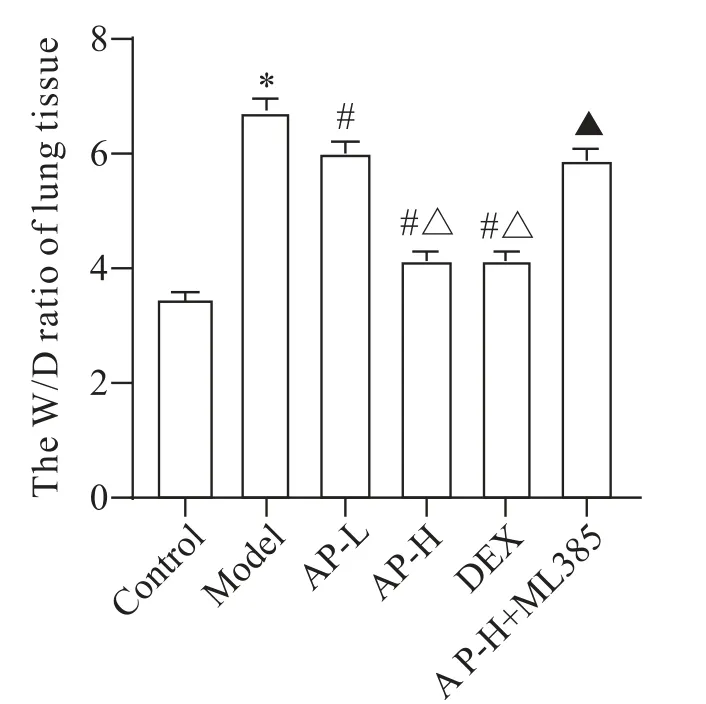
Figure 2. The effect of AP on the W/D ratio of rat lung tissues in each group. Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs AP-L group;▲P<0.05 vs AP-H group.图2 AP对各组大鼠肺组织W/D的影响
5 AP对各组大鼠肺组织中SOD、GSH-Px、MDA和ROS水平的影响
与control 组比较,model组大鼠肺组织中SOD 和GSH-Px 活性降低,MDA 含量和 ROS 水平升高(P<0.05);与model组比较,AP-L组、AP-H组和DEX组大鼠肺组织中SOD 和GSH-Px 活性升高,MDA 含量和ROS 水平降低(P<0.05);与AP-L 组比较,AP-H 组和DEX组大鼠肺组织中SOD和GSH-Px活性升高,MDA含量和ROS水平降低(P<0.05);与AP-H组比较,APH+ML385组大鼠肺组织中SOD和GSH-Px活性降低,MDA含量和ROS水平升高(P<0.05),见图3。
6 AP 对各组大鼠肺组织中Keap1/Nrf2 通路相关因子mRNA及蛋白表达的影响
与control 组比较,model 组大鼠肺组织Keap1 mRNA、Nrf2 mRNA、HO-1 mRNA、Keap1、HO-1 蛋白及核 Nrf2 蛋白表达水平均显著降低(P<0.05);与model 组比较,AP-L 组、AP-H 组和 DEX 组大鼠肺组织 Keap1 mRNA、Nrf2 mRNA、HO-1 mRNA、Keap1、HO-1 蛋白及核Nrf2 蛋白表达水平均显著升高(P<0.05);与 AP-L 组比较,AP-H 组和 DEX 组大鼠肺组织Keap1 mRNA、Nrf2 mRNA、Keap1、HO-1 蛋白及核Nrf2蛋白表达水平均显著升高(P<0.05);与AP-H 组比较,AP-H+ML385 组大鼠肺组织Keap1 mRNA、Nrf2 mRNA、HO-1 mRNA、Keap1、HO-1 蛋白及核Nrf2蛋白表达水平均显著降低(P<0.05),见图4。
讨 论

Figure 3. Effects of AP on SOD activity,GSH-Px activity,MDA content and ROS level in lung tissues of rats in each group. Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs AP-L group;▲P<0.05 vs AP-H group.图3 AP对各组大鼠肺组织中SOD活性、GSH-Px活性、MDA含量和ROS水平的影响

Figure 4. Comparison of Keap1,HO-1 and Nrf2 mRNA and protein expression levels in lung tissues of rats in each group. A:comparison of Keap1,Nrf2 and HO-1 mRNA expression in lung tissues of rats in each group;B:Western blot was used to detect Keap1,Nrf2 and HO-1 protein expression in rat lung tissues. Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs AP-L group;▲P<0.05 vs AP-H group.图4 各组大鼠肺组织中Keap1、Nrf2和HO-1 mRNA及蛋白表达的比较
ALI是人类日益关注的问题,并且经常导致具有高发病率和死亡率的急性呼吸窘迫综合征[14]。真菌、病毒和细菌感染是ALI 的主要原因。具体来说,革兰氏阴性菌,如铜绿假单胞菌,会分泌各种内毒素,包括LPS。暴露于LPS会加速中性粒细胞募集和促炎分子的表达,最终加剧ALI的进展[15]。LPS 长期以来被广泛用于诱导ALI 大鼠肺部炎症[16]。本研究通过向气管内注射LPS以构建ALI大鼠模型,结果显示,与对照组比较,模型组大鼠肺组织病理损伤严重,提示造模成功。中性粒细胞在ALI 的发病机制中起重要作用,去除中性粒细胞可以减少ALI 的损害[17];肺水肿是ALI 发病机制的中心环节,肺组织的W/D 比可用来评估肺水肿的程度[18];促炎细胞因子IL-6、TNF- α 在 ALI 的发生发展中起重要调控作用[19];此外,氧化应激是 LPS 引起 ALI 的主要特征之一,在该过程中肺组织SOD、GSH-Px 活性降低,MDA含量升高[20];LPS 可通过增加 ROS 的生成引起氧化应激,ROS 的过多积累可引起肺水肿以及大量的炎性细胞浸润,进而导致ALI[8]。本研究显示,与对照组比较,模型组细胞总数、中性粒细胞数、W/D比、IL-6、TNF-α、MDA、ROS含量升高,SOD、GSH-Px活性降低,提示氧化应激及炎症反应参与了模型大鼠ALI过程,进而造成肺组织病理损伤严重。
AP是苹果中多元酚类化合物的总称,具有抗炎、抗氧化的特性。如AP对LPS诱发的小鼠单核/巨噬细胞 RAW264.7 细胞炎症具有抑制作用[21];AP 可以提高高脂血症小鼠的抗氧化能力[22]。而关于AP对LPS诱导的大鼠ALI 的影响鲜有报道。本研究显示,低、高剂量AP可抑制ALI大鼠肺组织炎症反应及氧化应激,减轻肺组织病理损伤,且AP 剂量越高,对应的趋势越明显;而AP-H 组与DEX 组比较,对应指标变化差异无统计学意义,提示AP 可能通过抑制炎症反应及氧化应激对LPS诱导的大鼠ALI发挥保护作用。
Keap1/Nrf2信号通路是重要的抗氧化通路,在正常生理状态下,Nrf2 和Keap1 位于细胞质中。然而,当氧化应激被激活时,蛋白激酶将被激活以诱导Nrf2与Keap1解离并转移到细胞核中,入核的Nrf2与抗氧化反应元件(如HO-1)结合,启动抗氧化蛋白的转录,进而发挥抗氧化作用[23]。据报道,百合固金汤通过激活Keap1/Nrf2信号通路对LPS诱导的小鼠ALI发挥保护作用[24]。提示Keap1/Nrf2信号通路的激活可对LPS诱导的ALI 发挥保护作用。本研究结果与其是一致的,本研究显示,模型组大鼠肺组织中Keap1 mRNA、Nrf2 mRNA、HO-1 mRNA、Keap1、HO-1蛋白及核Nrf2蛋白表达降低,AP-L组、AP-H组大鼠肺组织中上述指标表达升高,且AP 剂量越高,对应的升高趋势越明显,Model组Keap1表达下调,鉴于Keap1对Nrf2的锚定作用,此时Nrf2应呈现胞质定位减少而入核增多,因此核Nrf2 蛋白量应增加,但本研究Model 组中核Nrf2 含量反而降低,这可能是由于ALI 过程中,机体出现自噬功能障碍,使得p62与Nrf2间的反馈回路无法被破坏,使得Nrf2在胞浆呈持续激活或延长激活状态导致的[25]。基于上述结果推测AP 可能通过激活Keap1/Nrf2信号通路对LPS诱导的大鼠ALI发挥保护作用。为了验证该猜想,本研究在高剂量AP 处理的基础上再加上Nrf2抑制剂ML385干预ALI大鼠,结果显示,ML385减弱了高剂量AP对LPS诱导的大鼠ALI的保护作用,证实了猜想是正确的。
综上所述,AP 可能通过激活Keap1/Nrf2 信号通路对LPS 诱导的大鼠ALI发挥保护作用。AP 可能具有临床治疗LPS诱导的ALI的潜力。

