陈皮药材HPLC特征图谱的建立
刘根才 华 杰
浙江维康药业股份有限公司,浙江 丽水 323000
陈皮为芸香科植物橘Citri Reticulatae Pericarpium及其栽培变种的干燥成熟果皮,采摘成熟果实,剥取果皮,晒干或低温干燥。陈皮具有理气健脾,燥湿化痰的功效,用于脘腹胀满,食少吐泻,咳嗽痰多[1]。2020年版《中国药典》陈皮药材标准中控制的质量属性有性状、鉴别、检查、含量测定等,未对初步确定的关键质量属性水溶性浸出物及主要化学成分(指纹图谱)进行控制。
中药指纹图谱是目前中药产品质量控制主要手段之一,可更全面的反映中药产品整体特征[2]。指纹图谱研究常用高效液相色谱法、气相色谱法、薄层色谱法等[3],陈皮主要化学成分为主要有黄酮类化合物、挥发油类、柠檬苦素类、生物碱类和微量元素等[4- 6]。其中黄酮类橙皮苷是陈皮中最主要活性成分之一,具有维持血压正常渗透压、降低血管脆性、降低人体胆固醇含量、抗过敏、降血压、抑制癌变和抗病毒,抑菌,消炎,保肝等的作用[7-14],其检测方法主要为高效液相色谱法,检测器为因紫外检测器,紫外检测器具有灵敏度高、噪音低、线性范围宽、有较好的选择性,应用范围广,因此选择高效液相色谱法紫外检测器作为陈皮指纹图谱方法开发的检测器。
陈皮药材可增加指纹图谱方法进行专属性鉴别,本试验收集了不同产地的陈皮药材,采用高效液相色谱法对其进行专属性鉴别,建立了陈皮药材HPLC指纹图谱,为更好地控制陈皮药材质量提供了可靠的方法依据。
1 仪器与材料
1.1 材料 橙皮苷对照品(批号:110721-201818,中国食品药品检定研究院);川陈皮素对照品(批号:PS020082,成都普思生物科技股份有限公司);桔皮素对照品(批号:PS010637,成都普思生物科技股份有限公司);陈皮药材(CP21060801,广东省新会区;CP21060802,浙江省衢州区;CP21060803,四川省青白江区;CP21061101,浙江省开化县;CP21061102,四川省金堂县;CP21061103,河南省淅川县;CP21061501,广东省新会区;CP21061502,广东省新会区;CP21061503,湖南省汉寿县;CP21061504,湖南省汉寿县;CP21061505,四川省高县;CP21061506,四川省三台县;CP21061507,湖南省泸溪县;CP21062201,湖南省石门县;CP21062202,湖南省中方县;CP21062203,湖南省沅江市;CP21062204,浙江省衢州区),均购自浙江惠松制药有限公司。乙腈[色谱纯,批号:193478,赛默飞世尔科技(中国)有限公司]、甲酸(分析纯,批号:1801089)、甲醇(分析纯,批号:20190912)、乙醇(分析纯,批号:20191011),均购自国药集团化学试剂有限公司。
1.2 仪器 Waters 2695高效液相色谱仪,Kromasil 100-5-C18色谱柱(5 μm,4.6 mm×250 mm,Kromasil),BK-900B超声仪(济南巴克超声波仪器有限公司),MS205DU十万分之一电子天平(梅特勒-托利多),FA2004万分之一电子天平(上海舜宇恒平仪器有限公司),LD610-2百分之一电子天平(沈阳龙腾电子科技有限公司),药典检验筛(浙江上虞市华丰五金仪器有限公司)。
2 方法与结果
2.1 陈皮粉末的制备 取陈皮药材适量粉碎,过二号筛(24目),即得。
2.2 对照品溶液的制备 取橙皮苷、川陈皮素、桔皮素对照品适量,精密称定,加甲醇制成浓度分别为0.4 mg/mL的溶液,即得。
2.3 供试品溶液的制备 取本品粗粉(过二号筛),取约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定重量;超声处理30 min(功率900 W,频率60 kHz),放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.4 色谱条件与系统适用性试验 Kromasil 100-5-C18型色谱柱(4.6 mm×250 mm,5 μm);以乙腈为流动相A,以0.1%甲酸溶液为流动相B,按下表进行梯度洗脱;柱温为30 ℃;流速为 1.0 mL/min;检测波长为283 nm。见表1。
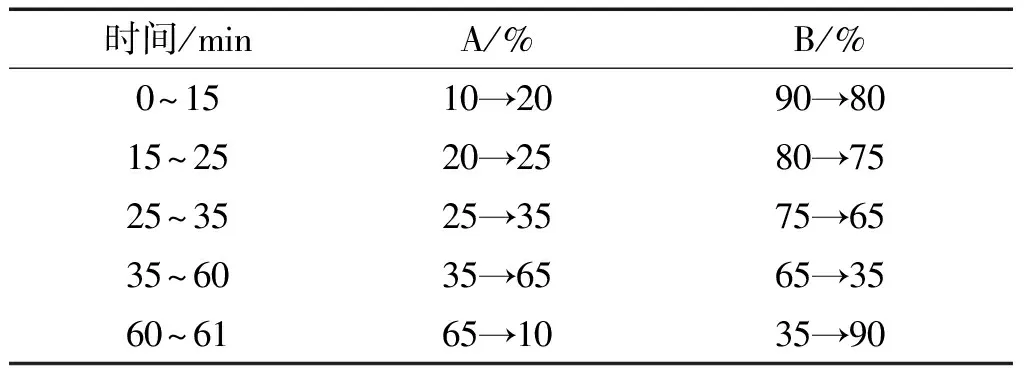
表1 陈皮药材HPLC特征图谱梯度洗脱表
2.5 方法学考察
2.5.1 专属性试验 取空白(甲醇)、橙皮苷、川陈皮素、桔皮素、陈皮药材CP21061504,按“2.2”“2.3”项下方法制备对照品溶液和供试品溶液,按照“2.4”项下色谱条件进样检测分析。结果如图1所示。

从下至上依次为:空白(甲醇)、橙皮苷、川陈皮素、桔皮素、陈皮CP21061504供试品图1 专属性试验对比图
结果表明,空白溶剂未在供试品色谱相应位置出峰,供试品色谱中含有与橙皮苷、桔皮素、川陈皮素对照品保留时间且紫外吸收光谱一致的峰(详见表2),说明该方法专属性良好。
2.5.2 精密度试验 取陈皮药材CP21061504,按“2.3”项下方法制备供试品溶液,按照“2.4”项下色谱条件连续进样5针,每次进样10 μL,将得到5针AIA数据导入《中药色谱指纹图谱相似度评价系统(2012版)》计算软件进行分析,参数设置为:以供试品1-1(S1)色谱图为参照图谱,生成方法中位数,时间窗0.3;多点校正;全峰匹配,计算相似度结果,并对指纹图谱中8个明显特征峰进行标记,计算7个标记峰与标记S峰(橙皮苷)的相对保留时间及相对峰面积,如图2所示。结果表明,连续进样的5针供试品溶液指纹图谱相似度均大于0.99,各供试品溶液与对照指纹图谱之间的相似度均大于0.99,7个明显特征峰的峰相对保留时间RSD均小于1.0%,相对峰面积小于5.0%,说明该仪器精密度良好。
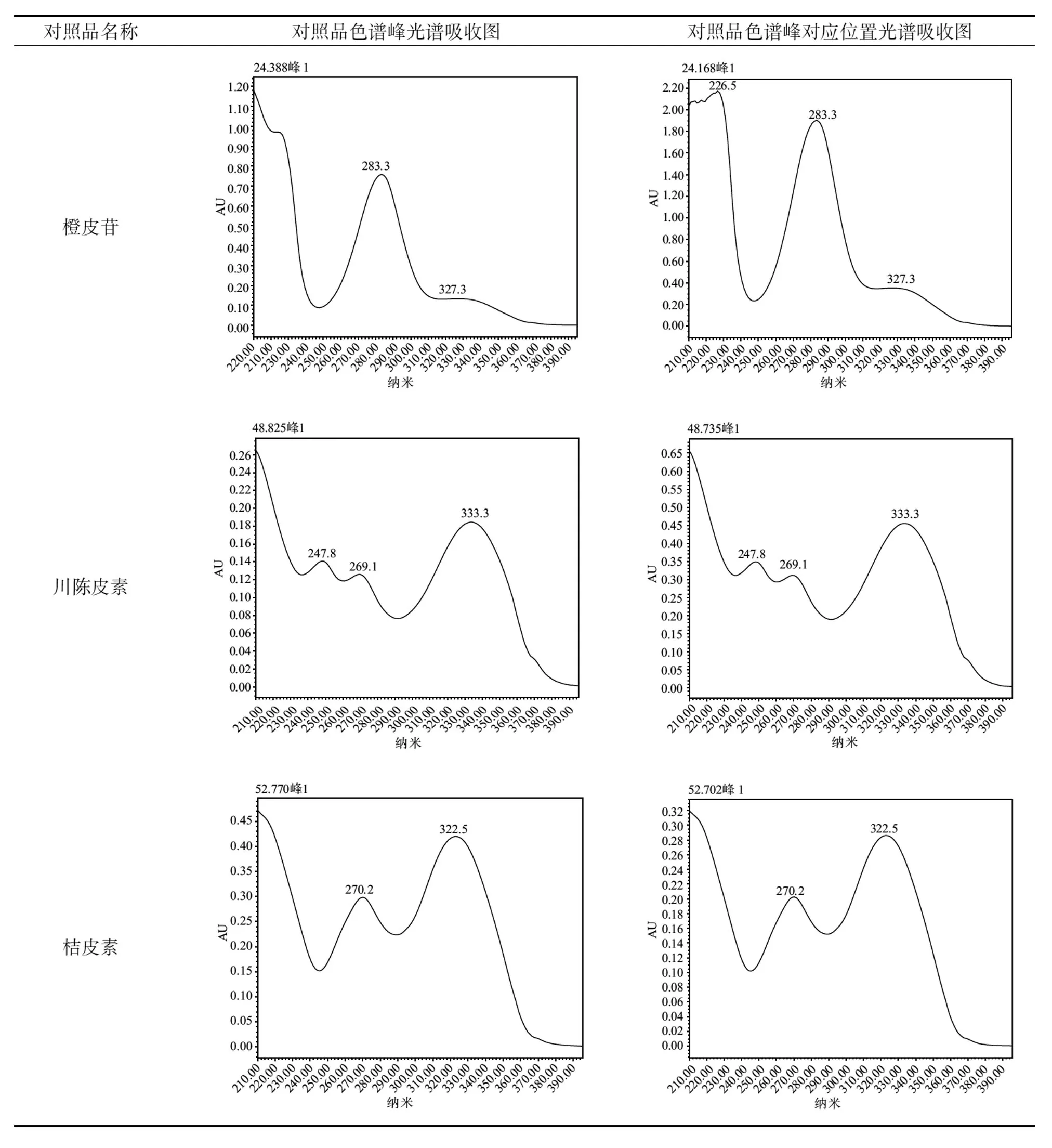
表2 对照品与陈皮药材供试品紫外图谱吸收
2.5.3 重复性试验 取陈皮药材CP21061504,按“2.3”项下方法平行制备6份供试品溶液,按照“2.4”项下色谱条件各进样10 μL,将得到的AIA数据导入《中药色谱指纹图谱相似度评价系统(2012版)》计算软件进行分析,参数设置为:以供试品1(S1)色谱图为参照图谱,生成方法中位数,时间窗0.3;多点校正;全峰匹配,计算相似度结果,计算7个标记峰与标记S峰(橙皮苷)的相对保留时间及相对峰面积,如图3所示。结果表明,6个供试品呈现出的色谱相似度均大于0.99,各供试品溶液与对照指纹图谱之间的相似度均大于0.99,特征峰(同精密度项下)相对保留时间RSD均小于1.0%,相对峰面积RSD均小于5.0%,说明该方法重复性良好。
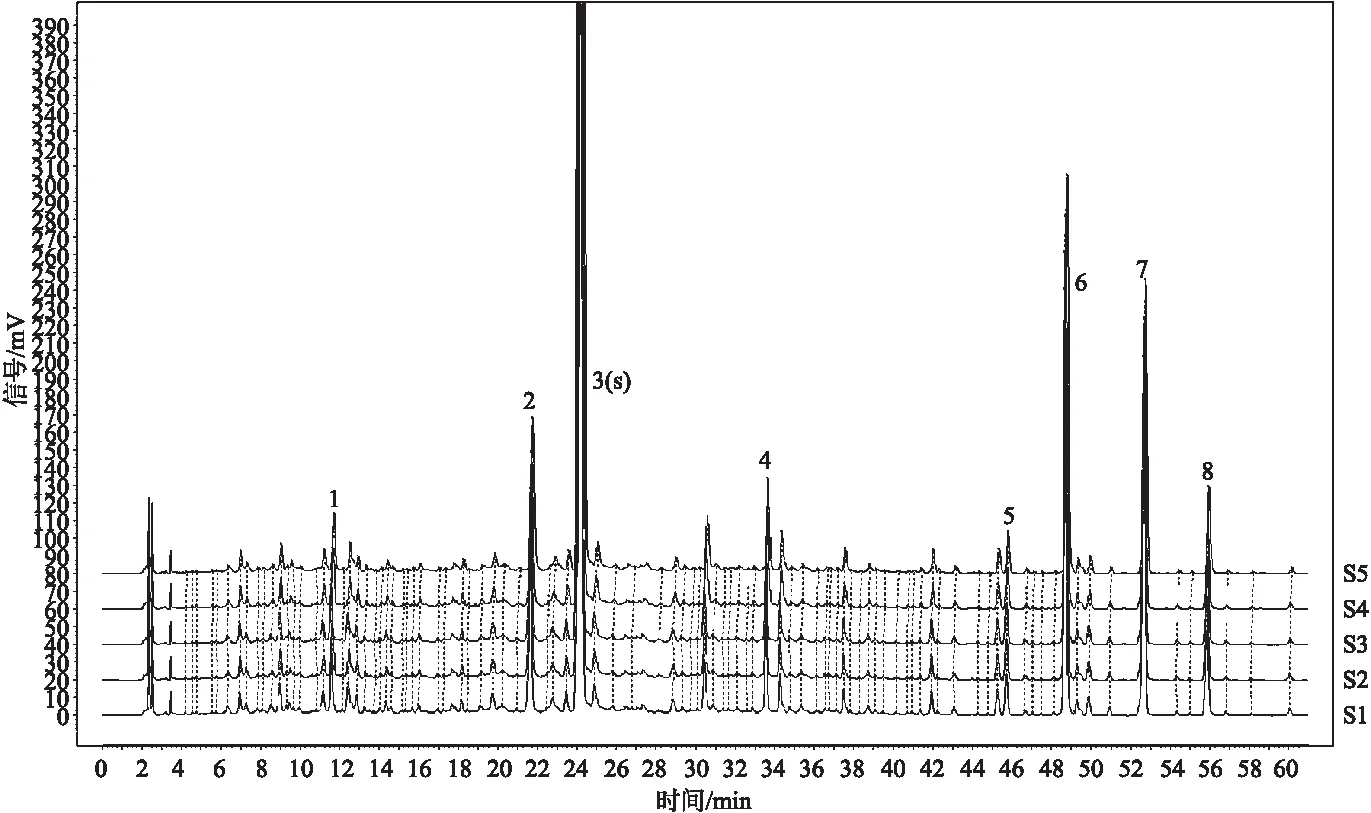
注:从下至上依次为:供试1-1、供试1-2、供试1-3、供试1-4、供试1-5。图2 仪器精密度试验图
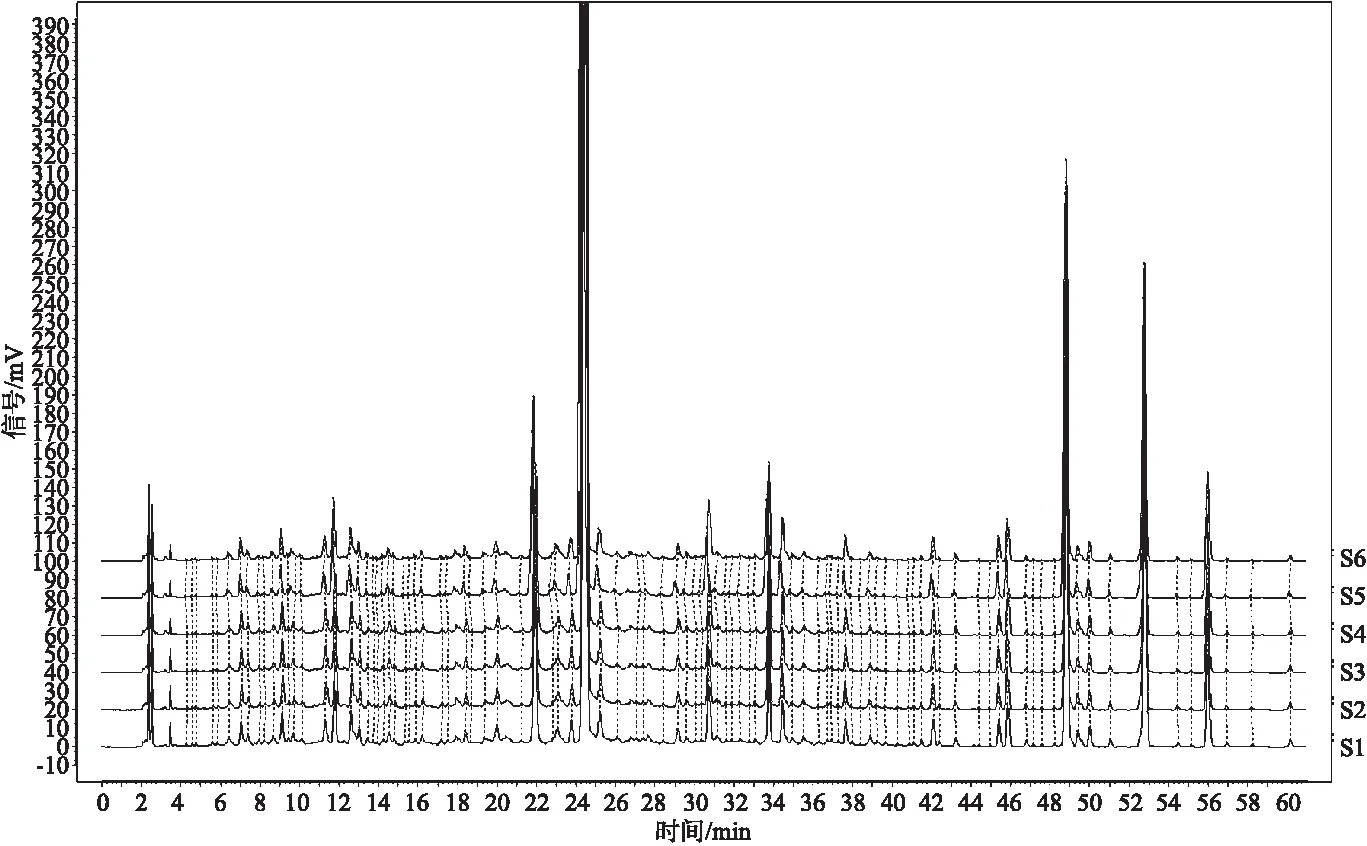
注:从下至上依次为:供试品1、供试品2、供试品3、供试品4、供试品5、供试品6。图3 重复性试验图
2.5.4 溶液稳定性试验 取陈皮药材CP21061504,按“2.3”项下方法制备供试品溶液,分别在0 h、6 h、12 h、18 h、24 h按照“2.4”项下色谱条件各进样10μL进样检测,将得到的AIA数据导入《中药色谱指纹图谱相似度评价系统(2012版)》计算软件进行分析,参数设置为以0 h(S1)色谱图为参照图谱,生成方法中位数,时间窗0.3;多点校正;全峰匹配,计算相似度结果,计算7个标记峰与标记S峰(橙皮苷)的相对保留时间及相对峰面积,如图4所示。结果表明,不同时间点测得的色谱相似度均大于0.99,各时间点供试品溶液与对照指纹图谱之间的相似度均大于0.99,特征峰(同精密度项下)相对保留时间RSD均小于1.0%,相对峰面积RSD均小于7.0%,该供试品溶液在常温放置24 h内稳定性良好。
2.5.5 中间精密度考察 按照“2.4”项下色谱条件,按“2.3”项下方法制备供试品溶液,取陈皮药材CP21061504供试品溶液考察随机变动因素不同日期、不同分析人员、不同仪器对重复性的影响,记录色谱图。将得到的AIA数据导入《中药色谱指纹图谱相似度评价系统(2012版)》计算软件进行分析,参数设置为:以实验员A供试1(S1)色谱图为参照图谱,生成方法中位数,时间窗0.3;多点校正8个峰;全峰匹配,计算7个标记峰与标记S峰(橙皮苷)的相对保留时间及相对峰面积,如图5所示。结果表明,12个指纹图谱之间的相似度均在0.96以上,与对照指纹图谱之间的相似度均在0.99以上,各特征峰相对保留时间RSD均小于3.0%,个别色谱峰相对峰面积RSD较大,但是不影响整体识别。说明该方法中间精密度良好。
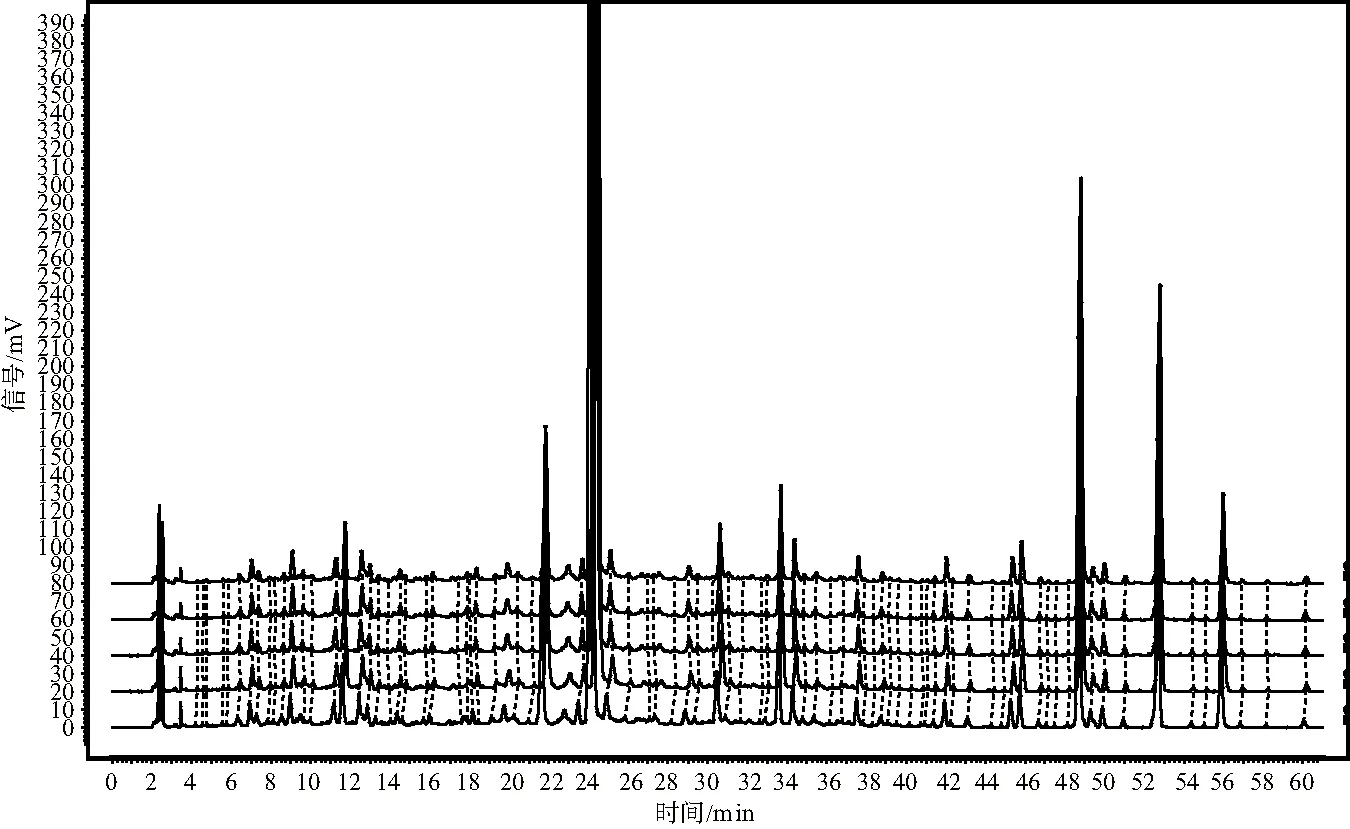
注:从下至上依次为0 h、6 h、12 h、18 h、24 h图4 溶液稳定性试验图
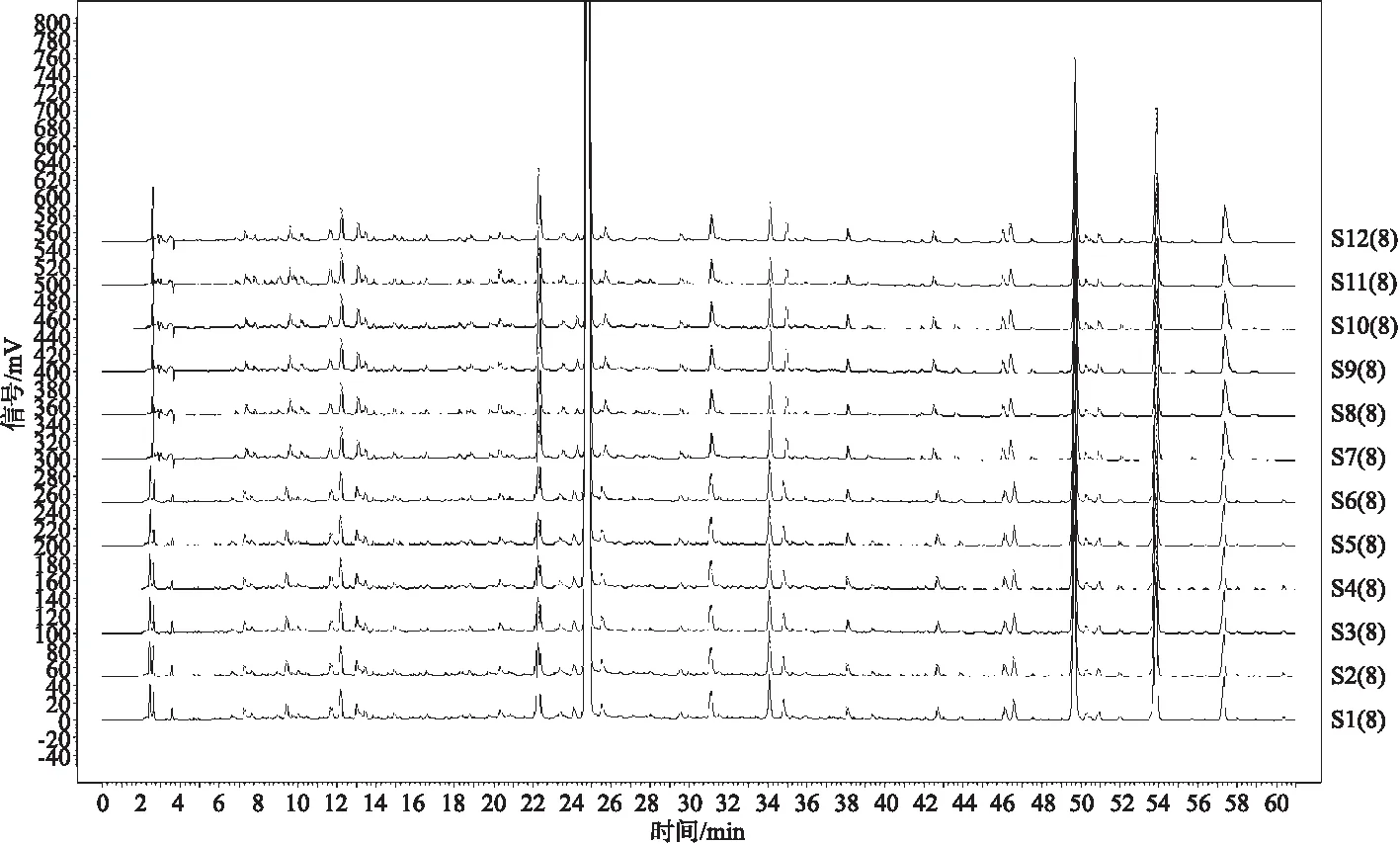
注:S1-S12依次为实验员A重复性1-6、实验员B重复性1-6图5 中间精密度试验考察对比图
2.6 评价标准的确定 按照“2.4”项下色谱条件,按“2.3”项下方法制备供试品溶液,对17批陈皮药材供试品溶液进行指纹图谱检测,将17批陈皮药材指纹图谱与陈皮药材对照指纹图谱AIA数据导入《中药色谱指纹图谱相似度评价系统(2012版)》计算软件进行分析,参数设置为:以S1(药材对照指纹图谱)为参照图谱,生成方法中位数,时间窗0.3;多点校正8个峰;全峰匹配,计算陈皮药材与药材对照指纹图谱的相似度,结果如图6所示。结果显示,17批陈皮药材与陈皮药材对照特征图谱的相似度均在0.90以上,表明陈皮药材、陈皮药材特征图谱具有相关性。
计算各特征峰与S峰的相对保留时间,17批陈皮药材特征峰相对保留时间分别为:峰1在0.476~0.483范围内,峰2在0.895~0.897范围内,峰4在1.387~1.396范围内,峰5在1.871~1.887范围内,峰6在2.013~2.031范围内,峰7在2.176~2.196范围内,峰8在2.307~2.328范围内,均符合陈皮药材特征图谱标准规定。故最终建立陈皮药材特征图谱标准同药材,即供试品特征图谱中应呈现8个特征峰,与参照物(橙皮苷)峰相应的峰为S峰,计算各特征峰与S峰的相对保留时间,应在规定值的加减10%范围内。相对保留时间规定值为0.486(峰1)、0.898(峰2)、1.380(峰4)、1.874(峰5)、1.996(峰6)、2.153(峰7)、2.287(峰8)。
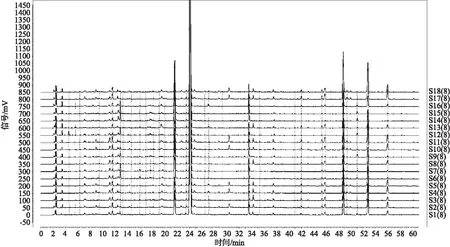
注:从下至上依次为陈皮药材对照、CP21060801、CP21060802、CP21060803、CP21061101、CP21061102、CP21061103、CP21061501、CP21061502、CP21061503、CP21061504、CP21061505、CP21061506、CP21061507、CP21062201、CP21062202、CP21062203、CP21062204图6 17批陈皮药材特征图谱
3 讨论
3.1 供试品溶液制备方法选择 以色谱峰个数、整体分布、制备难易等为指标,采用单因素考察方法,对供试品溶液提取方法、提取时间、提取溶媒等进行了研究。对比了加热回流30 min、超声处理(功率900 W,频率60 kHz)30 min两种提取方式获得的供试品溶液指纹图谱情况,结果表明回流和超声两种提取方式所呈现的色谱图基本一致,考虑到超声相对较为简便,选择超声提取。先对比甲醇、乙醇、水所提取得色谱峰差异进行判断,再根据结果考察不同浓度的溶剂对呈批指纹图谱的影响,结果表明甲醇作为提取溶媒时色谱峰个数明显多于乙醇和水,随着提取溶媒中甲醇占比越高,所提取的色谱峰越多,各峰分离度均良好,故选择甲醇作为样品前处理提取溶剂。对比了不同提取时间(超声处理15 min、30 min、45 min、60 min)制备的陈皮供试品溶液指纹图谱差异,不同提取时间制得的供试品溶液得到的色谱图基本一致,选择提取时间较为适中的30 min。最终确定陈皮指纹图谱检测用供试品溶液制备方法。
3.2 检测波长确定 结合确定的方法所测陈皮指纹图谱的3D图(时间-波长-响应值)分析可知,250~350 nm波长呈现的色谱峰相对较多,其中部分色谱峰在各波长下均展示有较强的吸收,分析陈皮中该三种成品含量较高。对比250~350 nm波长范围内指纹图谱可知,色谱峰283 nm波长下呈现的色谱峰个数较多,比例分布相对其他更为均匀,且参照峰橙皮苷具有较高的响应值,整体谱图呈现良好,故选择283 nm为陈皮指纹图谱检测波长。
3.3 流动相的考察研究 本试验分别考察“乙腈-0.1%甲酸溶液”“乙腈-水”“乙腈-0.1%醋酸溶液”“乙腈-0.1%磷酸溶液”流动相体系中对陈皮指纹图谱的影响。结果显示,不同流动性体系对色谱峰洗脱影响不一致,其中“乙腈-0.1%甲酸溶液”色谱峰明显多于其他三种流动相体系,故选择“乙腈-0.1%甲酸溶液”为陈皮指纹图谱流动相体系。
3.4 特征峰的确认 17批陈皮药材中共有峰31个,统计对照指纹图谱中各共有峰中峰面积占共有峰总峰面积百分比可知,除橙皮苷、川陈皮素、橘皮素色谱峰外,其他占总峰面积比值均低于2%,考虑到批次间质量化学成分含量存在差异,峰面积较小、分离度较差的共有峰受检测条件等影响较大,不适宜作为特征峰用于药材的质量控制,故选择占总峰面相对较大(占总峰面积0.5%)、响应值较高、分离度较好的共有峰作为特征峰,经评估,陈皮药材对照指纹图谱中不低于总峰面积0.5%色谱峰有10个,但其中有两个峰分离度较差,在不同批次间呈现较弱,不适宜作为特征峰,故选择占总峰面较大、响应值较高、分离度较好的共有峰作为其特征峰,故本研究建立了以8个特征峰为指标成分的陈皮HPLC指纹图谱,对其中3个峰进行了峰归属,确定为橙皮苷、川陈皮素、桔皮素,其余5个色谱峰还需进一步研究确认。
综上,以Kromasil 100-5-C18色谱柱(4.6 mm×250 mm,5 μm);以乙腈—0.1%甲酸水溶液(梯度洗脱)为流动相;流速为1.0 mL/min;柱温为30 ℃;检测波长为283 nm,采用HPLC法测定,该方法经过方法学验证,可用于陈皮药材的质量控制。

