山奈酚抑制脑缺血/再灌注大鼠的脑损伤、炎症、氧化应激和凋亡
张丽阳,孙军,陈迪
(南阳市中心医院神经内科,南阳 473000)
缺血性脑卒中(ischemic stroke,IS)发生后,应及早恢复脑灌流,但脑缺血/再灌注(ischemia/reperfusion,I/R)的过程依然会造成神经损伤,且脑I/R损伤不可避免[1]。目前研究[2-4]显示,脑I/R引起的脑损伤主要包含炎症反应、氧化应激、兴奋性谷氨酸毒性和神经元凋亡等。山奈酚(3,4’,5,7-四羟基黄酮,kaempferol,Kae)是一种天然的黄酮类化合物,有抗炎和抗氧化作用[5]。Kae在脂多糖诱导的小胶质细胞活化和动物神经炎症模型中的抗炎和抗氧化作用已被广泛报道[5-8],但其对脑I/R引起的脑损伤治疗潜力和分子机制仍不清楚。在本研究中,我们研究了Kae对脑I/R大鼠的治疗作用,并探讨了其可能的机制。
材料和方法
1 材料
1.1 试剂与抗体
Kae(纯度≥98%;上海纯优生物科技有限公司);TTC染色试剂盒和BCA蛋白定量试剂盒和ECL化学发光试剂盒(北京索莱宝生物科技有限公司);RIPA缓冲液和TUNEL染色试剂盒(上海碧云天生物技术有限公司);兔源神经元核抗原(neuronal nuclei antigen,NeuN)抗体(英国Abcam公司);兔源Cleaved Caspase-3、Caspase-3、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白介素1β(interleukin-1β,IL-1β)抗体(美国CST公司);兔源β-actin抗体和ECL化学发光试剂盒(武汉博士德生物工程有限公司);Alexa Fluor 647或HRP标记羊抗兔IgG(H+L)抗体(北京百奥莱博科技有限公司);丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物研究所);3-硝基酪氨酸(3-nitrotyrosine,3-NT)ELISA检测试剂盒(江苏酶免实业有限公司)。
1.2 实验动物
35只清洁级雄性SD大鼠(6~7周龄,210~230 g)购自华中农业大学实验动物中心[动物生成许可证号:SCXK(鄂) 2020—0019]。所有大鼠被安置在恒温(22±1)℃、恒湿(50~60)%和12 h/12 h光暗循环的屏障环境动物房内,可自由获得标准的饮食和饮用水。
2 方法
2.1 动物模型制作与分组
用大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)法诱发局灶性脑I/R损伤。大鼠适应饲养3 d后,随机分为假手术(Sham)组(n=11)、MCAO组(n=12)和MCAO+Kae组(n=13)。MCAO组和MCAO+Kae组大鼠参照文献[9]方法,腹腔内注射戊巴比妥钠(50 mg/kg)麻醉大鼠后,从颈正中切口,暴露并分离左颈总动脉、颈内动脉和颈外动脉,用缝合线打活结结扎翼颚动脉同时远心端结扎颈外动脉,将线栓小心地从颈外动脉切口插入颈内动脉,直到线栓的头部到达颈内动脉和大脑中动脉的分叉处;1 h后,打开活结并抽出线栓以通过再灌注恢复对大脑中动脉区域的血液供应。Sham组大鼠除不进行缝合线闭塞翼颚动脉和插入线栓外接受其余相同的手术程序。再灌注2 h后,剔除发生持续丧失意识或抽搐的大鼠,最终Sham组、MCAO组和MCAO+Kae组各纳入11只。再灌注4 h后,MCAO+Kae组每天给予灌胃100 mg/kg Kae[10],持续7 d;Sham组和MCAO组给予等体积生理盐水。
2.2 神经功能学评分
按照Durukan等[11]方法对MCAO术后7 d各组大鼠进行神经功能缺陷进行评分,0分表示无神经功能缺陷,分数越高则提示神经缺陷越严重,12分为意识丧失或死亡。
2.3 TTC染色
MCAO术后7 d,每组各取5只大鼠,麻醉后,通过断头取出全脑。全脑在-20 ℃快速冷冻30 min,然后制成连续2 mm厚的冠状切片。并将脑片在2% TTC染色液中避光染色20 min,然后用4%多聚甲醛固定4 h。TTC染色结果用Image-Pro Plus 6.0进行数字扫描和分析。
2.4 核磁共振成像
剩余大鼠使用吸入麻醉剂(一氧化二氮/氧气/异氟醚混合气=68.5% / 30% / 1.5%)麻醉后,将大鼠用非磁性摇篮固定头部,用小动物核磁共振成像(MRI)仪(NM42-040H-I;苏州纽迈分析仪器股份有限公司)成像。
2.5 微正电子发射断层扫描
大鼠使用吸入麻醉剂麻醉后,将大鼠置于扫描床上,用小动物微正电子发射断层扫描(PET)活体成像仪(法国Inviscan公司)对头部血流成像。
2.6 TUNEL与NeuN免疫荧光双染
剩余大鼠麻醉后处死,取左侧脑半球并按常规法用石蜡包埋后,切成6 μm厚的脑片。脑片经脱蜡复水后,滴加20 mg/mL蛋白酶K并在室温下作用20 min,用PBS洗涤后,滴加50 μL FITC标记TdT酶工作液(TUNEL检测液)在室温孵育1 h,用PBS洗涤3次。用10%山羊血清封闭30 min,滴加NeuN抗体(1:500稀释)室温孵育2 h,PBS洗涤后,滴加Alexa Fluor 647标记羊抗兔IgG(H+L)抗体(1:500稀释)室温孵育1 h。在荧光显微镜下观察并获取图像,用Image-Pro Plus 6.0计算TUNEL阳性神经元比例。
2.7 试剂盒法测量脑组织中MDA和3-NT水平
取左侧半球脑组织,用10倍体积的冷PBS匀浆后,收集匀浆液并用BCA法对匀浆液中蛋白定量。按照试剂盒说明书步骤,用硫代巴比妥酸法测量匀浆液中MDA水平,用ELISA法测量匀浆液中3-NT水平;然后根据匀浆中蛋白的含量,将匀浆中MDA和3-NT水平换算成脑组织中MDA和3-NT水平。
2.8 Western blot
取左侧半球脑组织,用10倍体积的冷RIPA缓冲液在冰上匀浆,并以13000 r/min离心15 min,收集上清液。用BCA法对上清液中蛋白定量。每样品取45 μg蛋白并加入加载缓冲液混合,并在100 ℃加热10 min后,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离并转移到聚偏氟乙烯膜上。用5%牛血清白蛋白在含吐温-20的Tris缓冲盐水(TBST)中封闭膜1 h,然后与抗Cleaved caspase-3(1:500稀释)、Caspase-3(1:4000稀 释)、TNF-α(1:2000稀释)、IL-1β(1:1000稀释)和β-actin(1:8000稀释)抗体孵育过夜,用TBST液洗涤3次后,将膜与HRP标记羊抗兔IgG(H+L)二抗(1:1000稀释)在室温下孵育2 h,然后用ECL系统显影。用Image-Pro Plus软件分析蛋白条带的光密度值,目的蛋白相对水平=目的蛋白光密度值/β-actin光密度值。
2.9 统计学处理
数据以平均值±标准差表示。用GraphPad Prism 7.0软件进行统计学分析。组间均数的俩俩比较采用单因素方差分析后Bonferroni校正。P<0.05则认为差异具备统计学意义。
结果
1 Kae减轻I/R大鼠脑损伤
为研究Kae对I/R大鼠脑损伤的影响,对MCAO大鼠连续给药Kae 7 d,然后评估神经功能、脑梗死和脑血流。与Sham组比较,MCAO组大鼠神经功能缺损评分明显增高(图1A),说明MCAO组大鼠的神经功能缺损;经Kae给药后,神经功能有所改善。TTC染色(图1B、C)显示,Kae给药能降低MCAO大鼠的脑梗死灶的体积,且这一现象在MRI(图1D)中得到验证。另外,用PET/CT观察了Kae对MCAO大鼠脑血流量的影响,结果(图1E)显示Kae给药能增加MCAO大鼠缺血边界区域的脑血流量。
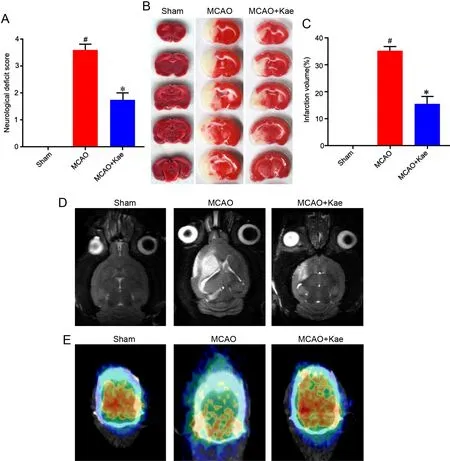
图1 Kae对I//R大树神经功能、脑梗死及脑血流的影响。A,神经功能缺损评分的定量分析(n=11);B和C,代表性的脑切片TTC染色图像(B)和脑梗死体积的定量分析(C)(n=5);D,代表性MRI图像;E,代表性PET图像。与Sham组比较,*P<0.001;与MCAO组比较, #P<0.01。Fig. 1 The effect of Kae administration on the neurological function, cerebral infarction and cerebral blood flow of the I/R rats. A, quantitative analysis of neurological deficit score (n=11); B and C, representative images of TTC stained brain sections (B) and quantitative analysis of cerebral infarction volume (C) (n=5); D, representative MRI images; E, representative PET images. *P<0.001, compared with Sham group; #P<0.01, compared with MCAO group
2 Kae减少I/R大鼠脑内神经元凋亡
用TUNEL和NeuN双染色定位观察神经元凋亡显示,与Sham组比较,MCAO组缺血半暗带中细胞凋亡(TUNEL阳性细胞)增多,神经元(NeuN阳性细胞)减少,且神经元凋亡(TUNEL和NeuN双阳性细胞)增多;与MCAO组比较,MCAO+Kae组细胞凋亡减少,神经元数量较多,且神经元凋亡减少(图2)。
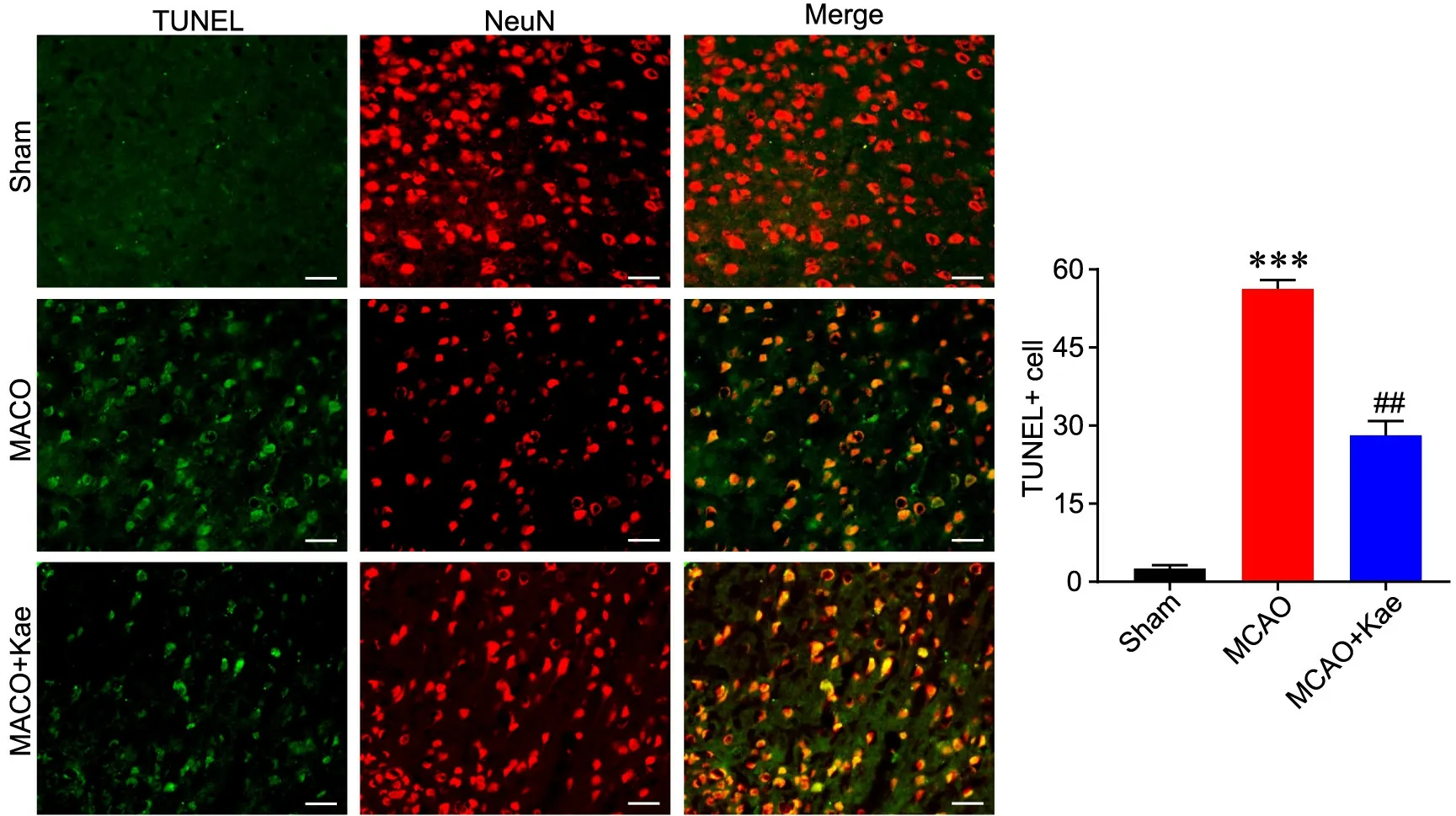
图2 Kae给药对I/R大鼠脑内神经元凋亡的影响。A,代表性TUNEL和NeuN双免疫荧光染色图像(比例尺=100 μm);B,TUNEL染色阳性细胞的定量分析。与Sham组比较,***P<0.001;与MCAO组比较,##P<0.01;n=6Fig. 2 The effect of Kae administration on neuronal apoptosis in the brain of the rats with I/R. A, representative double immunofluorescent staining images of TUNEL and NeuN (scale bar, 100 μm); B, quantitative analysis of TUNEL staining positive cells. ***P<0.001, compared with Sham group; ##P<0.01, compared with MCAO group; n=6
3 Kae抑制I/R大鼠脑内MDA、3-NT、IL-1β、TNF-α和Cleaved caspase-3的升高
与Sham组比较,MCAO组脑组织中MDA和3-NT水平明显增高(图4A、B);与MCAO组比较,Kae给药后MDA和3-NT水平明显降低。Western blot检测与大脑凋亡和炎症相关的标志蛋白显示,与Sham组比较,MCAO组脑组织中Cleaved caspase-3、IL-1β和TNF-α水平明显增高;与MCAO组比较,Kae给药后上述指标明显降低(图4C)。
讨论
脑I/R是恢复IS患者脑血灌流过程中所经历的必然步骤,但脑I/R所带来的脑损伤也不可忽视,甚至其也是导致IS患者不良预后甚至死亡的主要因素之一[1]。目前尚无避免脑I/R损伤的办法,因此,如何减轻脑I/R所致的脑损伤成为IS治疗研究的主要方向。MCAO/再灌注大鼠模型是目前研究脑I/R损伤的经典模型[12],且绝大多数IS患者的治疗具有滞后性,造成缺血前预处理方式的应用范围极窄,因此本研究采用MCAO大鼠模型并在再灌注后给药方式研究Kae对脑I/R损伤的影响,结果显示,Kae给药能改善MCAO大鼠的神经功能、减轻脑梗死并增加脑血流,提示Kae可能是潜在的抗脑I/R损伤的药物。
神经元凋亡是影响IS患者预后的运动、学习和语言等各种生理功能的主要因素[4]。在脑缺血发生后,在缺血半暗带依然有神经元存活,虽然恢复血液灌流是拯救缺血半暗带中神经元必要策略,但脑I/R依然也会引起存活的神经元发生二次伤害[4],因此如何减轻脑I/R后缺血半暗带中存活的神经元的二次损伤尤为关键。本研究显示,Kae给药能减少缺血半暗带中神经元凋亡,提示Kae可能有助于脑I/R后的功能恢复。许多证据[13-14]表明,神经元和胶质细胞的再灌注损伤主要是由炎症损伤引起的,包括小胶质细胞的激活在内许多细胞事件都有助于脑I/R后的炎症过程。此外,炎症能导致线粒体功能障碍、降低超氧化物歧化酶活性、扰乱活性氧产生和解毒之间的平衡,且这些氧自由基会攻击细胞膜脂质、蛋白质和糖胺聚糖,进而会进一步放大炎症级联反应并导致神经元死亡,加重神经损伤[15-16]。据报道,Kae在脂多糖诱导的炎症和小胶质细胞活化中具有抗炎和抗氧化损伤作用[6-8,10],而Kae对脑I/R大鼠的保护作用尚不完全清楚。本研究显示,Kae能降低MCAO大鼠脑组织中氧化应激标记物MDA和3-NT水平以及促炎标记物IL-1β和TNF-α和凋亡关键因子Cleaved caspase-3的表达,提示Kae的神经保护作用可能与抗炎、抗氧化以及抑制神经元凋亡有关。

图3 . Kae给药对MCAO大鼠脑组织中MDA、3-NT、IL-1β、TNF-α和Cleaved caspase-3表达的影响。A,MDA水平的定量分析;B,3-NT水平的定量分析;C,IL-1β、TNF-α和Cleaved Caspase-3表达水平的代表性Western blot检测与统计学分析。与Sham组比较,***P<0.001;与MCAO组比较,###P<0.001;n=6Fig. 3 Effects of Kae administration on the levels of MDA, 3-NT, IL-1β, TNF-α and Cleaved Caspase-3 in the brain of the I/R rats. A, quantitative analysis of MDA levels; B, quantitative analysis of 3-NT levels; C, representative Western blot detection and statistical analysis for levels of IL-1β, TNF-α and Cleaved Caspase-3. ***P<0.001, compared with Sham group; ##P<0.01, compared with MCAO group; n=6
综上所述,Kae对MCAO大鼠具有改善神经功能、减轻脑梗死和增加脑灌流的作用;抗氧化、抗炎和降低神经元凋亡作用可能是Kae在抗I/R诱导的脑损伤机制中的关键因素。然而,脑I/R过程中的病理过程是复杂的,因此Kae在脑I/R中的神经保护机制任需进一步的研究。此外,本研究结果为开发Kae作为一种有潜在的治疗中风的药物提供了有利依据,但其临床疗效有待于进一步证实。

