干姜和炮姜对脾胃虚寒型胃溃疡大鼠药效学指标及肠道菌群的影响Δ
余凌英,李 星,蔡平君,强梦琴,东宝花,蒋云秀,黄勤挽,陈志敏(成都中医药大学药学院/西南特色中药资源国家重点实验室,成都 611137)
胃溃疡是临床常见的消化道疾病,是多种因素损害胃黏膜致人体胃酸、胃蛋白酶增多而引起的黏膜损伤及黏膜免疫失衡性疾病,其主要诱因包括幽门螺杆菌感染、药物滥用、饮食不节、心理压力剧增等[1]。西医临床常用的治疗药物有抑酸剂、黏膜保护剂、抗菌药物等,侧重于胃溃疡的局部治疗;中医治疗则遵循辨证论治原则,强调整体与局部相结合[2]。脾胃虚寒是胃溃疡的常见证型之一。研究表明,中药可用于脾胃虚寒型胃溃疡的治疗[3]。
干姜为姜科植物姜Zingiber officinaleRosc.的干燥根茎。炮姜是干姜的砂烫炮制品,具有温经止血、温中止痛的作用,主要含有姜辣素、挥发油和二苯基庚烷等成分[4]。研究表明,干姜制成炮姜后,其姜酚类成分含量降低,姜烯酚、姜酮等成分含量增加[5]。其中,姜烯酚类成分的抗炎作用强于姜酚类成分[6],姜酮对溃疡具有一定的保护作用[7]。肠道菌群的平衡是脾脏正常发挥生理作用的重要因素,肠道菌群紊乱与中医脾虚具有共同的生物学基础,且脾虚患者普遍存在肠道菌群失调的情况[8]。为进一步探究干姜砂烫前后的药效差异,本研究基于炮姜的温经止血功效,以食醋加无水乙醇复制脾胃虚寒型胃溃疡大鼠模型,研究干姜、炮姜对大鼠凝血、黏膜修复功能及肠道菌群的影响,从不同角度分析炮制的影响,为干姜炮制品的合理应用提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有RAC-030 型全自动凝血分析仪(深圳雷杜生命科学股份有限公司)、DNM-9602G型酶标仪(北京普朗新技术有限公司)、CX31 型光学显微镜(日本Olympus公司)、Ministar型低温离心机(湖南恒诺仪器设备有限公司)等。
1.2 主要药品与试剂
干姜饮片(批号20050103)购自四川国强中药饮片有限公司,经成都中医药大学药学院兰志琼副教授鉴定为姜科植物姜Z.officinaleRosc.的干燥根茎。炮姜为实验室自制品[参照2020年版《中国药典》(一部)“炮姜”项下炮制方法并结合本课题组前期筛选工艺,控制砂烫温度为195 ℃,砂烫时间为7.5 min]。复方田七胃痛胶囊[阳性对照,批号201103,规格每粒装0.5 g(相当于原药材0.73 g)]购自桂林三金药业股份有限公司。
胃泌素(gastrin,GAS)、胃动素(motilin,MTL)、表皮生长因子(epidermal growth factor,EGF)酶联免疫吸附测定(ELISA)试剂盒(批号分别为42Q392KMS6、IBTT5FPHVX、XKWK1TTDZP)均购自武汉伊莱瑞特生物科技股份有限公司;活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)、纤维蛋白原(fibrinogen,FIB)试剂盒(批号分别为20200827M、2020072902M、20200821M、2019120201M)均购自深圳雷杜生命科学股份有限公司;食醋(批号20210716)购自四川保宁醋有限公司;无水乙醇(批号2021091002)购自成都科隆化学品有限公司;其余试剂均为分析纯,水为纯净水。
1.3 实验动物
SPF级雄性SD大鼠70只,体质量180~220 g,购自成都达硕实验动物有限公司,动物生产许可证号为SCXK(川)2020-030。本研究的动物实验方案经成都中医药大学动物实验伦理委员会批准,批准号为TCM-2016-312。
2 方法
2.1 供试液的制备
2.1.1 干姜、炮姜供试液 取干姜和炮姜,分别打成粗粉,置于圆底烧瓶内,加10倍量水,浸泡0.5 h,回流提取2 h,收集提取液,药渣加8倍量水,回流提取1.5 h,合并2次提取液,减压浓缩,制成质量浓度分别为1.50、0.75 g/mL(以生药量计)的供试液[9]。
2.1.2 复方田七胃痛胶囊供试液 取一定量的复方田七胃痛胶囊内容物,用水配制成质量浓度为0.045 g/mL的供试液[9]。
2.2 分组、造模与给药
将大鼠适应性饲养1 周后,随机分为正常组、模型组、阳性对照组(复方田七胃痛胶囊供试液0.45 g/kg)、炮姜高剂量组(15.0 g/kg)、炮姜低剂量组(7.5 g/kg)、干姜高剂量组(15.0 g/kg)、干姜低剂量组(7.5 g/kg),每组10 只,各给药组剂量参考预实验结果设置。除正常组外,其余各组参考相关文献[10-11]采用食醋联合无水乙醇灌胃法建立脾胃虚寒型胃溃疡大鼠模型。模型组和各给药组大鼠于每天上午灌胃4 ℃的食醋(10 mL/kg),连续10 d,正常组灌胃等量水;第5~10 天,各给药组大鼠每天下午灌胃相应药物,正常组、模型组大鼠灌胃水;第10 天给药结束后,所有大鼠均禁食不禁水;第11 天,除正常组外,其余各组大鼠均灌胃无水乙醇(1 mL/只)。若大鼠精神萎靡,动作迟缓无力,背毛疏散无泽,渐见体型瘦弱,大便溏泄且肛门附近出现污物,胃组织有溃疡,说明脾胃虚寒型胃溃疡模型复制成功[10-11]。实验期间有动物死亡,故每组选用6只大鼠进行后续研究。
2.3 样本采集与处理
灌胃无水乙醇1 h后,于大鼠股动脉取血,一部分静置后以3 000 r/min 离心15 min,取血清;另一部分置于含枸橼酸钠的试管内,以3 000 r/min 离心15 min,取血浆。然后,剖取大鼠胃组织,置于10%甲醛溶液中浸泡20 min 后取出备用;取大鼠粪便,置于密封的无菌冻存管内,于-80 ℃下冻存。
2.4 大鼠血清中MTL、GAS、EGF含量的测定
采用ELISA 法进行测定。取“2.3”项下各组大鼠的血清适量,按相应试剂盒说明书操作,检测其MTL、GAS、EGF含量。
2.5 大鼠凝血4项的测定
采用凝固法进行测定。取“2.3”项下各组大鼠的血浆适量,按相应试剂盒说明书操作,检测其APTT、PT、TT和FIB含量。
2.6 大鼠胃溃疡指数和溃疡抑制率的测定
取“2.3”项下各组大鼠胃组织适量,沿胃大弯剪开,用生理盐水洗净胃内容物,观察黏膜面溃疡的形成情况,用游标卡尺测量出血区域的长度和宽度,以相关标准(表1)进行评分,所得总积分即为该动物的溃疡指数;同时,计算各组大鼠的溃疡抑制率。总积分=出血点分值+出血带长度分值+出血带宽度分值×2(因宽度所反映损伤的严重程度强于长度,故双倍积分),溃疡抑制率(%)=(模型组溃疡指数-实验组溃疡指数)/模型组溃疡指数×100%[11]。

表1 直观观察评分标准
2.7 大鼠胃组织病理形态学的观察
取“2.3”项下各组大鼠的胃组织适量,常规脱水、石蜡包埋、切片,经苏木精-伊红(HE)染色后,于光学显微镜下观察各组胃组织的病理形态学变化并拍照,记录胃黏膜糜烂灶数量:平均每个视野下糜烂灶数量=切面内糜烂灶数量/计数视野个数。利用Olympus Cellsens Dimension 软件测量糜烂灶面积:平均糜烂灶面积=切面内糜烂灶面积总和/切面内糜烂灶数量。
2.8 大鼠肠道菌群的检测
取“2.3”项下正常组、模型组、干姜高剂量组(结果中简称“干姜组”)、炮姜高剂量组(结果中简称“炮姜组”)大鼠的粪便样品适量,委托北京诺禾致源科技股份有限公司进行DNA 提取和16S V3+V4 区扩增子信息采集、分析。基于Illumina Nova测序平台测序,构建PCR-free文库,然后进行双末端测序。通过对reads拼接,按97%的一致性将序列聚类成操作分类单元(operational taxonomic units,OTUs)。结 合Silva138 数 据 库,对 所 得OTUs(共4 060 个)序列进行物种注释。根据物种注释结果,进一步计算α多样性与β多样性,取不同分类水平上相对丰度排名前10位的物种进行分析,揭示各组大鼠粪便样本物种组成和群落结构的差异。
2.9 统计学方法
采用SPSS 26.0软件对数据进行统计分析。数据均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法检验。检验水准α=0.05。
3 结果
3.1 大鼠血清中MTL、GAS、EGF含量的测定结果
与正常组比较,模型组大鼠血清中MTL、GAS、EGF含量均显著降低(P<0.05);与模型组比较,阳性对照组和炮姜高剂量组大鼠血清中MTL、GAS、EGF含量,干姜低、高剂量组MTL、GAS 含量,以及炮姜低剂量组EGF含量均显著升高(P<0.05);与相同剂量干姜组比较,炮姜低剂量组大鼠血清中MTL、GAS含量均显著降低,炮姜低、高剂量组EGF 含量均显著升高(P<0.05)。结果见表2。
表2 各组大鼠血清中MTL、GAS、EGF 含量的测定结果(±s,n=6)
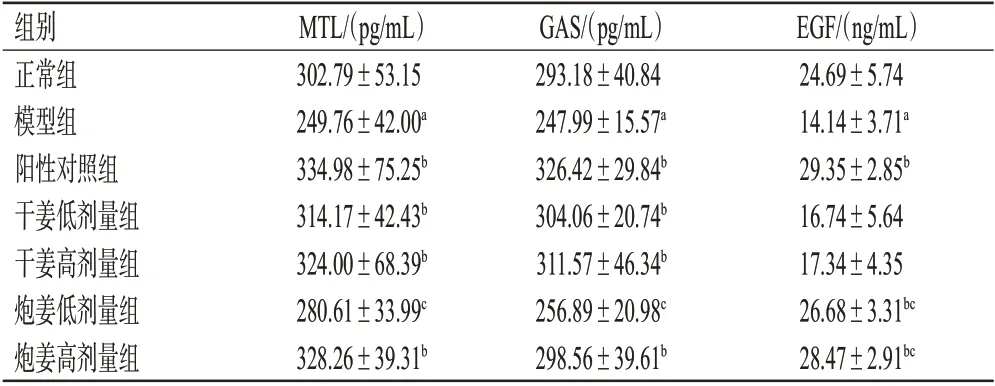
表2 各组大鼠血清中MTL、GAS、EGF 含量的测定结果(±s,n=6)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与相同剂量干姜组比较,P<0.05
组别正常组模型组阳性对照组干姜低剂量组干姜高剂量组炮姜低剂量组炮姜高剂量组MTL/(pg/mL)302.79±53.15 249.76±42.00a 334.98±75.25b 314.17±42.43b 324.00±68.39b 280.61±33.99c 328.26±39.31b GAS/(pg/mL)293.18±40.84 247.99±15.57a 326.42±29.84b 304.06±20.74b 311.57±46.34b 256.89±20.98c 298.56±39.61b EGF/(ng/mL)24.69±5.74 14.14±3.71a 29.35±2.85b 16.74±5.64 17.34±4.35 26.68±3.31bc 28.47±2.91bc
3.2 大鼠凝血4项的测定结果
与正常组比较,模型组大鼠的TT 显著延长,FIB 含量显著下降(P<0.05),APTT 和PT 有升高趋势但差异均无统计学意义(P>0.05)。与模型组比较,阳性对照组和炮姜低、高剂量组大鼠的APTT、TT 以及炮姜高剂量组大鼠的PT均显著缩短,阳性对照组和炮姜低、高剂量组大鼠的FIB 含量均显著升高(P<0.05)。与相同剂量干姜组比较,炮姜低剂量组大鼠APTT、炮姜高剂量组凝血4项均显著缩短或升高(P<0.05)。结果见表3。
表3 各组大鼠凝血4项的测定结果(±s,n=6)
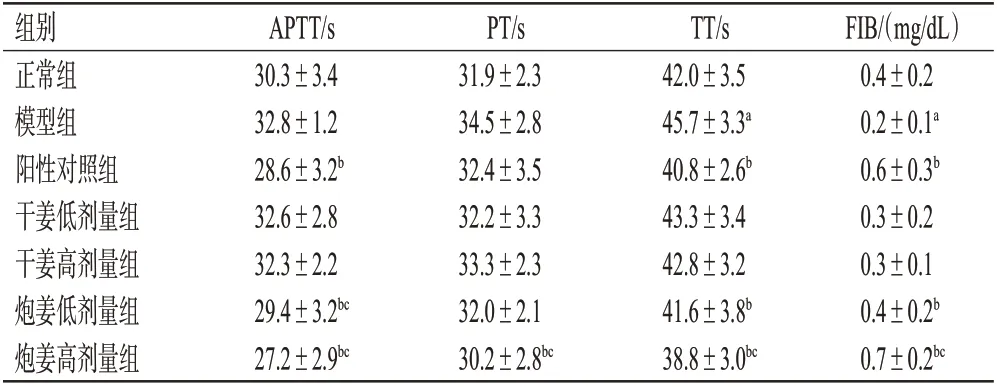
表3 各组大鼠凝血4项的测定结果(±s,n=6)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与相同剂量干姜组比较,P<0.05
组别正常组模型组阳性对照组干姜低剂量组干姜高剂量组炮姜低剂量组炮姜高剂量组APTT/s 30.3±3.4 32.8±1.2 28.6±3.2b 32.6±2.8 32.3±2.2 29.4±3.2bc 27.2±2.9bc PT/s 31.9±2.3 34.5±2.8 32.4±3.5 32.2±3.3 33.3±2.3 32.0±2.1 30.2±2.8bc TT/s 42.0±3.5 45.7±3.3a 40.8±2.6b 43.3±3.4 42.8±3.2 41.6±3.8b 38.8±3.0bc FIB/(mg/dL)0.4±0.2 0.2±0.1a 0.6±0.3b 0.3±0.2 0.3±0.1 0.4±0.2b 0.7±0.2bc
3.3 大鼠胃溃疡指数和溃疡抑制率的测定结果
与正常组比较,模型组大鼠的胃溃疡指数显著升高(P<0.05);与模型组比较,阳性对照组和炮姜低、高剂量组大鼠的胃溃疡指数均显著降低,阳性对照组大鼠的溃疡抑制率显著升高(P<0.05);与相同剂量干姜组比较,炮姜高剂量组大鼠的溃疡指数显著降低,炮姜低、高剂量组大鼠的溃疡抑制率均显著升高(P<0.05)。结果见表4。
3.4 大鼠胃组织的病理形态学观察结果
正常组大鼠胃黏膜腺体细胞排列整齐,未见黏膜细胞坏死、水肿及间质充血、炎症细胞浸润等。模型组大鼠胃组织可见多个糜烂灶分布,灶内浅表黏膜上皮细胞肿胀、坏死,毛细血管扩张,部分上皮细胞及红细胞裂解成细颗粒状;糜烂灶中部黏膜细胞及固有层水肿,细胞排列疏松、紊乱,少量糜烂灶中部可见明显出血;糜烂灶炎症细胞浸润不明显,黏膜底部及黏膜下层可见少量嗜酸性粒细胞分布;肌层及浆膜层未见明显异常。与模型组比较,各给药组大鼠糜烂灶水肿均有所好转,糜烂灶数量和面积均有不同程度减少,其中阳性对照组和炮姜低、高剂量组大鼠上述指标的差异均有统计学意义(P<0.05),结果见表5和图1。
表4 各组大鼠胃溃疡指数和溃疡抑制率的测定结果(±s,n=6)
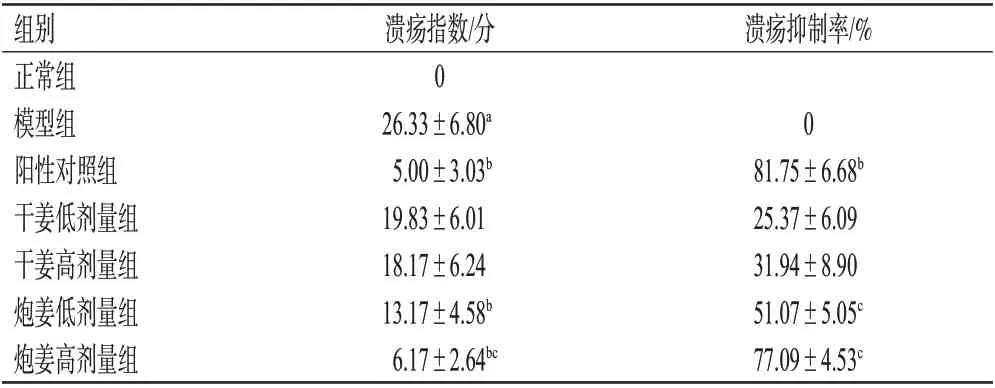
表4 各组大鼠胃溃疡指数和溃疡抑制率的测定结果(±s,n=6)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与相同剂量干姜组比较,P<0.05
溃疡抑制率/%组别正常组模型组阳性对照组干姜低剂量组干姜高剂量组炮姜低剂量组炮姜高剂量组溃疡指数/分0 26.33±6.80a 5.00±3.03b 19.83±6.01 18.17±6.24 13.17±4.58b 6.17±2.64bc 0 81.75±6.68b 25.37±6.09 31.94±8.90 51.07±5.05c 77.09±4.53c
表5 各组大鼠胃黏膜糜烂灶数量和面积的测定结果(±s,n=6)

表5 各组大鼠胃黏膜糜烂灶数量和面积的测定结果(±s,n=6)
a:与模型组比较,P<0.05
组别正常组模型组阳性对照组干姜低剂量组干姜高剂量组炮姜低剂量组炮姜高剂量组糜烂灶数量/个0 1.83±0.40 0.83±0.40a 1.50±0.58 1.33±0.52 1.00±0.63a 0.83±0.40a糜烂灶面积/mm2 0 0.30±0.15 0.04±0.04a 0.13±0.19 0.10±0.07 0.07±0.04a 0.04±0.03a

图1 各组大鼠胃组织病理形态学观察的显微图(HE染色,×100)
3.5 大鼠肠道菌群的测定结果
3.5.1 α多样性分析 对各组大鼠肠道菌群的整体群落结构差异进行α 多样性分析,结果见表6。Chao1、ACE指数用来评价菌群的丰度;Shannon、Simpson 指数则用来评价菌群多样性的丰富度[12]。由表6 可知,与正常组比较,模型组大鼠的Chao1、ACE 指数均显著降低(P<0.05)。与模型组比较,炮姜组大鼠的ACE、Shannon、Simpson指数均显著升高(P<0.05)。与干姜组比较,炮姜组大鼠的Shannon指数显著升高(P<0.05)。
表6 各组大鼠肠道菌群α 多样性相关指数统计结果(±s,n=6)
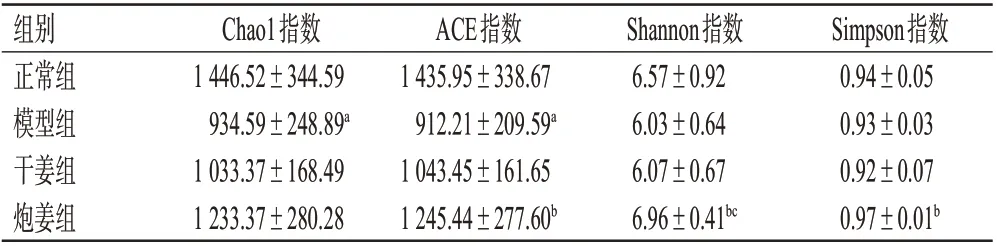
表6 各组大鼠肠道菌群α 多样性相关指数统计结果(±s,n=6)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与干姜组比较,P<0.05
组别正常组模型组干姜组炮姜组Chao1指数1 446.52±344.59 934.59±248.89a 1 033.37±168.49 1 233.37±280.28 ACE指数1 435.95±338.67 912.21±209.59a 1 043.45±161.65 1 245.44±277.60b Shannon指数6.57±0.92 6.03±0.64 6.07±0.67 6.96±0.41bc Simpson指数0.94±0.05 0.93±0.03 0.92±0.07 0.97±0.01b
3.5.2 β多样性分析 对各组大鼠肠道菌群的整体群落结构差异进行β 多样性分析,结果见图2。由图2可知,模型组样本点与正常组样本点完全分开,距离较远且差异较大;炮姜组样本点与正常组样本点的距离比干姜组样本点与正常组样本点的距离更近。上述结果说明,脾胃虚寒型胃溃疡可导致大鼠肠道菌群组成及结构发生变化;经过干姜、炮姜干预后,可改善脾胃虚寒型胃溃疡大鼠肠道菌群的组成及结构变化,且炮姜的改善效果相对较好。
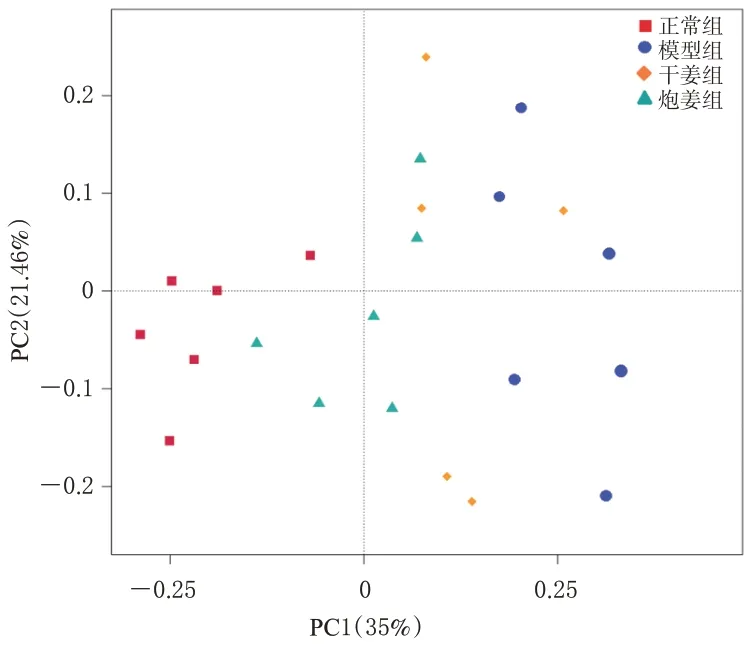
图2 各组大鼠肠道菌群的β多样性分析图
3.5.3 肠道菌群门水平分析 在门水平,相对丰度排名前10 位的物种以厚壁菌门、拟杆菌门、变形菌门为主。与正常组比较,模型组大鼠的拟杆菌门相对丰度显著降低(P<0.05),变形菌门相对丰度显著升高(P<0.05)。与模型组、干姜组比较,炮姜组拟杆菌门相对丰度均显著升高(P<0.05),变形菌门变形菌门相对丰度均显著降低(P<0.05),结果见表7。
表7 各组大鼠肠道菌群门水平主要差异物种相对丰度的测定结果(±s,n=6,%)
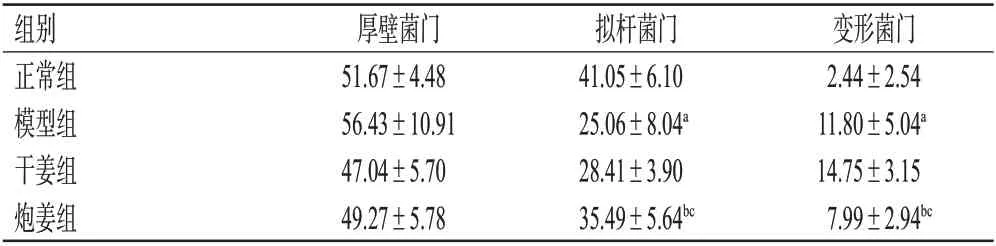
表7 各组大鼠肠道菌群门水平主要差异物种相对丰度的测定结果(±s,n=6,%)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与干姜组比较,P<0.05
组别正常组模型组干姜组炮姜组厚壁菌门51.67±4.48 56.43±10.91 47.04±5.70 49.27±5.78拟杆菌门41.05±6.10 25.06±8.04a 28.41±3.90 35.49±5.64bc变形菌门2.44±2.54 11.80±5.04a 14.75±3.15 7.99±2.94bc
3.5.4 肠道菌群属水平分析 在属水平,相对丰度排名前10位的物种包括乳酸杆菌属、粘液乳酸杆菌属、罗姆布茨菌属、联合乳酸杆菌属、普雷沃菌属、支原体属、埃希氏-志贺菌属等。与正常组比较,模型组大鼠的联合乳酸杆菌属相对丰度显著降低,罗姆布茨菌属相对丰度显著增加(P<0.05)。与模型组比较,干姜组大鼠的粘液乳酸杆菌属相对丰度显著降低(P<0.05)。结果见表8。
表8 各组大鼠肠道菌群属水平主要差异物种相对丰度的测定结果(±s,n=6,%)
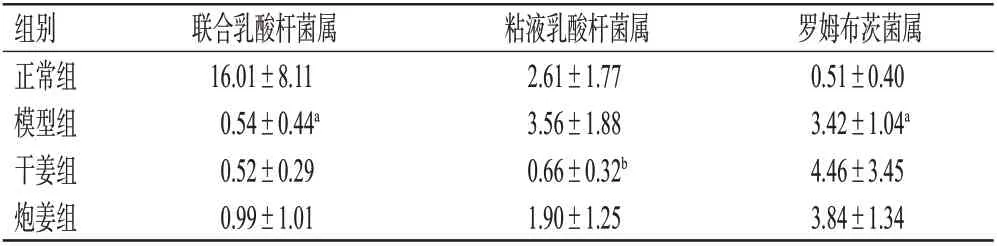
表8 各组大鼠肠道菌群属水平主要差异物种相对丰度的测定结果(±s,n=6,%)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组干姜组炮姜组联合乳酸杆菌属16.01±8.11 0.54±0.44a 0.52±0.29 0.99±1.01粘液乳酸杆菌属2.61±1.77 3.56±1.88 0.66±0.32b 1.90±1.25罗姆布茨菌属0.51±0.40 3.42±1.04a 4.46±3.45 3.84±1.34
4 讨论
饮食偏酸可损伤脾胃,长时间给予大量低温食醋会导致泄泻、体质量减轻等症状,符合中医脾胃虚寒的临床表现,因此可采用冷食醋灌胃法复制脾胃虚寒动物模型[13]。摄入过量乙醇可导致胃黏膜损伤,是急性胃溃疡的常见病因,因此可采用无水乙醇灌胃法复制胃溃疡动物模型[14]。基于此,本研究采用食醋联合无水乙醇灌胃法复制脾胃虚寒型胃溃疡模型。
GAS 和MTL 是重要的消化道胃肠激素,与脾胃虚寒密切相关,临床实践证实,脾胃虚寒患者多表现为GAS 和MTL 分泌过少[15]。研究指出,GAS 正常分泌可促进胃肠运动,其异常表达可导致胃酸分泌增多,胃肠道黏膜屏障受损,从而加重溃疡出血症状;MTL 可促进胃肠排空及胃酸分泌,其异常表达会加重胃肠黏膜损伤[16]。本研究结果显示,脾胃虚寒型胃溃疡模型大鼠血清中GAS和MTL含量均显著降低,经干姜、炮姜干预后均有不同程度的升高,但炮姜低剂量组大鼠血清中GAS、MTL 含量均明显低于干姜低剂量组,表明干姜和炮姜用于治疗脾胃虚寒证可能与促进GAS和MTL的分泌有关,而低剂量炮姜对上述指标的干预作用较弱。
正常生理条件下,胃黏膜依赖多种保护机制以维持结构的完整性,并通过黏膜防御系统来抵御外界有害刺激。EGF 可促进细胞增生,抑制胃酸、胃蛋白酶分泌以减轻后者对黏膜的损伤作用,增加胃黏膜黏液及糖蛋白的合成和分泌而对胃黏膜起保护作用;还可以增加上皮细胞的合成,促进胃黏膜损伤修复和溃疡愈合等[17]。本研究中,炮姜低、高剂量组大鼠的溃疡抑制率均显著高于相同剂量干姜组,干姜砂烫后抗溃疡作用的增强可能与血清中EGF 含量显著增加而使胃黏膜保护作用有所增强有关。因黏膜受损,胃溃疡常伴有出血现象,凝血4项可反映机体的止血功能。与模型组比较,炮姜能使脾胃虚寒型胃溃疡大鼠的APTT、TT、PT 均明显缩短,而FIB 含量明显升高,表明炮姜能增强机体内源性和外源性凝血功能,有助于提升溃疡治疗的临床效果。
研究指出,调控肠道菌群水平、增加菌群多样性与抗胃溃疡作用的发挥密切相关[18]。本研究结果显示,与模型组比较,炮姜组ACE、Shannon、Simpson指数均显著升高,表明炮姜能更好地改善肠道菌群的相对丰度、多样性及均匀度。厚壁菌门和拟杆菌门细菌参与了机体能量代谢、脂肪存储等过程,二者比值(F/B)反映了机体能量吸收与贮存的能力,是肠道稳态的生理性指标之一,该比值越低则肠道菌群越稳定;变形菌门包含了很多潜在的致病菌,其相对丰度的升高可增加肠道对炎症的敏感性,同时也是肠道菌群失调的标志[12]。与正常组比较,模型组大鼠的拟杆菌门相对丰度降低,厚壁菌门、变形菌门相对丰度升高,提示肠道菌群发生紊乱;给予干姜、炮姜干预后,拟杆菌门相对丰度升高,厚壁菌门、变形菌门相对丰度(炮姜组)降低,说明干姜、炮姜均可改善肠道微生态,且炮姜效果更好。从属水平对大鼠肠道菌群组成结构进行分析,与正常组相比,模型组大鼠的罗姆布茨菌属相对丰度显著增加。联合乳酸杆菌属、粘液乳酸杆菌属对胃肠道有潜在保护作用,可降低炎症的发生[19-20]。炮姜组大鼠的联合乳酸杆菌属、粘液乳酸杆菌属相对丰度较干姜组有一定升高,说明炮姜的胃肠道保护作用相对更强。可见,干姜和炮姜能一定程度地调节脾胃虚寒型胃溃疡大鼠肠道菌群的相对丰度和多样性,改善肠道菌群结构,炮姜的作用优于干姜。
综上所述,干姜和炮姜可通过提高GAS、MTL含量来改善脾胃虚寒型胃溃疡大鼠的脾胃虚寒症状,增强其胃肠功能;与干姜比较,炮姜能明显抑制脾胃虚寒型胃溃疡,且这种作用与促进黏膜修复、改善凝血功能、调整肠道菌群紊乱等有关。本研究虽然从胃溃疡黏膜保护、肠道菌群等方面探究了干姜和炮姜对脾胃虚寒胃溃疡的作用,但仅初步探讨了药物对肠道菌群种类的影响,体内细胞因子(如炎症因子)与肠道菌群的关系及对黏膜屏障的影响、抗溃疡作用机制等还需要进一步研究。

