三叶香茶菜提取物对肝星状细胞和肝细胞TLR4/NF-κB/NLRP3通路的影响Δ
覃 乐,陈 勇,黄桂东,吴瑞胜,刘代华,周至品#(.广西中医药大学药学院,南宁 53000;.广西医科大学附属柳州市人民医院药学部/广西壮族自治区卫生健康委员会广西临床疾病生物技术研究重点实验室/柳州市胃肠道中成药工程技术研究中心,广西柳州 545006)
三叶香茶菜Isodon ternifolius(D.Don)Kudo 为唇形科植物,又名细叶香茶菜,常用于治疗黄疸、风湿肿痛等,其复方制剂可用于临床治疗急慢性肝炎[1-2]。有研究表明,三叶香茶菜乙醇提取物具有保肝、降酶活性,其主要药效成分为齐墩果酸和熊果酸[3-4]。另有研究发现,三叶香茶菜的多种苯基木脂素成分可减少小鼠巨噬细胞RAW264.7 的炎性损伤,可能是其药效成分之一[5]。动物实验表明,三叶香茶菜能减轻四氯化碳致大鼠肝纤维化(hepatic fibrosis,HF)程度,下调Toll 样受体4(Tolllike receptor 4,TLR4)、核因子κB(nuclear factor-κB,NF-κB)、磷酸化核因子κB 抑制蛋白(phosphorylated inhibitor of NF-κB,p-IκB)、NOD 样受体蛋白3(NODlike receptor protein 3,NLRP3)的表达,减少白细胞介素1β(interleukin-1β,IL-1β)、IL-18、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子的释放,提示其可通过抑制TLR4/NF-κB/NLRP3 通路来减轻大鼠的炎性损伤,从而发挥抗HF 作用[6-7]。有研究指出,NLRP3炎症小体可诱导肝细胞死亡,并可在细胞外被肝星状细胞吞噬,从而激活肝星状细胞,使得IL-1β、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)分泌上调,进而加重HF[8],提示肝星状细胞和肝细胞所构成的肝脏微环境在HF的发展过程中发挥了重要作用。基于此,本研究在前期体内实验的基础上,以TLR4/NF-κB/NLRP3通路为切入点,探讨三叶香茶菜提取物对肝星状细胞和肝细胞的影响,进一步揭示其抗HF的分子机制。
1 材料
1.1 主要仪器
本研究所用主要仪器包括CC-170T-8型三气培养箱(新加坡ESCO 公司)、FilterMax F3 型多功能酶标仪[美谷分子仪器(上海)公司]、FC-1100型超微量核酸检测仪(杭州遂真生物技术有限公司)、AriaMx型实时聚合酶链反应(real-time PCR)系统(美国Agilent 公司)、Tanon 5200型凝胶成像系统(上海天能科技有限公司)等。
1.2 主要药品与试剂
三叶香茶菜饮片(批号20190501,产地广西)于2019年10月购自广西仙茱中药科技有限公司,由广西中医药大学药用植物学教研室梁子宁教授鉴定为唇形科植物三叶香茶菜I.ternifolius(D.Don)Kudo的干燥根茎。
TAK-242 对照品(TLR4 阻断剂,批号SML0832,纯度≥98%)、秋水仙碱对照品(阳性对照,批号C3915,纯度≥95%)均购自美国Sigma 公司;脂多糖(LPS,批号L8880)、MTT 细胞增殖及毒性检测试剂盒(批号M1020)均购自北京索莱宝科技有限公司;ECL 化学发光底物(批号BL523A)购自北京兰杰柯科技有限公司;IL-1β、IL-18、Ⅰ型胶原蛋白(type Ⅰcollagen,COL-Ⅰ)、COL-Ⅲ、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)酶联免疫吸附测定(ELISA)试剂盒(批号分别为JYM0419Ra、JYM0650Ra、JYM0413Ra、JYM0811Ra、JYM0722Ra、JYM0994Ra)均购自武汉基因美生物科技有限公司;α-SMA、转化生长 因子β1(transforming growth factor-β1,TGF-β1)ELISA 试剂盒(批号分别为ml038078、ml002856)均购自上海酶联生物科技有限公司;兔源TLR4、NF-κB p65、NLRP3、Gasdermin D(GSDMD)、凋亡相关微粒蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、β-肌动蛋白(β-actin)单克隆抗体(批号分别为ab13867、ab76302、ab263899、ab219800、ab180799、ab8227)和辣根过氧化物酶标记的山羊抗兔IgG 二抗(批号ab6721)均购自英国Abcam 公司;兔源p-IκBα单克隆抗体(批号2859S)购自美国CST公司;其余试剂均为实验室常用规格,水为纯净水。
1.3 实验动物与细胞
SPF 级雄性SD 大鼠,体质量为180~200 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004。所有动物均饲养于广西中医药大学实验动物中心动物房(室内保持通风、干燥、洁净)内,并自由摄食、饮水。动物处置符合相关动物实验伦理要求。
2 方法
2.1 三叶香茶菜提取物的制备
取适量三叶香茶菜饮片,加10 倍量水浸泡30 min,煮沸60 min,用纱布过滤,收集滤液。同法重复提取3次,合并滤液,加95%乙醇适量使乙醇最终体积分数为70%,搅拌,静置24 h后,过滤除渣,收集滤液,回收乙醇并浓缩成浸膏(每1 g 浸膏相当于生药20 g),冷藏。将浸膏用DMEM 高糖培养基稀释,过滤除菌后用于细胞实验。
2.2 大鼠原代肝星状细胞、原代肝细胞的分离
参照张玉等[9]所建方法,依次通过肝逆向两步酶灌注法原位消化,密度梯度离心分离,特征性表面抗原α-SMA、结蛋白免疫荧光法鉴定,获得原代肝星状细胞。参照叶娟等[10]所建方法,依次通过改良原位两步灌流法和多次过滤低速离心法分离,抗肝细胞角蛋白18免疫化学法鉴定,获得原代肝细胞。所获细胞均接种于完全培养基[含10%胎牛血清、青链霉素双抗的DMEM 高糖培养基,下同]中,在37 ℃、5%CO2条件下培养(下同)。
2.3 三叶香茶菜提取物对肝星状细胞及肝细胞增殖影响的检测
取原代肝星状细胞或肝细胞适量,按6×104个/mL接种于96孔板中,分别用不同质量浓度的三叶香茶菜提取物[肝星状细胞:0.2、0.4、1、2、4 mg/mL,肝细胞:0.1、0.5、1、1.5、2.5 mg/mL,均按生药量计(下同),质量浓度参考前期预实验结果设置]干预,并设不含药物的空白对照组。培养24 h 后,每孔加入5 mg/mL 的MTT 试剂20 μL,继续培养4 h。使用酶标仪于570 nm波长处测定各孔的吸光度,计算增殖抑制率[增殖抑制率=(空白对照组吸光度-实验组吸光度)/空白对照组吸光度×100%]和半数抑制浓度(IC50)。每质量浓度设3个复孔,实验重复3次。
2.4 细胞分组与处理
将原代肝星状细胞或肝细胞传代培养至对数生长期后,分为空白对照组、LPS 模型组、秋水仙碱(1 μmol/L)组、三叶香茶菜提取物(1 mg/mL,质量浓度参考“2.3”项下IC50设置)组、TLR4 阻断剂(TAK-242,1 μmol/L)组和TLR4 阻断剂+三叶香茶菜提取物(1 μmol/L+1 mg/mL)组,每组设3 个复孔。空白对照组细胞加入无LPS的完全培养基,培养24 h;LPS模型组细胞加入含LPS(100 ng/mL)的完全培养基,培养24 h;各药物组细胞先用含相应药物或阻断剂的完全培养基培养24 h 后,再用含LPS 的完全培养基培养24 h。LPS、TLR4、秋水仙碱的质量浓度参考相关文献设置[11-12]。
2.5 指标检测
2.5.1 纤维因子和炎症因子含量 收集各组细胞上清液,以2 000~3 000 r/min离心20 min,收集上清液,采用ELISA 法以酶标仪于570 nm 波长处检测肝星状细胞上清液中α-SMA、TGF-β1、COL-Ⅰ、COL-Ⅲ的含量和肝细胞上清液中ALT、AST、IL-1β、IL-18的含量。
2.5.2 TLR4/NF-κB/NLRP3 通路相关基因表达 采用real-time PCR 法进行检测。收集各组细胞并提取其总RNA。待测定浓度后,将总RNA 逆转录成cDNA,随后进行PCR 扩增。PCR 反应体系包括:cDNA 模板1 μL、SYBR Premix Ex Taq(Ti RNaseH plus)7.5 μL、上/下游引物各0.6 μL、ddH2O 5.3 μL。PCR 反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火10 s,72 ℃延伸30 s,共循环40 次。反应结束后,以β-actin 作为内参,采用2-ΔΔCt法计算目标基因mRNA 的表达量,并以空白对照组作为参照,计算各组目标基因mRNA 的相对表达量。实验重复3次。所有引物均由生工生物工程(上海)股份有限公司设计、合成,引物序列及产物长度见表1。

表1 TLR4等目标基因的引物序列及产物长度
2.5.3 TLR4/NF-κB/NLRP3 通路相关蛋白表达 采用Western blot 法进行检测。收集各组细胞,裂解后匀浆,以12 000 r/min离心5 min,取上清液。采用BCA法检测蛋白浓度后,加buffer 适量并于100 ℃下变性10 min。取变性蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离并转移至聚偏二氟乙烯膜上,用5%脱脂奶粉封闭1 h,加入TLR4、p-IκBα、NF-κB p65、NLRP3、GSDMD、ASC、β-actin 一抗(稀释度均为1∶1 000),于4 ℃下孵育过夜;用TBST溶液清洗15 min×3次,加入相应二抗(稀释度为1∶4 000),于37 ℃下孵育90 min。以ECL 化学发光底物显色后,置于凝胶成像系统下曝光成像并使用Image J 1.53 e软件进行分析,以目标蛋白与内参蛋白的灰度值比值表示目标蛋白的表达水平。实验重复3次。
2.6 统计学方法
采用SPSS 26.0软件对数据进行统计分析。数据均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LDS-t检验。检验水准α=0.05。
3 结果
3.1 三叶香茶菜提取物对2种细胞增殖的影响
随着三叶香茶菜提取物质量浓度的增加,肝星状细胞和肝细胞的增殖抑制率均逐渐降低,提取物对上述2种细胞的IC50分别为1.66、1.88 mg/mL。因此,在不影响细胞增殖活力的前提下,本研究选择1 mg/mL(此质量浓度下,该提取物对2 种细胞的增殖抑制率分别约为65%、71%)作为后续实验中三叶香茶菜提取物的干预浓度。
3.2 三叶香茶菜提取物对2 种细胞上清液中纤维因子和炎症因子含量的影响
与空白对照组比较,LPS模型组肝星状细胞上清液中TGF-β1、α-SMA、COL-Ⅰ、COL-Ⅲ含量和肝细胞上清液中ALT、AST、IL-1β、IL-18 含量均显著升高(P<0.05);与LPS 模型组比较,各药物组上述指标含量均显著降低(P<0.05)。与TLR4 阻断剂组比较,TLR4 阻断剂+三叶香茶菜提取物组细胞上清液中TGF-β1、α-SMA、COL-Ⅲ和ALT、AST、IL-1β、IL-18 含量均显著降低(P<0.05);而三叶香茶菜提取物组上述指标与TLR4阻断剂组比较,差异均无统计学意义(P>0.05)。结果见表2。
表2 三叶香茶菜提取物对2种细胞上清液中纤维因子和炎症因子含量的影响(±s,n=3)

表2 三叶香茶菜提取物对2种细胞上清液中纤维因子和炎症因子含量的影响(±s,n=3)
a:与空白对照组比较,P<0.05;b:与LPS模型组比较,P<0.05;c:与TLR4阻断剂组比较,P<0.05
组别空白对照组LPS模型组秋水仙碱组三叶香茶菜提取物组TLR4阻断剂组TLR4阻断剂+三叶香茶菜提取物组肝星状细胞肝细胞TGF-β1/(ng/mL)4.08±0.51 23.43±4.52a 14.38±2.67b 12.02±1.88b 11.19±1.52b 6.47±1.05bc α-SMA/(pg/mL)6.38±1.42 68.18±14.11a 39.64±8.84b 32.65±6.45b 30.04±5.01b 14.63±3.11bc COL-Ⅰ/(ng/mL)1.58±0.25 5.01±0.98a 3.46±0.55b 3.09±0.44b 2.83±0.38b 2.10±0.22b COL-Ⅲ/(pg/mL)266.88±37.12 671.71±93.79a 476.75±64.00b 434.92±56.82b 430.08±55.59b 298.57±42.67bc ALT/(pg/mL)635.89±126.58 2 306.14±369.98a 1 553.16±262.80b 1 375.39±212.38b 1 326.68±186.49b 879.14±138.04bc AST/(ng/mL)1.25±0.28 5.26±0.89a 3.46±0.61b 3.05±0.51b 2.92±0.45b 1.85±0.32bc IL-1β/(pg/mL)6.81±1.29 26.20±4.55a 17.16±2.89b 15.26±2.79b 14.83±2.65b 8.41±1.85bc IL-18/(pg/mL)33.47±4.96 92.86±14.04a 64.83±9.31b 57.87±8.53b 57.36±7.72b 38.03±6.17bc
3.3 三叶香茶菜提取物对2 种细胞中TLR4/NF-κB/NLRP3通路相关基因表达的影响
与空白对照组比较,LPS模型组肝星状细胞和肝细胞中TLR4、NF-κB p65、NLRP3、GSDMD、ASC mRNA的表达均显著上调(P<0.05),IκBα mRNA 的表达均显著下调(P<0.05)。与LPS模型组比较,各药物组2种细胞中TLR4、NF-κB p65、NLRP3、GSDMD、ASC mRNA的表达均显著下调(P<0.05),IκBα mRNA 的表达均显著上调(P<0.05)。与TLR4 阻断剂组比较,TLR4 阻断剂+三叶香茶菜提取物组2种细胞中TLR4、NF-κB p65、NLRP3、GSDMD、ASC mRNA 的表达均显著下调(P<0.05),IκBα mRNA 的表达均显著上调(P<0.05);而三叶香茶菜提取物组上述指标与TLR4 阻断剂组比较,差异均无统计学意义(P>0.05)。结果见表3。
表3 三叶香茶菜提取物对2种细胞中TLR4/NF-κB/NLRP3通路相关基因表达的影响(±s,n=3)
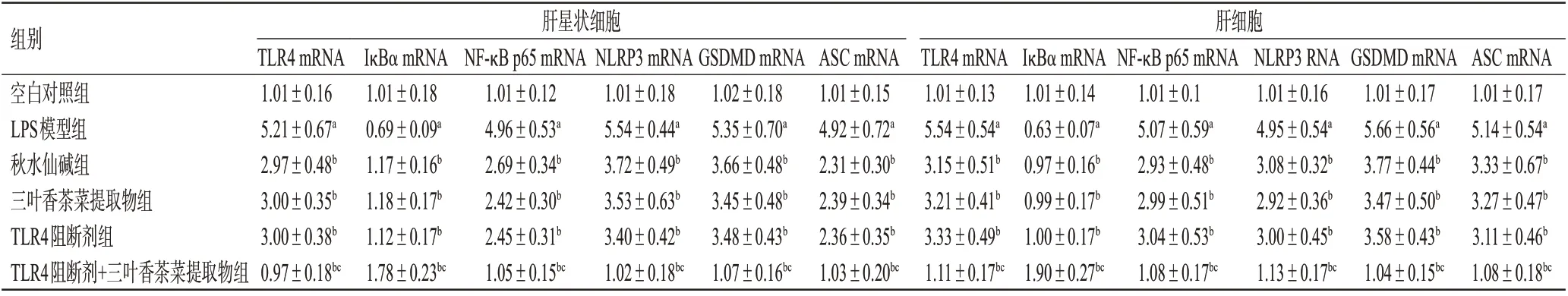
表3 三叶香茶菜提取物对2种细胞中TLR4/NF-κB/NLRP3通路相关基因表达的影响(±s,n=3)
a:与空白对照组比较,P<0.05;b:与LPS模型组比较,P<0.05;c:与TLR4阻断剂组比较,P<0.05
组别空白对照组LPS模型组秋水仙碱组三叶香茶菜提取物组TLR4阻断剂组TLR4阻断剂+三叶香茶菜提取物组肝星状细胞肝细胞TLR4 mRNA 1.01±0.16 5.21±0.67a 2.97±0.48b 3.00±0.35b 3.00±0.38b 0.97±0.18bc IκBα mRNA 1.01±0.18 0.69±0.09a 1.17±0.16b 1.18±0.17b 1.12±0.17b 1.78±0.23bc NF-κB p65 mRNA 1.01±0.12 4.96±0.53a 2.69±0.34b 2.42±0.30b 2.45±0.31b 1.05±0.15bc NLRP3 mRNA 1.01±0.18 5.54±0.44a 3.72±0.49b 3.53±0.63b 3.40±0.42b 1.02±0.18bc GSDMD mRNA 1.02±0.18 5.35±0.70a 3.66±0.48b 3.45±0.48b 3.48±0.43b 1.07±0.16bc ASC mRNA 1.01±0.15 4.92±0.72a 2.31±0.30b 2.39±0.34b 2.36±0.35b 1.03±0.20bc TLR4 mRNA 1.01±0.13 5.54±0.54a 3.15±0.51b 3.21±0.41b 3.33±0.49b 1.11±0.17bc IκBα mRNA 1.01±0.14 0.63±0.07a 0.97±0.16b 0.99±0.17b 1.00±0.17b 1.90±0.27bc NF-κB p65 mRNA 1.01±0.1 5.07±0.59a 2.93±0.48b 2.99±0.51b 3.04±0.53b 1.08±0.17bc NLRP3 RNA 1.01±0.16 4.95±0.54a 3.08±0.32b 2.92±0.36b 3.00±0.45b 1.13±0.17bc GSDMD mRNA 1.01±0.17 5.66±0.56a 3.77±0.44b 3.47±0.50b 3.58±0.43b 1.04±0.15bc ASC mRNA 1.01±0.17 5.14±0.54a 3.33±0.67b 3.27±0.47b 3.11±0.46b 1.08±0.18bc
3.4 三叶香茶菜提取物对2 种细胞中TLR4/NF-κB/NLRP3通路相关蛋白表达的影响
与空白对照组比较,LPS模型组肝星状细胞和肝细胞中TLR4、p-IκBα、NF-κB p65、NLRP3、GSDMD、ASC蛋白的表达水平均显著升高(P<0.05)。与LPS 模型组比较,各药物组2种细胞中上述蛋白的表达水平均显著降低(P<0.05)。与TLR4阻断剂组比较,TLR4阻断剂+三叶香茶菜提取物组2 种细胞中TLR4、p-IκBα(肝星状细胞除外)、NF-κB p65、NLRP3、GSDMD、ASC 蛋白的表达水平均显著降低(P<0.05);而三叶香茶菜提取物组上述指标与TLR4 阻断剂组比较,差异均无统计学意义(P>0.05)。结果见表4、图1。
表4 三叶香茶菜提取物对2种细胞中TLR4/NF-κB/NLRP3通路相关蛋白表达的影响(±s,n=3)

表4 三叶香茶菜提取物对2种细胞中TLR4/NF-κB/NLRP3通路相关蛋白表达的影响(±s,n=3)
a:与空白对照组比较,P<0.05;b:与LPS模型组比较,P<0.05;c:与TLR4阻断剂组比较,P<0.05
组别空白对照组LPS模型组秋水仙碱组三叶香茶菜提取物组TLR4阻断剂组TLR4阻断剂+三叶香茶菜提取物组肝星状细胞肝细胞TLR4 0.58±0.16 1.37±0.24a 0.94±0.17b 0.92±0.16b 0.91±0.12b 0.54±0.11bc p-IκBα 0.72±0.10 1.51±0.24a 1.12±0.19b 1.05±0.15b 0.98±0.15b 0.75±0.09b NF-κB p65 0.40±0.08 1.53±0.27a 0.96±0.13b 0.91±0.13b 0.93±0.11b 0.44±0.06bc NLRP3 0.96±0.16 2.19±0.46a 1.37±0.20b 1.27±0.27b 1.26±0.29b 0.76±0.12bc ASC 0.40±0.10 1.16±0.24a 0.71±0.18b 0.73±0.16b 0.63±0.12b 0.34±0.05bc GSDMD 0.58±0.11 1.42±0.26a 0.87±0.17b 0.84±0.18b 0.83±0.16b 0.41±0.08bc TLR4 0.70±0.12 1.63±0.30a 0.96±0.23b 1.11±0.26b 1.11±0.15b 0.61±0.12bc p-IκBα 0.54±0.09 1.16±0.15a 0.76±0.10b 0.80±0.10b 0.74±0.10b 0.53±0.09bc NF-κB-p65 0.25±0.05 1.02±0.18a 0.54±0.11b 0.71±0.14b 0.73±0.16b 0.29±0.05bc NLRP3 0.50±0.10 1.22±0.28a 0.78±0.16b 0.80±0.15b 0.78±0.12b 0.49±0.10bc GSDMD 0.35±0.06 0.97±0.19a 0.55±0.20b 0.68±0.18b 0.64±0.13b 0.34±0.05bc ASC 0.47±0.09 1.03±0.10a 0.68±0.08b 0.72±0.11b 0.68±0.10b 0.38±0.05bc
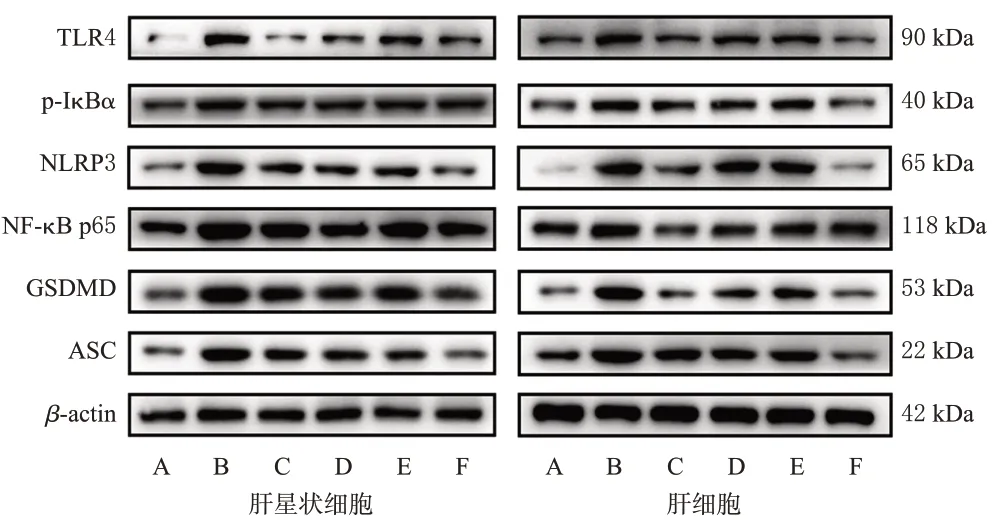
图1 三叶香茶菜提取物对2 种细胞中TLR4/NF-κB/NLRP3通路相关蛋白表达影响的电泳图
4 讨论
本研究在前期动物实验的基础上,采用原代肝星状细胞和原代肝细胞进行体外实验,研究三叶香茶菜提取物对TLR4/NF-κB/NLRP3通路的影响,以进一步揭示其抗HF 的分子机制。研究表明,肝星状细胞和肝细胞所构成的肝脏微环境直接影响HF 的进展,肝细胞通常是损伤的初始目标,随后通过与肝星状细胞间的相互作用(包括炎症反应和再生反应)来直接或间接激活肝星状细胞,促进细胞外基质(extracellular matrix,ECM)的合成、分泌[8,13]。因此,本研究采用原代肝星状细胞和原代肝细胞开展体外实验。
ECM 沉积是HF 的主要特征,也是该症的主要驱动因素[14]。胶原蛋白是ECM 的主要结构性纤维不溶性蛋白,也是ECM 的主要成分[15]。TGF-β1在多种纤维化疾病(含HF)中起核心作用,能激活肝星状细胞,促进ECM产生、沉积,从而导致HF 的形成[16-17]。在肝损伤期间,肝星状细胞被激活并转化为表达α-SMA的收缩性肌成纤维细胞,导致血管变形和血管阻力增加,从而引发门静脉高压,可见抑制α-SMA 可减缓HF 的进展[18]。本研究结果显示,三叶香茶提取物能降低肝星状细胞上清液中TGF-β1、α-SMA、COL-Ⅰ、COL-Ⅲ的含量,表明其可抑制TGF-β1活化,从而使肝星状细胞转化为收缩性肌成纤维细胞的途径受阻,最终抑制了COL-Ⅰ、COL-Ⅲ等ECM成分的分泌。
在肝细胞与肝星状细胞组成的微环境中,濒死的肝细胞会触发先天免疫系统,激活无菌性炎症反应,从而对邻近肝细胞造成进一步损伤并激活肝星状细胞[19]。有证据表明,从死亡肝细胞中释放的物质可作为肝星状细胞激活和分化的重要介质,从而上调TGF-β1和COL-Ⅰ的分泌[20]。研究表明,LPS 可通过刺激肝细胞、激活NF-κB 通路来促进肝细胞中NLRP3、IL-1β、IL-18 的表达[21],上述炎症因子可激活肝星状细胞,促进胶原沉积,从而加重HF[8]。本研究结果显示,三叶香茶菜提取物能降低肝细胞上清液中ALT、AST、IL-1β、IL-18的含量,表明其能减轻肝细胞的炎性损伤。
有研究指出,TLR4/NF-κB/NLRP3是一条重要的炎症反应通路,TLR4 与LPS 结合可活化其下游IκB 激酶,使IκBα 磷酸化后降解,从而激活NF-κB,促进NLRP3、ASC 和胱天蛋白酶1 前体表达并组装形成NLRP3 炎症小体,活化的NLRP3 炎症小体可促进细胞焦亡关键蛋白GSDMD活化、成熟,使细胞肿胀、裂孔而释放IL-1β、IL-18 等炎症因子,最终造成肝星状细胞或肝细胞受损[22-23]。经LPS 刺激后,肝星状细胞可通过TLR4 信号转导和NF-κB 活化而被激活,分泌TGF-β1、α-SMA、COL-Ⅰ、COL-Ⅲ等因子,从而促进HF的发展;经LPS刺激后,肝细胞的TLR4 被激活,使IL-1β、IL-18 等炎症因子分泌增加,从而造成炎性损伤[24-25]。此外有研究表明,NLRP3炎症小体可诱导肝细胞死亡并释放至细胞外被肝星状细胞吞噬,导致IL-1β 和α-SMA 分泌的增加,从而加重HF[8]。本研究结果显示,三叶香茶菜提取物能下调肝星状细胞和肝细胞中TLR4、NF-κB p65、NLRP3、GSDMD、ASC mRNA 的表达,上调IκBα mRNA 的表达,并可降低TLR4、p-IκBα、NF-κB p65、NLRP3、GSDMD、ASC 蛋白的表达,降低肝星状细胞上清液中TGF-β1、α-SMA、COL-Ⅰ、COL-Ⅲ的含量和肝细胞上清液中IL-1β、IL-18 的含量,提示三叶香茶菜提取物可通过抑制TLR4/NF-κB/NLRP3 通路活化来减轻肝细胞的炎性损伤,抑制肝星状细胞的活化,减少纤维因子的合成分泌。
此外,本课题组前期动物实验研究表明,作为阳性对照的秋水仙碱可明显减轻大鼠HF 程度,本研究结果也得出了相似的结果。TLR4 阻断剂可阻断TLR4/NFκB/NLRP3 通路,抑制炎症因子和纤维因子的表达[12]。本结果显示,TLR4 阻断剂同样可下调肝星状细胞和肝细胞中上述指标的分泌或表达,且TLR4 阻断剂联合三叶香茶菜提取物对上述多数指标的下调趋势更加明显,表明三叶香茶菜提取物抗HF作用除调控TLR4/NF-κB/NLRP3 通路外,可能还存在其他作用途径,但尚需进一步验证。
综上所述,三叶香茶菜提取物能通过抑制TLR4/NF-κB/NLRP3通路活化,减少纤维因子、炎症因子释放,减轻肝细胞炎性损伤,抑制肝星状细胞活化,从而发挥保护肝细胞、抗HF的作用。但是,本研究尚未明确三叶香茶菜对肝星状细胞与肝细胞相互作用的影响,有待后续研究予以完善。

