苗药了哥王提取物对斑马鱼的毒性作用Δ
何正艳,冯 果,郑传奇,李 玮,刘 文,朱光林,王文静,苏红梅,宋学丽,张 菊(.贵州中医药大学药学院,贵阳 550025;2.国家苗药工程技术研究中心,贵阳 550025)
了哥王始载于《岭南采药录》,来源于瑞香科植物南岭荛花Wikstroemia indica(Linn.)C. A. Mey.的根及根皮,是贵州地区常用苗药之一。了哥王味苦、微辛,性寒,有毒,归肺、肝经,具有清热解毒、消肿散结、止痛的功效,常用于瘰疬、痈肿、跌打损伤、急性扁桃体炎、慢性支气管炎、乳腺癌、恶性淋巴癌、肺癌等疾病的临床治疗[1-5]。现代研究发现,了哥王具有抗肿瘤、镇痛、抗菌、抗炎、镇咳袪痰等药理作用[6-7]。该药疗效确切,临床应用价值和市场潜力较大,但因毒性作用较强,使得其进一步开发和利用受限。《生草药性备要》《湖南药物志》中均有了哥王“大毒”或“有毒”的毒性记载[8-9]。目前,国内外有关了哥王的毒性研究大多基于大鼠和小鼠模型[10-12],具有成本高、周期长、不便于观察等缺点。斑马鱼作为一种新的模式生物,其幼鱼及胚胎通体透明,且繁殖率高、生长发育周期短,加之其与人类基因的相似度高达87%,故在筛选和评价药物毒性方面具有独特优势[13]。基于此,本文拟利用斑马鱼模型,探讨了哥王提取物对斑马鱼胚胎、斑马鱼的毒性作用,以期为其毒性的深入研究提供实验参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有MULTISKAN SKY 1530型全自动酶标仪[赛默飞世尔科技(中国)有限公司]、SMZ18型体视荧光显微镜(日本Nikon公司)、CKX53型倒置相差显微镜(上海蛮吉光电科技有限公司)、PCO-1500型立体显微镜及成像系统(武汉鑫力钧生物科技有限公司)、ESENAWS1型斑马鱼养殖系统(北京爱生科技发展有限公司)、SLI700型生化培养箱(天津信睿生物科技有限公司)等。
1.2 主要药品与试剂
了哥王药材购自广西壮族自治区玉林市玉州区玉林银丰国际中药港,经贵州中医药大学药学院李玮教授鉴定为瑞香科荛花属植物了哥王W. indica(Linn.)C.A.Mey.的干燥根或根皮。
吖啶橙(批号325E043)、油红O染液(批号20190910)、PBS(批号20190517)、DMSO(批号821D0311)均购自北京索莱宝科技有限公司;4%多聚甲醛(批号190620)购自上海尚宝生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)检测试剂盒(批号均为20191118)均购自南京建成生物工程研究所;NaCl、KCl、K2HPO4、Na2HPO4、NaHCO3、MgSO4、CaCl2等试剂均为分析纯,水为纯净水。
1.3 实验动物
AB系野生型斑马鱼,雌雄各半,购自国家斑马鱼资源中心,4~6 月龄(繁育、培养方法参照The Zebrafish Book),其相关质量控制项(微生物学等级及监测、寄生虫学等级及监测、遗传质量控制、病理诊断、配合饲料、环境条件)均符合北京市实验用鱼质量控制地方标准。所有斑马鱼均饲养于贵州中医药大学第一附属医院斑马鱼饲养中心的养殖房[光照14 h、黑暗10 h 交替,水温(28.0±0.5)℃,水pH6.8~7.5,室温26 ℃]内。
2 方法
2.1 斑马鱼胚胎培养液的配制
按照The Zebrafish Book标准配制斑马鱼胚胎培养液,其中NaCl、KCl、Na2HPO4、K2HPO4、CaCl2、MgSO4、NaHCO3的浓度分别为0.14、5.40、0.25、0.44、1.30、1.00、4.20 mol/L。
2.2 了哥王提取物的制备
参照课题组前期研究方法制备了哥王提取物并进行相关分析:取了哥王药材粗粉5 kg,以14 倍量的70%乙醇按5 mL/(min·kg)的速度进行渗漉提取;收集渗漉提取液,回收乙醇至提取液无醇味,采用低压真空浓缩干燥法(温度60 ℃,真空度0.07~0.08 MPa)进行浓缩、干燥后,粉碎成细粉,得了哥王提取物粉末(伞形花内酯和西瑞香素的含量分别为0.067、2.263 mg/g,浸膏得率为10.08%,每1 g了哥王提取物相当于生药9.92 g)[14]。
2.3 了哥王提取物药液的配制
精密称取“2.2”项下了哥王提取物粉末适量,溶于一定量的DMSO 中,涡旋溶解后,再加入胚胎培养液配制成1 mg/mL的母液,于实验前加胚胎培养液稀释至所需浓度。
2.4 了哥王提取物对斑马鱼胚胎发育的影响
于实验前一天晚上,将健康成年的斑马鱼按雌雄比例1∶1放入产卵缸中,使其自然受精产卵。随机选取受精后6~8 h(6-8 hours post fertilization,6~8 hpf)、发育正常且无畸形的斑马鱼胚胎,转移至12孔细胞培养板中(每孔20 枚胚胎),并加入适量胚胎培养液培养24 h,培养温度为(28.0±0.5)℃。
2.4.1 药物暴露质量浓度的选取与药液的配制 设置暴露质量浓度为10、20、40 μg/mL(质量浓度参考课题组前期预实验结果设置),并按照“2.3”项下方法配制质量浓度分别为10、20、40 μg/mL的了哥王提取物药液。
2.4.2 暴露处理 设置了哥王提取物10、20、40 μg/mL组和空白组(每孔20 枚胚胎,每组设置2 个复孔),缓慢吸出各孔中的胚胎培养液,各药物组分别按4 mL/孔加入“2.4.1”项下不同质量浓度的了哥王提取物药液进行暴露,空白组加入等体积的胚胎培养液和等量的DMSO作为对照。加盖标记后,将培养板置于生化培养箱中孵育72 h,每24 h更换药液1次。
2.4.3 斑马鱼胚胎自主抽动次数、心率及其畸形率、死亡率的测定 暴露24 h后,使用立体显微镜及成像系统观察各组斑马鱼1 min 内的胚胎自主抽动次数(每组选取10枚胚胎);暴露48 h后,使用立体显微镜及成像系统观察各组斑马鱼10 s 内的胚胎心率(每组选取10 枚胚胎);暴露72 h后,计算各组斑马鱼胚胎的畸形率和死亡率:畸形率(%)=某一时间点幼鱼的畸形数/某一时间点全部存活的幼鱼数×100%,死亡率(%)=死亡胚胎数/总胚胎数×100%。
2.5 了哥王提取物对斑马鱼的急性毒性作用
参照文献方法[15]繁育斑马鱼,于实验前一天晚上,将健康成年的斑马鱼按雌雄比例1∶1放入产卵缸中,使其自然受精。取受精卵,经清洗消毒后放入生化培养箱中孵育96 h。随机选取96 hpf、发育正常且无畸形的斑马鱼,转移至12孔细胞培养板中(每孔20尾斑马鱼),并加入适量的胚胎培养液培养24 h,培养温度为(28.0±0.5)℃。
2.5.1 药物暴露质量浓度的选取与药液的配制 根据课题组前期预实验结果,设置10、20、27、37、51、72、90、100 μg/mL药物暴露浓度组,并按照“2.3”项下方法配制质量浓度分别为10、20、27、37、51、72、90、100 μg/mL 的了哥王提取物药液。
2.5.2 暴露处理 慢慢吸出各孔中的胚胎培养液,分别加入“2.5.1”项下不同质量浓度的了哥王提取物药液进行暴露,其余操作同“2.4.2”项下。
2.5.3 半数致死浓度的计算 当暴露24、48、72 h时,统计各个药物暴露浓度组死亡的斑马鱼数量,按“2.4.3”项下方法计算死亡率,并运用SPSS 26.0 软件绘制其急性毒性线性回归方程并计算半数致死浓度(LC50)。
2.6 了哥王提取物对斑马鱼肝脏的毒性作用
2.6.1 药物暴露质量浓度的选取和暴露处理 根据“2.5”项下急性毒性实验结果,设置药物低、中、高质量浓度组,并设置含等体积胚胎培养液的空白组作为对照(每组设置2 个复孔)。随机选取96 hpf、发育正常且无畸形的斑马鱼,转移至12孔细胞培养板中(每孔20尾斑马鱼)。经培养后,各药物组分别按4 mL/孔加入不同质量浓度的了哥王提取物药液,空白组加入等体积的胚胎培养液和等量的DMSO,置于(28.0±0.5)℃恒温生化培养箱中培养24 h。
2.6.2 斑马鱼肝脏表型的观察 按“2.6.1”项下方法暴露处理后,吸去药液,每组选取10尾幼鱼进行表型观察:将斑马鱼用胚胎培养液清洗3次,以侧躺姿态固定于涂布有3%甲基纤维素凝胶的载玻片上,在体视荧光显微镜下依次观察各组斑马鱼的肝脏表型变化并拍照记录。
2.6.3 斑马鱼肝脏细胞凋亡的评价 按“2.6.1”项下方法暴露处理后,吸去药液,每组选取10尾幼鱼进行细胞凋亡评价:将各孔斑马鱼用胚胎培养液清洗后,于避光条件下按2 mL/孔加入2.5 μg/mL吖啶橙染色液(以胚胎培养液配制[16])进行染色;染色完成后,将斑马鱼用PBS反复清洗,以侧躺姿态固定于涂布有3%甲基纤维素凝胶的载玻片上,在体视荧光显微镜下观察斑马鱼肝脏细胞的凋亡情况,并拍照记录。
2.6.4 斑马鱼肝脏脂质沉积的评价 按“2.6.1”项下方法暴露处理后,吸去药液,每组选取10尾幼鱼进行脂质沉积评价:将各孔斑马鱼用胚胎培养液清洗,再以4%多聚甲醛固定过夜,依次用PBS和漂白液清洗3次;分别用85%、100%丙二醇脱水,用0.5%油红O染液染色3 h;染色完成后,依次用100%、85%丙二醇脱色30 min,用PBS清洗后于显微镜下观察油红O染液的染色情况,以评价斑马鱼的肝脏脂质沉积情况。
2.6.5 斑马鱼ALT、AST、LDH 活性的测定 按“2.6.1”项下方法暴露处理后,吸去药液,每组选取10尾幼鱼进行ALT、AST、LDH活性测定:将各孔斑马鱼用生理盐水清洗,以滤纸吸干水分后称定质量;加入9倍量的生理盐水,于冰浴中充分研磨,所得匀浆产物于4 ℃下以3 500 r/min 离心10 min,取上清液,采用酶联免疫吸附测定法检测各组上清液中ALT、AST、LDH活性。
2.7 统计学方法
应用SPSS 26.0软件对数据进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验(方差齐)或非参数秩和检验(方差不齐)。检验水准α=0.05。
3 结果
3.1 了哥王提取物对斑马鱼胚胎发育影响的测定结果
当斑马鱼的运动神经未发育完全时,会不受控制地发生胚胎自主抽动;随着运动神经的逐渐发育,这种自主抽动的次数将会减少[17]。与空白组比较,各药物组斑马鱼胚胎的自主抽动次数均显著增加,了哥王提取物40 μg/mL组斑马鱼胚胎的心率显著降低(P<0.05)。结果见表1。
表1 不同质量浓度了哥王提取物对斑马鱼胚胎自主抽动次数、胚胎心率、畸形率、死亡率影响的测定结果(±s,n=10)
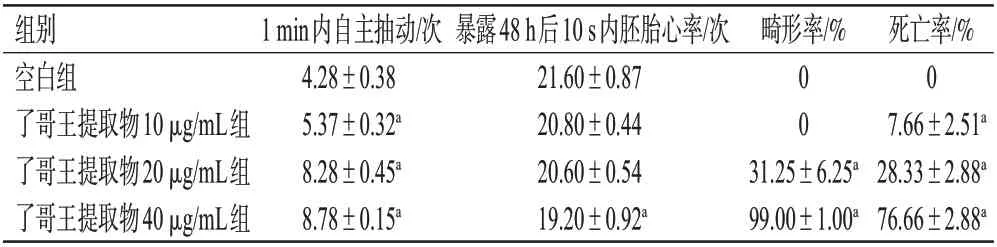
表1 不同质量浓度了哥王提取物对斑马鱼胚胎自主抽动次数、胚胎心率、畸形率、死亡率影响的测定结果(±s,n=10)
a:与空白组比较,P<0.05
畸形率/%组别空白组了哥王提取物10 μg/mL组了哥王提取物20 μg/mL组了哥王提取物40 μg/mL组1 min内自主抽动/次4.28±0.38 5.37±0.32a 8.28±0.45a 8.78±0.15a暴露48 h后10 s内胚胎心率/次21.60±0.87 20.80±0.44 20.60±0.54 19.20±0.92a 0 0 31.25±6.25a 99.00±1.00a死亡率/%0 7.66±2.51a 28.33±2.88a 76.66±2.88a
空白组斑马鱼胚胎发育正常,未见发育畸形和死亡。与空白组比较,了哥王提取物10 μg/mL 组斑马鱼的胚胎形态相似且无明显变化,了哥王提取物20、40 μg/mL 组斑马鱼胚胎可见畸形(表现为心包肿大、卵黄囊畸形、体长变短等);各药物组斑马鱼胚胎畸形率(了哥王提取物10 μg/mL 组除外)和死亡率均显著升高(P<0.05)。结果见表1。
3.2 了哥王提取物对斑马鱼急性毒性作用的测定结果
空白组斑马鱼发育正常,72 h 内无死亡;药物暴露24、48、72 h 后,LC50分别为39.850、28.300、21.490 μg/mL。24、48、72 h的线性回归方程(式中,y为死亡率,x为药物质量浓度)和LC50见表2。根据LC50检测结果,本文以27、37、51 μg/mL 作为了哥王提取物低、中、高质量浓度进行后续实验。

表2 不同时间点了哥王提取物对斑马鱼急性毒性作用的线性回归方程和LC50
3.3 了哥王提取物对斑马鱼肝脏毒性影响的测定结果
3.3.1 肝脏表型 空白组斑马鱼肝脏表型正常,肝脏形态完整、清晰,卵黄囊基本吸收完全,不存在肝脏变性。与空白组比较,了哥王提取物低、中、高质量浓度组斑马鱼的肝脏区域均有不同程度的透明度降低、形态膨大现象,且有随药物暴露质量浓度增加而肝脏区域逐渐模糊的趋势;当药物暴露质量浓度为51 μg/mL时,斑马鱼卵黄囊吸收不完全,且部分鱼体肝脏轮廓模糊。结果见图1。

图1 不同质量浓度了哥王提取物对斑马鱼肝脏表型的影响(×3.2)
3.3.2 肝脏区域细胞凋亡情况 吖啶橙染色结果显示,空白组斑马鱼肝脏区域未出现黄绿色亮点,提示空白组斑马鱼肝脏基本无细胞凋亡;而了哥王提取物中、高质量浓度组斑马鱼的肝脏区域均可见致密透亮的黄绿色亮点,且有药物暴露质量浓度越高、荧光强度越强的趋势。结果见图2。
3.3.3 肝脏脂质沉积 经油红O染液染色后,空白组斑马鱼肝脏区域橘红色较浅;而了哥王提取物高质量浓度组斑马鱼肝脏区域的颜色明显加深,提示其肝脏存在脂质沉积。结果见图3(了哥王提取物低、中质量浓度组经油O染液染色后,与空白组比较无明显差异,故图略)。
3.3.4 肝组织中ALT、AST、LDH活性 与空白组比较,了哥王提取物低、中、高质量浓度组斑马鱼肝组织中ALT、AST、LDH活性均显著升高(P<0.05),且有随药物暴露质量浓度增加而增强的趋势。结果见表3。

图2 不同质量浓度了哥王提取物对斑马鱼肝脏区域细胞凋亡的影响(吖啶橙染色,×3.2)

图3 不同质量浓度了哥王提取物对斑马鱼肝脏脂质沉积的影响(油红O染色,×3.2)
表3 不同质量浓度了哥王提取物对斑马鱼肝组织中ALT、AST、LDH 活性影响的测定结果(±s,n=10)

表3 不同质量浓度了哥王提取物对斑马鱼肝组织中ALT、AST、LDH 活性影响的测定结果(±s,n=10)
a:与空白组比较,P<0.05
组别空白组了哥王提取物低质量浓度组了哥王提取物中质量浓度组了哥王提取物高质量浓度组ALT/(U/g prot)14.98±3.11 32.51±5.45a 36.17±4.73a 49.89±4.72a AST/(U/g prot)37.28±1.98 55.41±3.78a 66.17±4.68a 90.56±4.60a LDH/(U/g prot)37.67±3.37 48.40±2.47a 52.31±3.86a 71.18±6.75a
4 讨论
了哥王作为一种民族药,具有较大的临床应用价值,但其毒性限制了该药的后续开发及利用。有研究表明,了哥王的不同提取物对正常大鼠具有明显的肝毒性,其中了哥王乙醇提取物的毒性作用较为明显[10]。斑马鱼的每个发育时间段都有不同的生理生化指标,且易于体外观察,适用于药物毒性评价[16]。因此,本实验利用斑马鱼模型,对了哥王提取物的毒性作用进行了初步评价。
为探究了哥王提取物对斑马鱼胚胎发育的毒性作用,本研究以6~8 hpf 斑马鱼胚胎为对象,记录了其1 min 内自主抽动次数、10 s 内心率及畸形、死亡发生情况。结果表明,与空白组比较,经了哥王提取物暴露后,斑马鱼胚胎在发育过程中的自主抽动次数增加、心率减慢,且出现心包肿大、卵黄囊肿大、体长变短等畸形现象和死亡;同时,随着药物质量浓度的增加,斑马鱼胚胎畸形和死亡的现象逐渐明显,与文献报道一致[17],提示了哥王提取物对斑马鱼胚胎具有一定的致畸和致死作用。
为探究了哥王提取物对斑马鱼肝脏的毒性作用,本研究在急性毒性实验的基础上,采用显微镜观察了低、中、高质量浓度药物对斑马鱼肝脏表型及相关指标的影响。结果表明,与空白组比较,了哥王提取物低、中、高质量浓度组斑马鱼的肝脏均有不同程度的透明度降低、形态膨大现象,且有随药物暴露质量浓度增加而肝脏区域逐渐模糊的趋势。吖啶橙染色结果显示,与空白组比较,中、高质量浓度的了哥王提取物均能够诱导斑马鱼肝脏细胞凋亡,与文献报道一致[16]。油红O染色结果显示,与空白组相比较,了哥王提取物高质量浓度组斑马鱼的肝脏中存在脂质沉积。这提示该提取物可诱导肝脏细胞凋亡,并可促进肝脏脂质沉积。
ALT、AST、LDH 常用以评价肝脏受到外源性物质损伤的严重程度,当肝细胞受损时,其活性会升高[18]。本研究采用酶联免疫吸附测定法检测了斑马鱼中ALT、AST、LDH 的活性,结果表明,与空白组比较,了哥王提取物低、中、高质量浓度组斑马鱼肝组织中ALT、AST、LDH活性均显著升高,提示该提取物对斑马鱼肝脏具有损伤作用。有文献报道,连续给予了哥王提取物后,大鼠血清中ALT、AST水平显著升高,其肝细胞凋亡增加,从而造成肝脏损伤[10,19],与本实验研究结果基本一致。
综上所述,了哥王提取物对斑马鱼胚胎的发育毒性表现为自主抽动次数增加,心率减慢,畸形率、死亡率升高等;同时,了哥王提取物可通过诱导肝细胞凋亡、促进肝脏脂质沉积而诱发肝脏损伤。

