益气活血中药组分对慢性脑缺血模型小鼠认知功能的影响及机制Δ
韩富华,刘剑刚,孙林娟,李南南,官 杰,詹 敏,5,陈文洁,5(.中国中医科学院西苑医院脑病科,北京 0009;2.北京中医药大学临床医学院,北京 00029;3.中国中医科学院西苑医院心血管病中心,北京 0009;.青岛市海慈医疗集团内分泌科,山东 青岛 266033;5.中国中医科学院研究生院,北京00700)
慢性脑缺血(chronic cerebral ischemia,CCI)又称慢性脑低灌注,是一种由多种原因导致脑血流长期灌注不足进而引发的慢性脑功能障碍综合征,早期表现为认知功能受损,随后可发展为持久性或进展性的认知及神经功能障碍[1],是血管性认知功能障碍(vascular cognitive impairment,VCI)的重要危险因素[2]。神经血管单元(neurovascular unit,NVU)是由神经元、血脑屏障、星形胶质细胞及细胞外基质组成的复合体,可发挥复杂的网络协同作用,共同维持神经元微环境的稳定[3]。NVU理论将NVU作为神经系统结构和功能的基本单位进行整体研究,把以往对单一神经元的保护扩展为对NVU 中各组成的全面保护[4],这一研究策略与中药多靶点、多环节、多维度全面保护和整体调节的作用特点相吻合。探究CCI 状态下脑内NVU 的病变情况,并基于此调节和促进NVU 功能与结构的恢复,对改善CCI 导致的认知功能障碍具有重要意义。
既往研究表明,益气活血中药组分(人参总皂苷、银杏总酮酯、西红花总苷)能够透过血脑屏障,可改善VCI患者的认知功能、神经元活动和脑灌注损伤[5];同时,又可调节多发梗死性痴呆大鼠脑内与学习记忆相关的神经递质水平,改善其认知功能[6]。然而目前该中药组分对CCI 所致认知功能障碍的作用及机制尚不清楚。本研究基于NVU理论,从动物学习记忆能力、NVU超微形态结构和相关蛋白[血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素1(angiopoietin 1,Ang1)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、α7 烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7 nAChRs)]表达等角度入手,探讨益气活血中药组分对CCI模型小鼠认知功能障碍的影响及作用机制,以期为临床防治VCI 提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括BT87-3型体内血栓形成测定仪(包头市昆仑生物化学应用技术开发研究所)、1049002 型跳台仪(北京众实迪创科技发展有限责任公司)、H-7500 型透射电镜(日本Hitachi公司)、Fresco17-1型低温冷冻离心机[赛默飞世尔科技(中国)有限公司]、Tanon 1600型凝胶成像系统(上海天能科技有限公司)、ABI 7500 型荧光定量聚合酶链反应(PCR)仪(美国ABI公司)、Multisksn MK3 型全自动酶标仪(芬兰Thermo Labsystems公司)等。
1.2 主要药品与试剂
益气活血中药组分[人参总皂苷(纯度≥90%)、银杏总酮酯(纯度≥90%)、西红花总苷(纯度≥90%)混合物,质量比5∶7∶1,批号090914]由神威药业集团有限公司提供;阿司匹林肠溶片(批号018170704,规格100 mg/片)购自石药集团欧意药业有限公司;兔VEGF多克隆抗体(批号GTX50153)购自美国GeneTex 公司;兔α7 nAChRs多克隆抗体(批号ab216485)购自英国Abcam公司;ECL Western blot 底物试剂盒(批号WBKLS0500)购自美国Millipore 公司;大鼠β-肌动蛋白(β-actin)单克隆抗体(批号YM3028)购自美国Immunoway公司;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G 二抗(H+L)和辣根过氧化物酶标记的山羊抗鼠免疫球蛋白G二抗(H+L)(批号分别为S004、S001)均购自天德悦(北京)生物科技有限责任公司;TRNzol 总RNA 提取试剂(批号DP405-02)购自天根生化科技(北京)有限公司;VEGF、Ang1、bFGF酶联免疫吸附测定(ELISA)试剂盒(批号分别为20180519A、20180620A、20180625A)均购自北京欣博盛生物科技有限公司;其余试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 实验动物
SPF 级雄性C57BL/6J 健康小鼠64 只,8 周龄,体质量为18~20 g,购自北京华阜康生物科技股份有限公司,动物生产许可证号为SCXK(京)2019-0008。所有小鼠均饲养于中国中医科学院西苑医院医学实验中心屏障级动物房(室温23~25 ℃,相对湿度50%~70%)内,并自由摄食和饮水。本实验方案遵循科技部《关于善待实验动物的指导性意见》的动物伦理要求,经中国中医科学院西苑医院医学伦理委员会审核批准(批准号2018XLC012-2)。
2 方法
2.1 CCI模型的建立
所有小鼠适应性饲养7 d 后,随机分为假手术组(n=16)和造模组(n=48)。造模组小鼠术前禁食12 h,腹腔麻醉,仰卧固定后行颈部备皮消毒,剪开颈部皮肤,暴露双侧颈总动脉(长度约1 cm),并在血管下垫玻璃纸以保护周围组织。将体内血栓形成测定仪的刺激电极、温度感受器钩于血管和玻璃纸之间,采用80 μA的温控电流刺激动脉血管7 min,若血管远端温度突然下降则表明血管内血栓形成,即CCI 模型复制成功[7]。然后缝合小鼠伤口,保温饲养,术后连续3 d肌内注射青霉素钠20万单位/d,以预防感染。取造模24 h后成功存活的小鼠(造模成功率100%)进行后续实验。假手术组小鼠按上述方法操作,但不通电。
2.2 分组与给药
将造模成功的CCI模型小鼠随机分为模型组、阿司匹林组(阳性对照,10 mg/kg)、中药组(益气活血中药组分,33 mg/kg),每组16只。除模型组和假手术组小鼠灌胃水外,其余各组小鼠灌胃相应药液,每天1 次,连续8周。阿司匹林组和中药组的给药剂量均为临床等效剂量[8-9],且前期实验已经证实该剂量是能引起(生物)等效反应的相对药物剂量。
2.3 小鼠学习记忆能力的检测
采用跳台实验检测各组小鼠的学习记忆能力。实验前,将小鼠放入实验箱内,适应环境5 min并进行学习测试;24 h 后,进行记忆能力测试,将小鼠放于平台上,记录从放上平台至第1次跳下平台所需的时间(即跳台潜伏期)和5 min内跳下平台的次数(即跳台错误次数),以此作为学习记忆能力的评价指标。
2.4 小鼠脑组织样本的处理
跳台实验结束后,所有小鼠禁食12 h,于次日麻醉、处死后快速取出完整脑组织,用预冷的生理盐水冲洗干净。每组随机取5只小鼠的左侧脑组织,剥离大脑皮层和海马组织,分别置于4%中性多聚甲醛溶液中保存;剩余小鼠的脑组织以锡纸包裹并保存于液氮中,置于-80 ℃冰箱中保存。
2.5 小鼠大脑皮层和海马组织中NVU超微形态结构的观察
取“2.4”项下小鼠的大脑皮层和海马组织,分别用0.1 mol/L 磷酸盐缓冲液冲洗3 次,加入1%锇酸溶液于4 ℃下染色2 h,切块,脱水;然后放入100%树脂中,常规包埋,切片(50 nm),于透射电镜下观察各组小鼠大脑皮层和海马组织中NVU 的超微形态结构,并随机选取10个视野拍照。
2.6 小鼠脑组织中VEGF 和α7 nAChRs 蛋白表达的检测
采用Western blot法进行检测。每组随机选取“2.4”项下冻存的5只小鼠的脑组织,经裂解、匀浆、静置后,于4 ℃下以13 000 r/min 离心20 min,取上清液,测定蛋白浓度并于100 ℃下变性。取变性蛋白样品,进行电泳分离并转移至聚偏二氟乙烯膜上,封闭后,分别加入VEGF、α7 nAChRs、β-actin 抗体(以含3%牛血清白蛋白的TBST 缓冲液稀释,稀释比例分别为1∶500、1∶300、1∶5 000),室温孵育10 min,4 ℃过夜;加入相应二抗(稀释比例1:10 000),室温孵育1.5 h;用TBST 缓冲液洗膜6次,每次3 min,随后加ECL试剂反应3~5 min,胶片曝光,显影2 min,定影。使用Total Lab Quant V11.5 版图像软件计算灰度值,以目标蛋白与内参(β-actin)的灰度值比值为目标蛋白的表达水平。
2.7 小鼠脑组织中VEGF 和α7 nAChRs mRNA 表达的检测
采用实时荧光定量PCR 法进行检测。每组随机选取“2.4”项下冻存的5 只小鼠的脑组织,采用TRNzol 总RNA 提取试剂提取样本脑组织的总RNA,测定RNA 浓度和纯度后进行cDNA 反转录。以所得cDNA 为模板,进行PCR 扩增。反应体系如下:cDNA 模板适量(由1 μg mRNA反转录所得),2×Master Mix 10 μL,10 μmol/L的上/下游引物各0.5 μL,加水至总体积为18 μL。PCR反应程序如下:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸40 s,共40个循环。采用2-ΔΔCt法,以β-actin为内参,计算目标基因的表达水平。各基因引物均由英杰生工生物技术(北京)有限公司设计、合成,引物序列和产物大小见表1。

表1 目标基因的引物序列和产物大小
2.8 小鼠脑组织中VEGF、Ang1、bFGF含量的检测
每组随机选取“2.4”项下冻存的5只小鼠的脑组织,严格按照ELISA 试剂盒说明书操作,使用酶标仪于450 nm波长处检测脑组织中VEGF、Ang1、bFGF的含量。
2.9 统计学方法
采用SPSS 25.0软件进行统计分析。所有数据均用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验、Student-Newman-Keuls 检验或Tamhane’sT2检验。检验水准α=0.05。
3 结果
3.1 益气活血中药组分对模型小鼠学习记忆能力的影响
与假手术组比较,模型组小鼠跳台错误次数显著增多(P<0.05),跳台潜伏期显著缩短(P<0.05)。与模型组比较,阿司匹林组和中药组小鼠跳台错误次数显著减少(P<0.05),中药组小鼠跳台潜伏期显著延长(P<0.05)。结果见表2。
表2 益气活血中药组分对CCI模型小鼠学习记忆能力的影响(±s,n=16)

表2 益气活血中药组分对CCI模型小鼠学习记忆能力的影响(±s,n=16)
a:与假手术组比较,P<0.05;b:与模型组比较,P<0.05
组别假手术组模型组阿司匹林组中药组跳台错误次数1.27±0.16 2.20±0.37a 1.32±0.33b 1.22±0.45b跳台潜伏期/s 226.45±53.12 179.23±55.29a 217.45±64.35 226.76±66.23b
3.2 益气活血中药组分对模型小鼠大脑皮层及海马组织中NVU超微形态结构的影响
假手术组小鼠大脑皮层细胞膜完整,胞浆内线粒体、细胞核形态和分布基本正常。与假手术组比较,模型组小鼠大脑皮层内线粒体嵴断裂,微血管内皮细胞周围水肿,血管壁增生,血管内皮细胞和基底膜正常结构消失,内皮细胞、基底膜和胶质细胞之间的间隙增宽。与模型组比较,各给药组小鼠细胞内线粒体、内皮细胞和基底膜结构修复,血管内皮细胞周围水肿减轻。结果见图1。

图1 益气活血中药组分对CCI 模型小鼠大脑皮层中NVU超微形态结构影响的显微图(×20 000)
假手术组海马组织细胞膜完整,核仁形态正常,线粒体数量较多且结构基本正常,偶见内质网、高尔基体。与假手术组比较,模型组小鼠海马组织神经元内细胞器减少,胞质固缩,线粒体数量减少,部分线粒体膜破裂,线粒体嵴模糊并有断裂现象,基质颗粒减少。与模型组比较,各给药组小鼠海马组织神经元内细胞器数量增多,线粒体结构明显改善,线粒体膜总体清晰,线粒体嵴增多。结果见图2。
3.3 益气活血中药组分对小鼠脑组织中VEGF 和α7 nAChRs蛋白及mRNA表达的影响

图2 益气活血中药组分对CCI 模型小鼠海马组织中NVU超微形态结构影响的显微图(×20 000)
与假手术组比较,模型组小鼠脑组织中VEGF蛋白及mRNA 的 表达水平均显著升高(P<0.05),α7 nAChRs 蛋白及mRNA 的表达水平均显著降低(P<0.05)。与模型组比较,中药组小鼠脑组织中VEGF 和α7 nAChRs 蛋白及mRNA 的表达水平均显著升高(P<0.05);阿司匹林组小鼠脑组织中VEGF蛋白及mRNA的表达水平均显著降低(P<0.05)。结果见图3、图4。

图3 益气活血中药组分对CCI 模型小鼠脑组织中VEGF、α7 nAChRs 蛋白表达影响的电泳图和柱状图(n=5)

图4 益气活血中药组分对CCI 模型小鼠脑组织中VEGF、α7 nAChRs mRNA 表达影响的柱状图(n=5)
3.4 益气活血中药组分对小鼠脑组织中VEGF、Ang1和bFGF含量的影响
与假手术组比较,模型组小鼠脑组织中VEGF的含量显著升高(P<0.05);bFGF、Ang1 含量差异均无统计学意义(P>0.05)。与模型组比较,阿司匹林组和中药组小鼠脑组织中Ang1、bFGF 的含量均显著升高(P<0.05),中药组小鼠脑组织中VEGF的含量显著升高(P<0.05)。结果见表3。
表3 益气活血中药组分对CCI 模型小鼠脑组织中VEGF、Ang1、bFGF 含量的影响(±s,n=5,ng/mg)
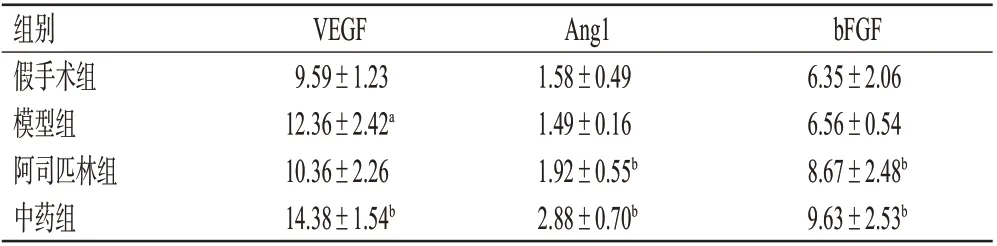
表3 益气活血中药组分对CCI 模型小鼠脑组织中VEGF、Ang1、bFGF 含量的影响(±s,n=5,ng/mg)
a:与假手术组比较,P<0.05;b:与模型组比较,P<0.05
组别假手术组模型组阿司匹林组中药组VEGF 9.59±1.23 12.36±2.42a 10.36±2.26 14.38±1.54b Ang1 1.58±0.49 1.49±0.16 1.92±0.55b 2.88±0.70b bFGF 6.35±2.06 6.56±0.54 8.67±2.48b 9.63±2.53b
4 讨论
CCI 作为一种脑整体水平血液供应减少的病理状态,不仅是多种缺血性脑血管疾病的发病原因,也是VCI的重要致病因素[10]。本研究采用温控电流刺激小鼠双侧颈总动脉,损伤血管内皮细胞,促使血小板黏附聚集,造成大脑低灌注,可较好地模拟患者前循环(颈内动脉系统)缺血导致CCI 的病理状态[11]。因本研究所用CCI模型与血小板聚集致颈总动脉血栓栓塞有关,结合《慢性脑缺血中西医结合诊疗专家共识》的推荐(对于血栓形成导致的CCI,临床应重视阿司匹林抗血小板聚集治疗)[12],本研究以阿司匹林作为阳性对照药物。本研究结果显示,模型组小鼠学习记忆能力较假手术组明显减退,与既往文献研究的发现一致[13]。
NVU理论既与中医“整体观”的思想一致,又强调了血管在神经结构和功能保护中的重要地位。王大鹏等[14]研究发现,CCI 发生时,NVU 的结构和功能发生了显著改变,可见神经元凋亡、微血管完整性受损、血脑屏障功能失调等。本研究观察到的小鼠脑组织中NVU超微形态结构的异常改变与上述研究基本一致;同时,该病理变化伴有小鼠学习记忆能力减退。在给予益气活血中药组分干预后,小鼠脑组织病理改变和学习记忆能力均有恢复。这提示CCI致NVU超微形态结构改变可能是CCI导致认知功能受损的病理基础,且益气活血中药组分对这种改变有一定的改善作用。
VEGF 作为NVU 的主要标志蛋白之一,可促进NVU重塑,对缺血大脑的NVU具有特殊的保护作用[15]。Ang1 与NVU 密切相关,当脑缺血发生时,Ang1 能促进微血管生成,维持血脑屏障的完整性,抑制神经元凋亡,促进神经功能的恢复[16]。bFGF 广泛分布于中枢神经系统内,不仅能营养和保护神经元,还能促进微血管的再生,诱导侧支循环的建立[17]。α7 nAChRs 与记忆能力密切相关,激活后可减轻缺血脑组织的炎症反应,抑制细胞凋亡,发挥神经保护作用[18]。本研究结果显示,与假手术组比较,模型组小鼠脑组织中VEGF蛋白和mRNA的表达均显著升高,α7 nAChRs蛋白和mRNA的表达均显著降低,表明CCI状态可影响脑内VEGF的表达,调控脑组织内血管内皮细胞增殖和微血管再生,同时可影响脑内与记忆认知功能密切相关的α7 nAChRs的表达,影响神经元兴奋性和神经递质的传递,最终直接损伤小鼠认知功能。在给予益气活血中药组分干预后,小鼠脑组织 中VEGF、α7 nAChRs 蛋 白 和mRNA 的 表 达 以 及VEGF、Ang1、bFGF的含量均显著升高,提示该中药组分改善CCI 所致认知功能障碍的机制可能与调控脑内与NVU及记忆功能密切相关蛋白的表达有关。
与急性脑血管疾病相比,CCI的可干预时间窗更长,早期诊治并有效逆转CCI 进展对防治VCI 具有重要意义[19]。本研究采用益气活血中药组分以临床等效剂量干预CCI 模型小鼠,结果发现,该中药组分能够显著改善CCI 模型小鼠的学习记忆能力,促使脑内与NVU 及记 忆 功 能 密 切 相 关 的 蛋 白VEGF、Ang1、bFGF、α7 nAChRs 的含量或表达显著升高,此举可促进脑组织中血管内皮细胞增殖和微血管再生,有利于脑血管侧支循环的建立,保护血脑屏障,恢复受损的NVU,增强神经元兴奋性和神经递质的传递,从而改善CCI导致的认知功能障碍。
综上所述,益气活血中药组分能够改善CCI所致的小鼠认知功能障碍,其机制可能是通过保护脑内NVU,恢复受损NVU的超微形态结构,调控脑内与NVU及记忆功能密切相关蛋白(VEGF、Ang1、bFGF、α7 nAChRs)的表达,进而改善认知功能。

