粉煤灰协同水热法稳定飞灰中重金属及其机理探究
圣 楠 ,孙晓蕾 ,张 伟 ,孙秀云,韩卫清
(1.南京理工大学环境与生物工程学院,南京 210094;2.化工污染控制与资源化江苏省高校重点实验室,南京 210094)
焚烧具有减容、无害化、能源可回收利用的优势[1].截至2019 年底,生活垃圾焚烧处理量占生活垃圾无害化总处理量的52.48%[2].然而,垃圾焚烧过程中会产生飞灰,飞灰中含有多种有机污染物以及多种重金属,属于危险废物[3].我国飞灰产生量随着焚烧比例的升高呈现逐年增加的趋势,亟需为飞灰的安全处置寻找一条有效途径[4].
水热处理是一种具有潜力的飞灰处理技术[5],在合适的钙与硅铝比值下,通过水热法在碱性体系中可生成硅铝酸盐矿物,达到稳定重金属的目的.Bayuseno 等[6]研究发现,飞灰水热可生成对重金属具有固定作用的各类沸石,可大幅降低飞灰中各类重金属的浸出毒性.飞灰中硅铝含量过低,无法满足水热技术的必须条件,粉煤灰中硅铝含量较高,两者经水热协同处置后,可生成稳定的雪硅钙石以稳定重金属.
将粉煤灰作为硅铝添加剂,与飞灰进行协同水热处理,探究了粉煤灰掺混比、水热时间、水热温度、是否添加碱性激发剂等条件对水热效果的影响.根据水热产物中重金属的浸出毒性(浸出方法为《固体废物浸出毒性浸出方法——醋酸缓冲溶液法》(HJ/T 300—2007)以及《固体废物浸出毒性浸出方法——硫酸硝酸法》(HJ/T 299—2007))、重金属固化率、重金属的形态分布以及水热液中的重金属浓度等指标探究水热作用对飞灰中重金属的稳定效果.同时,通过物相组成分析和微观形貌分析对水热产物中水钙铝榴石及雪硅钙石等晶体的形成和转化进行了探讨,开展了水热法稳定飞灰中重金属的基础性研究.
1 实验材料和方法
1.1 飞灰与粉煤灰样品获取
实验中所用飞灰取自扬州某生活垃圾焚烧发电厂,该厂焚烧采用炉排炉技术,日处理量1 000 t,飞灰取自烟气处理系统的袋式除尘器.实验中所用的粉煤灰取自安徽某火电厂,飞灰及粉煤灰在反应之前均置于105 ℃的烘箱中烘干至恒重,研磨过200 目筛网(74 μm)后放入干燥器中保存备用.
1.2 飞灰水热反应
将飞灰与粉煤灰按照质量比10:0、9:1、8:2、7:3、6:4、5:5 混合均匀后加入聚四氟乙烯反应釜内罐中,按照液固比10:1(mL/g)加入超纯水或者0.5 mol/L 的NaOH 溶液形成前驱液,将前驱液置于20~30 ℃下以500~1 000 r/min 速率搅拌10 h,随后超声处理1~3 h 使混合灰浆分布均匀,将聚四氟乙烯反应釜内罐装入配套的不锈钢外罐中,并将其置于烘箱中进行水热反应,水热反应温度为 140~200 ℃,时间为24~60 h.水热反应完成后,将水热反应釜自然冷却至室温后,再利用真空抽滤装置过滤反应后的飞灰水热产物.分离的水热固相于105 ℃的环境下干燥24 h 后置于干燥箱进行后续分析,分离出的水热液相用0.22µM 的亲水PTFE 针式滤器进行过滤,用硝酸酸化至pH 值小于2,然后在4 ℃冰箱中保存,用于后续分析.
1.3 重金属浸出毒性
按照《固体废物浸出毒性浸出方法——醋酸缓冲溶液法》(HJ/T 300—2007)[7]以及《固体废物浸出毒性浸出方法——硫酸硝酸法》(HJ/T 299—2007)[8]分别对原始飞灰、粉煤灰以及水热产物进行重金属毒性浸出实验,测得重金属浸出浓度与《生活垃圾填埋场污染控制标准》(GB16889—2008)[9]以及《危险废物鉴别标准浸出毒性鉴别》(GB5085.3—2007)[10]进行对比.每种重金属的固化效率(immobilization efficiency)利用式(1)进行计算:
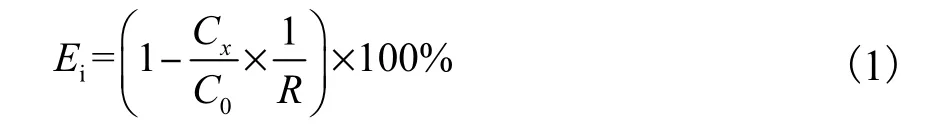
式中:Cx为水热产物重金属浸出质量浓度,mg/L;C0为原始飞灰中重金属浸出质量浓度,mg/L;R 为飞灰在混合灰中的占比.
1.4 飞灰重金属形态分布
利用BCR 连续提取法[11-12]分析飞灰及水热产物中重金属的化学形态,此方法将重金属形态分为弱酸可溶解态、可还原态、可氧化态以及残渣态4 种形态.其中弱酸可溶解态在自然环境中易浸出;可还原态和可氧化态在还原性和氧化性环境中分别易浸出;残渣态不易浸出[13].
目标金属的风险评价指数(risk assessment code,RAC)定义为弱酸可溶解态所占的分数[14],可根据式(2)计算:
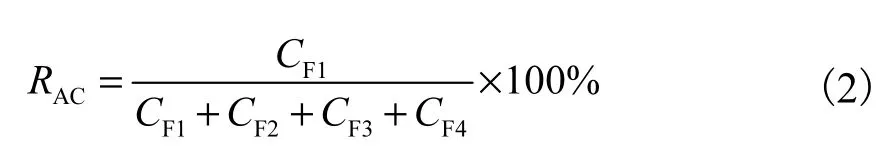
式中:CF1为弱酸可溶解态的含量,mg/kg;CF2为可还原态的含量,mg/kg;CF3为可氧化态的含量,mg/kg;CF4为残渣态的含量,mg/kg.
当RAC<1%时,金属的生物可利用性程度极低,对环境无风险;当1%≤RAC≤10%时,金属的生物可利用性程度低,对环境的影响为低风险;当10%<RAC≤30%时,金属的生物可利用性程度中等,对环境的影响为中风险;当30%<RAC≤50%时,金属的生物可利用性程度高,对环境的影响为高风险;RAC>50%为极高风险,容易进入食物链.
1.5 分析测试
飞灰、粉煤灰及水热产物中重金属含量采用HCl/HNO3/HF/HClO4体系进行全量消解.水热液相及消解后液相中的重金属含量利用电感耦合等离子体发射光谱仪进行分析测定,固相的晶体结构、元素组成及微观形貌分别采用XRD、XRF 及SEM 进行测试,实验所用仪器如表1 所示.

表1 实验仪器Tab.1 Experimental instruments
2 结果与分析
2.1 飞灰及粉煤灰理化特性分析
对飞灰和粉煤灰元素组成进行分析,结果如表2 所示.表2 中实验飞灰中Ca 含量高达28.801%,显著高于文献[15]报道中实验所用飞灰的Ca 含量(12.41%),较高的Ca 含量对硅铝酸盐沸石合成有利.飞灰中Si 和Al 含量仅为1.274%和0.486%,较文献[16]中实验所用飞灰的Si 和Al 含量(Si 含量3.87%~5.63%、Al 含量0.61%~2.43%)更低,而水热法合成沸石必须在Ca 与Si、Al 比例适宜情况下才能进行,故飞灰中较低的Si、Al 含量可能导致合成沸石效率下降,严重阻碍飞灰在水热稳定重金属方面的研究.粉煤灰中Si 和Al 的含量丰富,约为22.794%和24.223%,将粉煤灰作为硅铝添加剂可以弥补飞灰中Si、Al 含量上的不足.
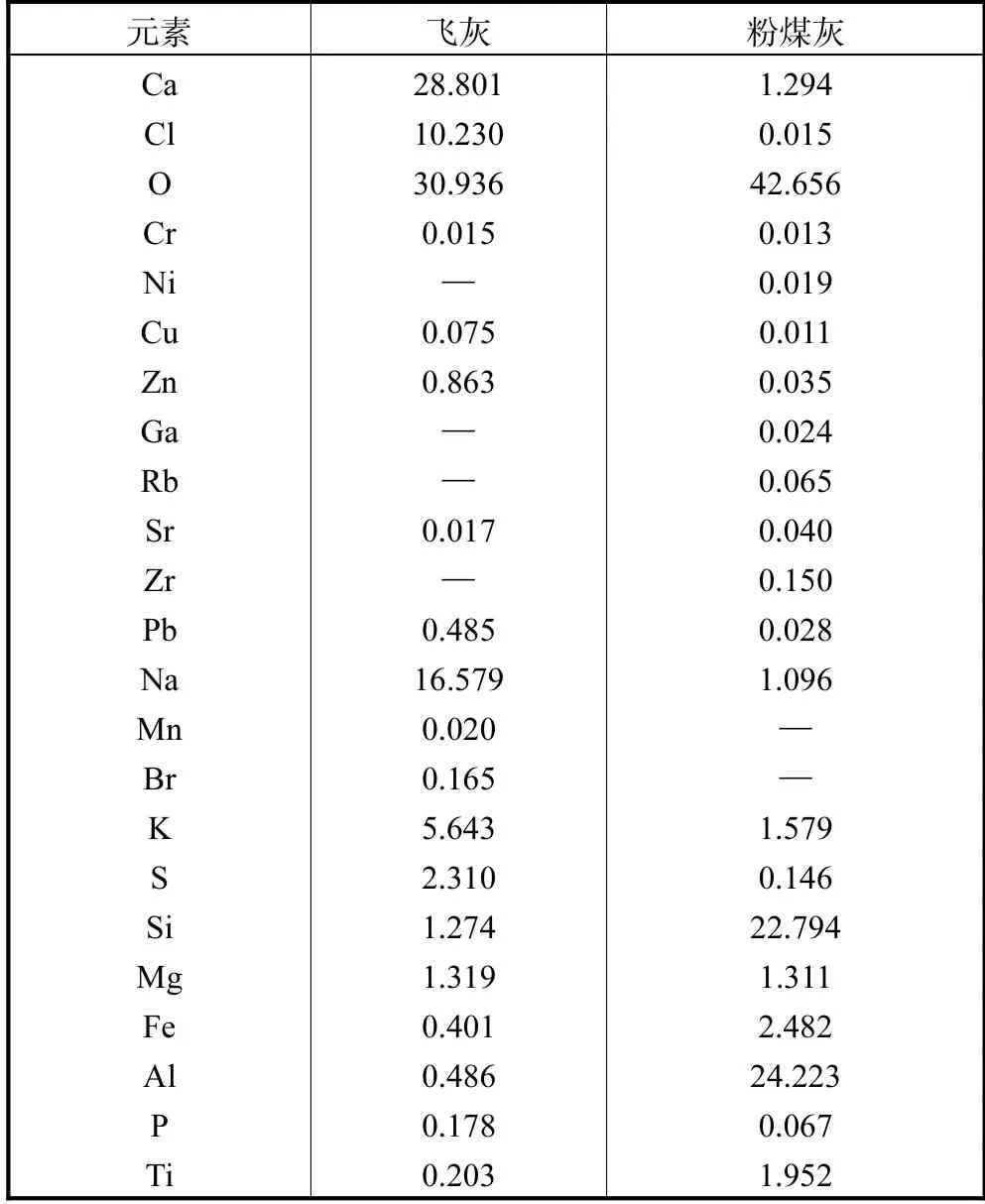
表2 飞灰和粉煤灰的化学组成Tab.2 Chemical composition of fly ash and coal fly ash %
测定了飞灰与粉煤灰中重金属的含量,并采用改进的BCR 连续提取法得到了飞灰中重金属形态分布结果[17-18],飞灰中主要重金属为Zn、Pb、Cu、Cr、Cd及Ni,含量如表3 所示,其中Ni 的含量最少而Zn 和Pb 的含量显著较高,导致这种现象的主要原因有两个,其一是城市生活垃圾本身就含有较多的重金属Zn 和Pb;其二是在生活垃圾焚烧过程中重金属Zn和Pb 易与氯元素结合形成金属氯盐ZnCl2和PbCl2,其沸点较低,所以容易挥发并且吸附在飞灰表面,使得飞灰中重金属Zn 和Pb 的含量相对其他重金属较高.
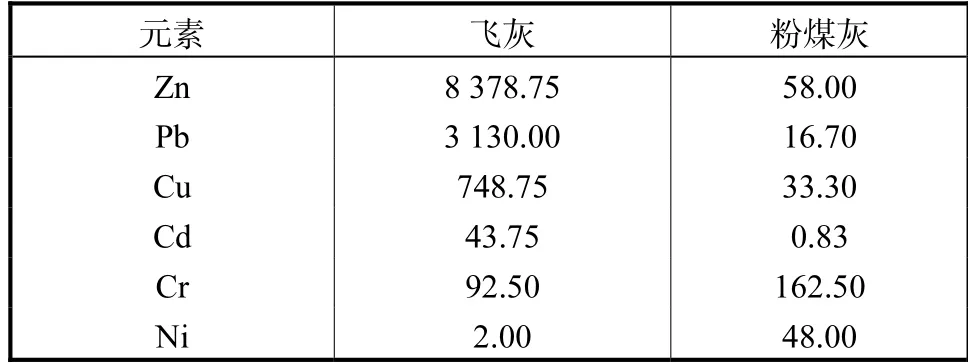
表3 飞灰及粉煤灰中重金属含量Tab.3 Heavy metal contents of fly ash and coal fly ash(mg/kg)
根据醋酸缓冲溶液法[7]以及硫酸硝酸法[8]分别对原始飞灰、粉煤灰以及水热产物重金属浸出特性进行探究,所得结果分别见表4.如表4 所示,Zn、Pb、Cu、Cd、Cr 的重金属浸出率分别为13.47%、4.03%、9.56%、61.85%和2.99%,不同重金属浸出率差异明显,这主要是由于在生活垃圾焚烧飞灰中,各种重金属的化学形态上的差异.如图1 所示,重金属Zn 和Pb 的形态分布中,弱酸可溶解态和可还原态所占的比例较大,故此两种重金属的浸出率相对也较高.
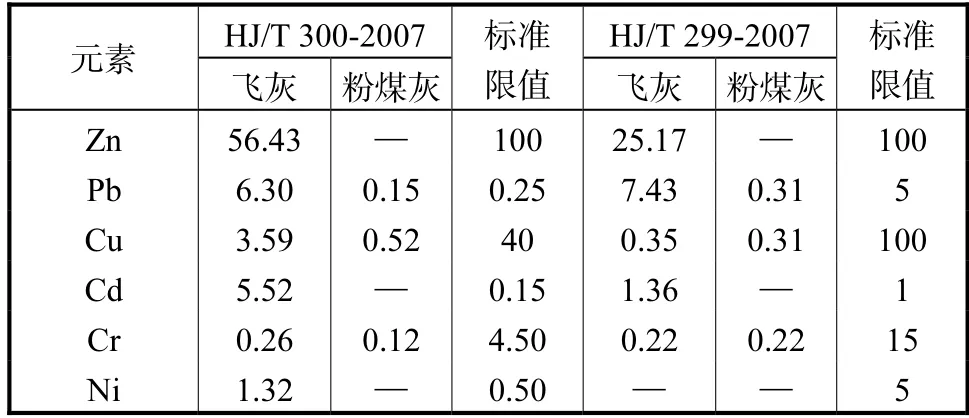
表4 飞灰及粉煤灰的重金属浸出质量浓度Tab.4 Leaching toxicity of heavy metals in fly ash and coal fly ash (mg/L)
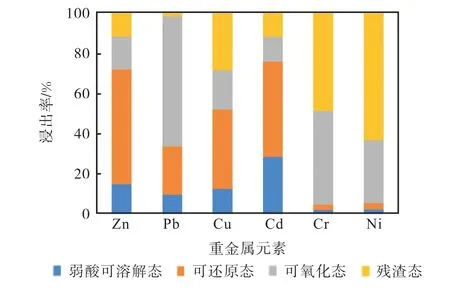
图1 飞灰重金属形态分布Fig.1 Chemical speciation of heavy metals in fly ash
图2 为生活垃圾焚烧飞灰中重金属在不同pH值下的浸出行为.由图可见重金属浸出情况随pH 值变化显著,随着pH 值的增大Zn、Pb、Cu、Cd 的浸出浓度曲线呈现下降趋势,而当pH 值大于10 时,Zn、Pb 的浸出浓度曲线出现上升趋势,文献[19-20]中也曾报道,当pH 值高于10 时,Pb 和Zn 的浸出会增加,从而呈现“V 形”曲线.
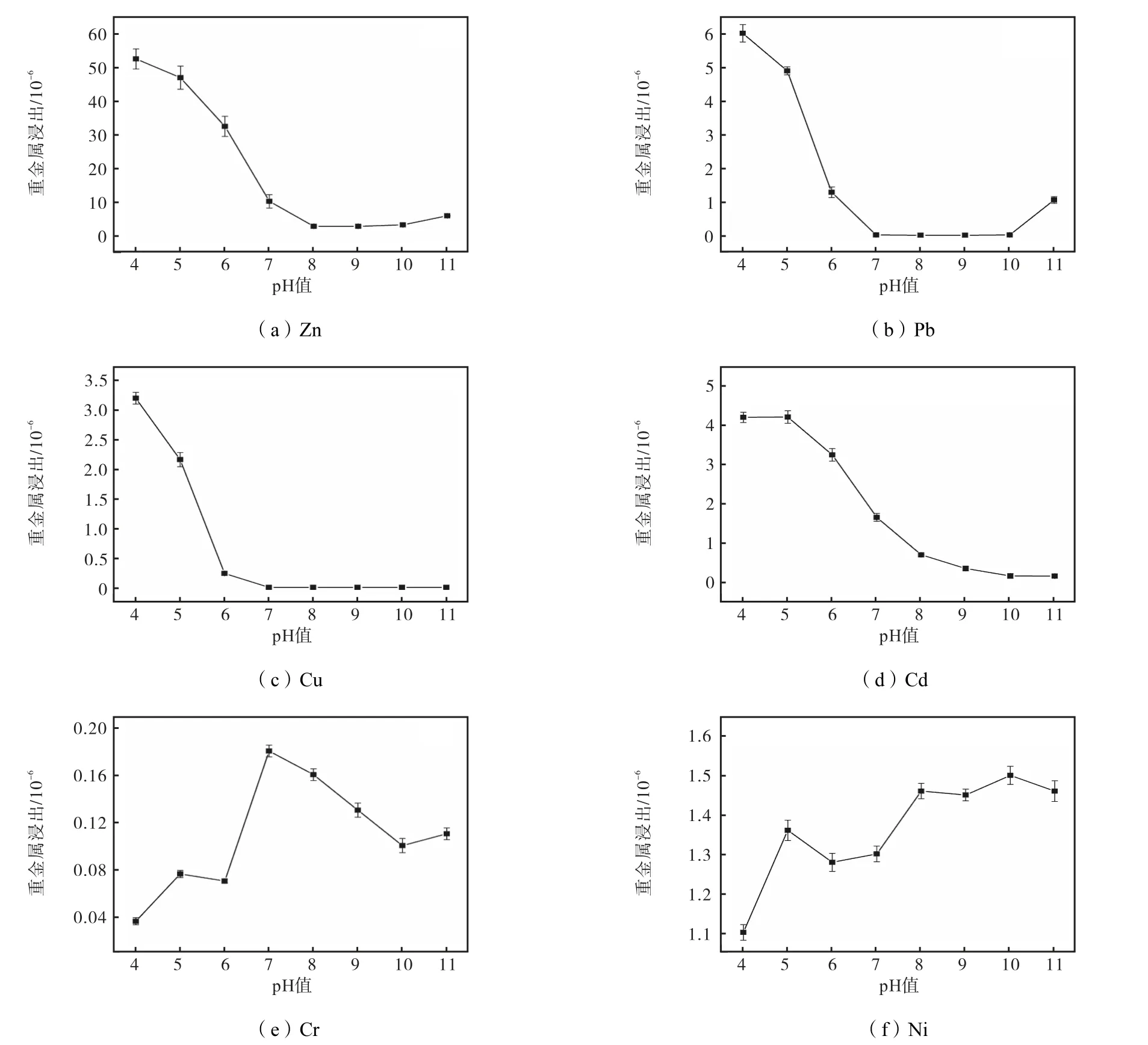
图2 pH值对飞灰中重金属浸出的影响Fig.2 Leaching concentration of heavy metals in MSWI fly ash under varying pH
Cu 和Cd 的浸出浓度随着pH 值降低而升高,并且在酸性条件下达到较大浸出浓度,这与Zhang 等[21]研究所得结论相符.Cr 在环境中的主要存在形式为三价(Cr(Ⅲ))和六价(Cr(Ⅵ)),浸出行为较为复杂.当pH 值高于7 时,溶液中控制浸出的主要物种为CrO42-,而当pH 值高于5 时,Cr3+化合物很少可溶[22].这一结果表明,CrO42-控制着飞灰中Cr 的浸出行为.
利用X 射线粉末衍射仪对飞灰及粉煤灰的物相组成进行分析,得到了相应的主要物相,并在晶峰上标出了相应的晶相,结果如图3 所示.从图3 得到飞灰的物相相对复杂,存在方解石(CaCO3)、羟钙石(Ca(OH)2)、硫酸钙(CaSO4)、羟基氯化钙(CaClOH)、氯化钠(NaCl)等,其中羟基氯化钙主要是由HCl 和Ca(OH)2反应所得,粉煤灰的主要物相为石英石(SiO2)、赤铁矿(Fe2O3)以及莫来石.
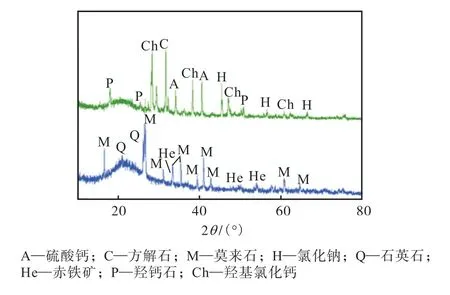
图3 飞灰及粉煤灰X射线衍射(XRD)分析Fig.3 XRD analysis of fly ash and coal fly ash
2.2 反应条件对固化的影响
2.2.1 粉煤灰掺混比对飞灰水热的影响
按照液固比10:1 向飞灰与粉煤灰混合物中加入超纯水后于160 ℃下水热反应48 h,对水热产物固相及液相进行分析.
表5 分别是按照醋酸缓冲测得不同水热产物重金属浸出浓度,根据结果可见,直接水热产物中Cd、Ni 的固化效率在7:3 时达到最佳,Pb 固化效率在7:3 和6:4 附近最佳.同时考虑固化效果和最大化处理飞灰,得到7:3 为最佳比例.Cu 和Zn 的固化效率呈下降趋势且各水热产物中Pb 和Cd 的浸出浓度均超过相关标准限值,表明飞灰直接水热产物中重金属稳定性较差,需要进一步改进水热条件.
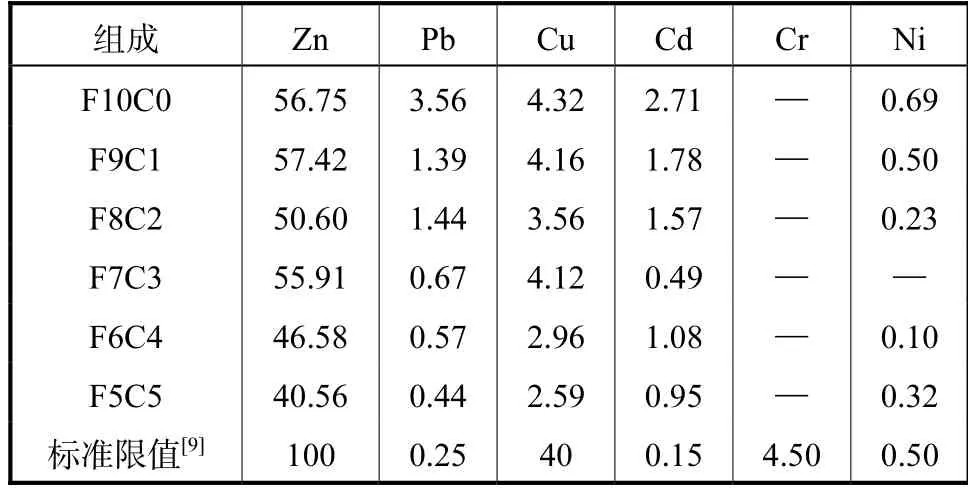
表5 水热产物重金属浸出质量浓度Tab.5 Leaching toxicity of heavy metals in HT products(mg/L)
从图4 中可以看出,原始飞灰中存在的氯盐,在水热产物中逐渐消失,这是因为这些可溶性的盐类从固相逐渐溶解至水热液相,在水热液中积累.原始飞灰中含有的羟基氯化钙的出峰消失,在飞灰直接水热产物中氢氧化钙的出峰更加明显,羟基氯化钙在强碱性环境下反应生成了氢氧化钙.雪硅钙石的前驱物是C-S-H 凝胶,此时体系中的Ca 和Si 比值较高,不能满足生成C-S-H 凝胶所需的元素比值,无法进一步生成雪硅钙石.
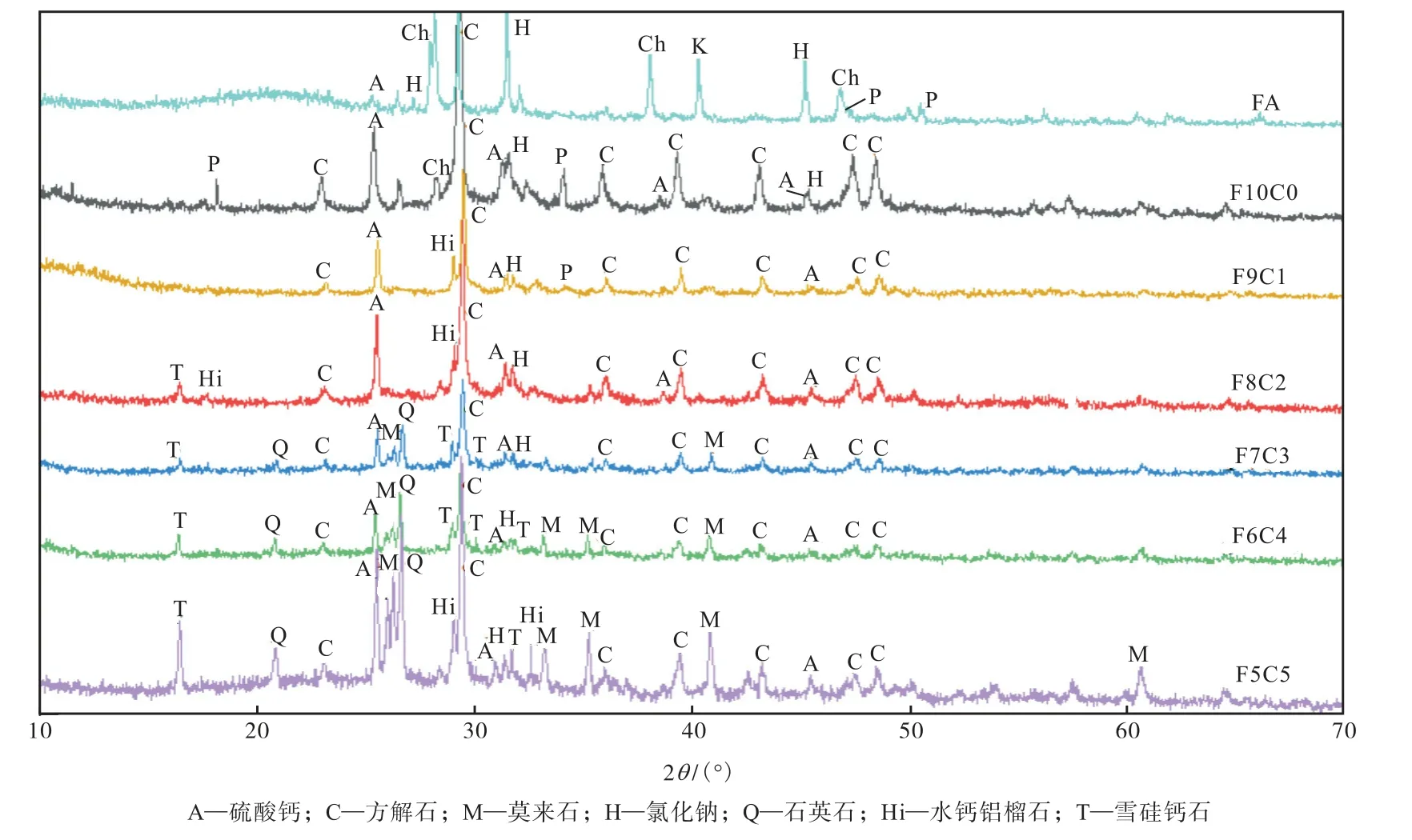
图4 不同掺比水热产物X射线衍射(XRD)分析Fig.4 XRD analysis of fly ash before and after HT
当飞灰与粉煤灰掺混比为9:1 和8:2 时,nCaO/n(SiO2+AlO1.5)元素比过高,会导致体系生成氧化钙的硅酸钙产物,为不易结晶的凝胶状物相,无法进一步晶化生成雪硅钙石,故飞灰直接进行水热以及粉煤灰掺混比较少时,都不利于水热合成硅铝酸盐类沸石固定重金属.当掺比为8:2 时,氢氧化钙完全转化为硅铝酸盐类沸石,且产物中除了水钙铝榴石外还出现了雪硅钙石的出峰,而碳酸钙的出峰并未改变,说明为沸石合成提供钙源的是氢氧化钙或者羟基氯化钙而非碳酸钙.此时体系中未出现石英石出峰,其一是因为粉煤灰添加量较少,降低了石英石含量,其二是飞灰中的碱加快了石英石向沸石的转化.
随着粉煤灰掺混比增加,nCaO/n(SiO2+AlO1.5)元素比下降,当粉煤灰的添加量为30%和40%时,nCaO/n(SiO2+AlO1.5)元素比为0.616~0.921,更接近合成雪硅钙石的元素范围,水热产物中生成雪硅钙石,且水钙铝榴石的出峰消失.
进一步添加粉煤灰使元素比达到5:5 时,此时体系中Si、Al 含量过高,而Al3+易进入雪硅钙石晶格中,使其处于稳定状态,这不利于其向硬硅钙石转变.在水热过程中,水钙铝榴石会在雪硅钙石之前形成,Si、Al 加入量过高时,Al3+无法完全取代雪硅钙石中的Si4+,导致雪硅钙石的结构彻底改变,水热产物中的杂质液随之出现.
如图5 所示,飞灰直接水热产物中具有许多六棱柱形 Ca(OH)2的晶体,由于此时 nCaO/n(SiO2+AlO1.5)元素比例高达11.438,水热产物中会形成氧化钙的硅酸钙产物,而此类物质为不易结晶的凝胶相也不会转化为硅铝酸盐类的沸石[23].当粉煤灰添加量达到30%,nCaO/n(SiO2+AlO1.5)更接近理论范围,在水热产物的扫描电镜图XRD 分析中可看出含有片状、板状的雪硅钙石的晶体[24].

图5 水热产物扫描电镜分析Fig.5 SEM photographs of FA,CFA and HT products
由表6 可见水热液的pH 值范围在9.25~12.36,属于较强的碱性环境,在水热反应过程中,重金属会向水热液中发生迁移,其中Zn 和Pb 的迁移尤为突出,其余重金属质量浓度均低于0.1 mg/L.Zn 和Pb是两性金属元素[25-26],在强碱性的水热液体系中,其氧化物和氢氧化物会溶解,最终以 Zn(OH)42-、Pb(OH)3-、Pb(OH)42-存在,发生如下反应[27]:
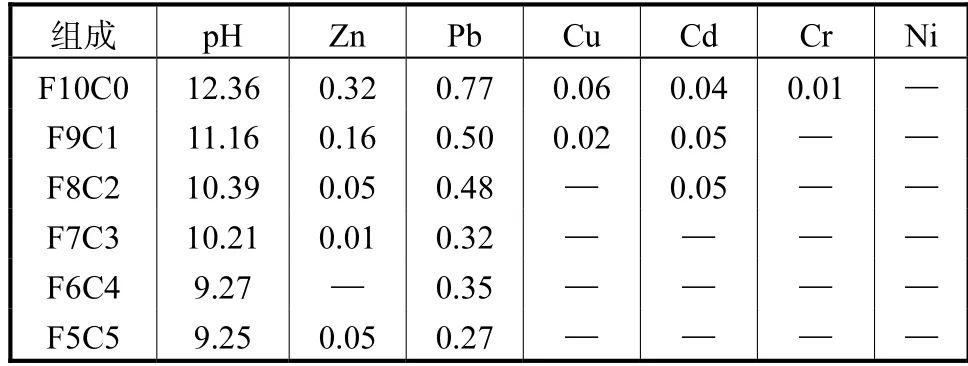
表6 水热液的pH值及重金属质量浓度Tab.6 pH and heavy metal content of hydrothermal fluid(mg/L)
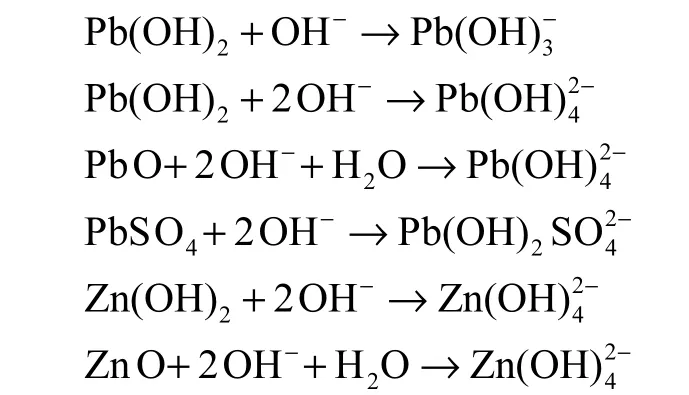
这些配合物进入水热反应液相中会导致水热液中重金属含量上升,水热液pH 值在未添加粉煤灰时为12.36,原始飞灰呈强碱性,此时水热液相中重金属含量也相对较高.粉煤灰含增加,水热液中重金属含量显著下降,一方面是因为粉煤灰占比增大,原始混合灰中重金属含量相对于未添加粉煤灰之前显著下降;另一方面是随着粉煤灰的添加Si 和Al 的含量上升,补充了单一飞灰水热在硅铝源上的缺失.
当nCaO/n(SiO2+AlO1.5)元素比在合成雪硅钙石最佳元素比范围内时,水热固相中形成大量硅铝酸盐类沸石来固定重金属,减少了重金属向水热液相的迁移.当粉煤灰占比过大时,元素比超出最佳范围,此时水热液相中重金属含量出现回升,但由于原始混合灰中重金属含量就相对较低,故重金属在液相中的含量未出现较大变化.综上,确定飞灰与粉煤灰最佳掺比为7:3.
2.2.2 水热时间及碱度对飞灰水热的影响
当飞灰与粉煤灰掺比为7:3,按照液固比10:1,未添加碱性激发剂和添加0.5 mol/L NaOH 溶液于160 ℃下分别反应24 h、36 h、48 h、60 h 后得到的水热产物,利用醋酸缓冲法和硫酸硝酸法测得水热产物重金属浸出浓度,结果分别列于表7.
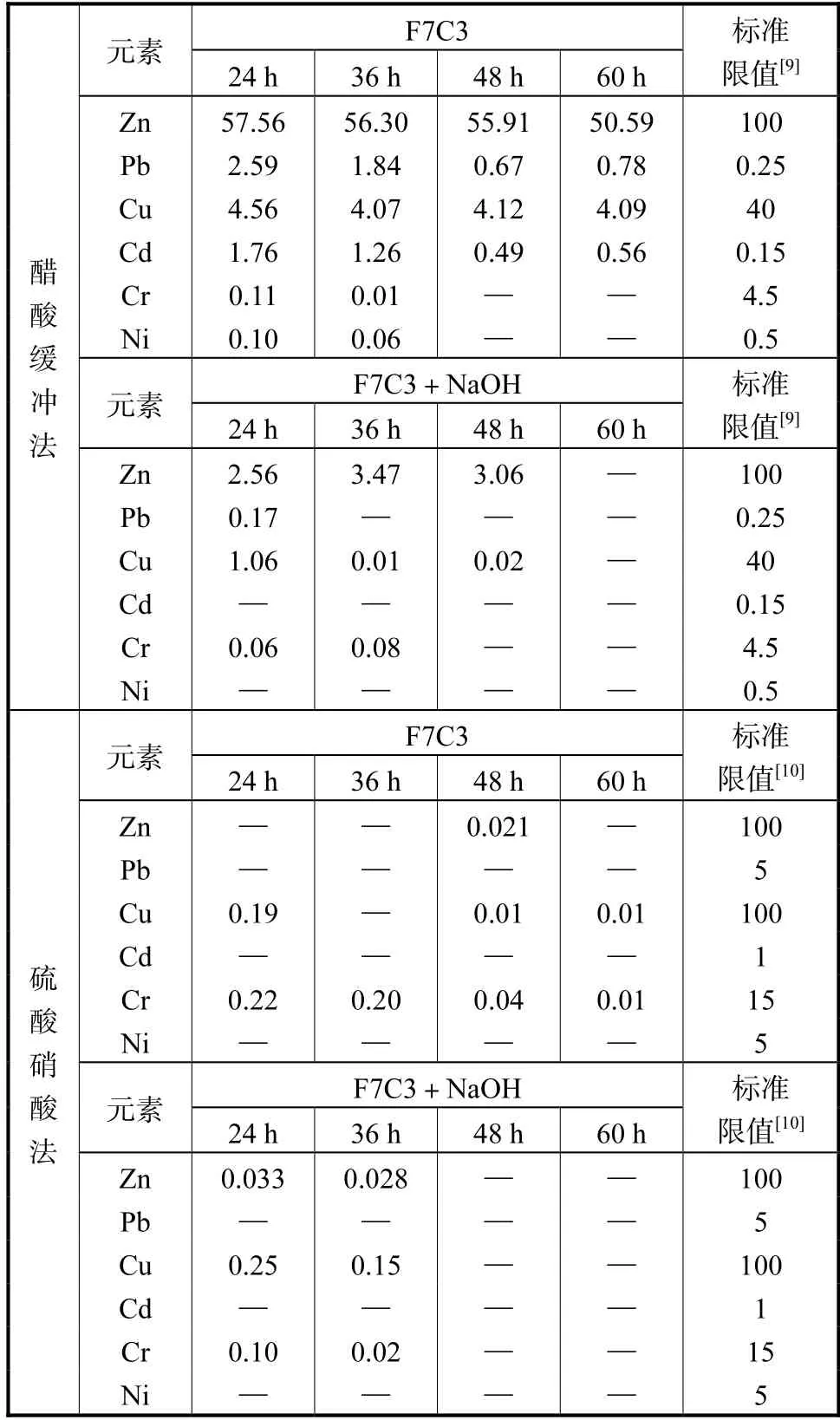
表7 不同水热时间下产物重金属浸出质量浓度Tab.7 Leaching toxicity of heavy metals in HT products of different reaction time (mg/L)
从浸出结果可见,在未添加碱性激发剂时,虽然混合灰中nCaO/n(SiO2+AlO1.5)较为适宜,但其碱性较弱,未达到生成雪硅钙石等沸石所需的碱度要求,所以无论温度如何变化,Zn 和Pb 的浸出浓度均无法达到标准限值.无论是否添加碱性激发剂,水热产物重金属浸出浓度随着时间的延长而下降,在水热进行之初,时间较短,飞灰中各种沸石晶体还未形成,重金属稳定化效果不佳,随着时间的延长,水热产物中的硅铝酸盐沸石逐渐成熟,对Zn 和Cu 进行稳定化,从而降低了其浸出浓度.
从图6 固化效率结果中可以看出,水热时间在48 h 时,Pb、Cd、Cr、Ni 的固化效率显著上升,时间延长为60 h 时,Cr 和Ni 的固化效率趋于稳定,Pb、Cd的固化效率出现微弱的下降趋势.如表7 所示,未添加碱性激发剂时,Zn 和Cu 的浸出浓度相较于反应前更高,水热激发了Zn 和Cu 的不稳定性,当加入NaOH 作为碱性激发剂时,其固化效率明显上升,强碱性的环境有利于飞灰中硅铝酸盐类沸石的形成.
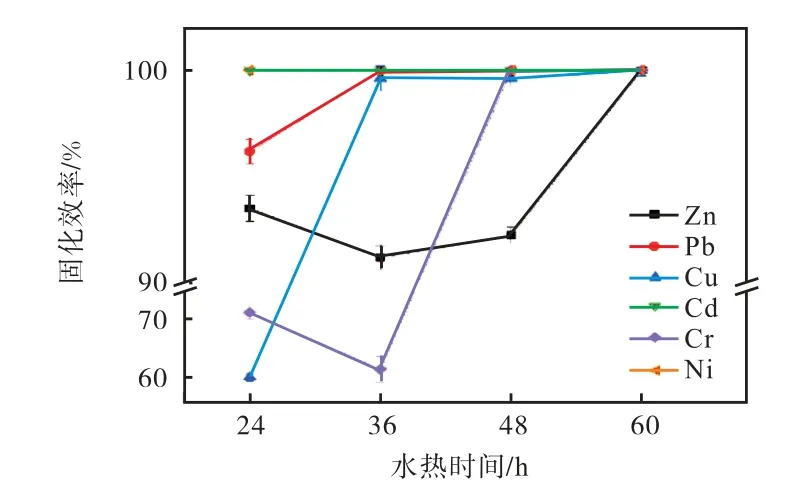
图6 水热时间对水热产物重金属固化效率的影响Fig.6 Effect of hydrothermal time on solidification rate of heavy metals in hydrothermal products
图7 是水热液相分别未添加和添加0.5 mol/L NaOH 时,不同水热产物XRD 结果.在160 ℃下直接反应24 h 的水热产物中有二氧化硅、莫来石,这些都是初始粉煤灰中含有的物质,而原始飞灰中的氢氧化钙转化为水钙铝榴石;反应进行到36 h 时,产物中同时存在水钙铝榴石和雪硅钙石,与24 h 水热产物类似,也存在SiO2和莫来石出峰.在水热过程中NaCl 和Na2SO4此类可溶性盐类溶解至液相,导致其出峰逐渐下降.在反应48 h 后水钙铝榴石的出峰消失,完全转化为雪硅钙石,此时再延长反应时间对产物影响不显著.未添加碱性激发剂时,在24~60 h 内均存在SiO2出峰,其原因可能是水热体系碱度不足,导致SiO2溶解缓慢甚至不能充分溶解.在未添加碱性激发剂时,SiO2无法完全利用,从而阻碍了水钙铝榴石凝胶的进一步生成.
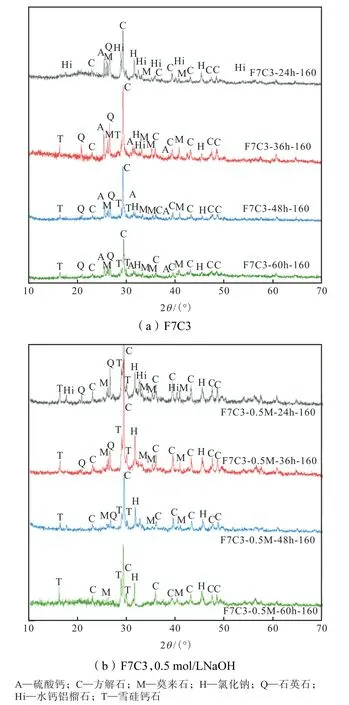
图7 不同条件下水热产物X射线衍射(XRD)分析Fig.7 XRD pattern of fly ash after HT products
当添加0.5 mol/L NaOH 作为碱性激发剂,24 h反应产物中出现水钙铝榴石和雪硅钙石的出峰,水钙铝榴石出峰于36 h 消失并完全转化为雪硅钙石,48 h时SiO2的出峰消失,此时氧化硅已被完全利用.在水热反应进行之初,CaO 溶解度比SiO2大,导致体系中CaO/SiO2较高,此时有利于C-S-H 凝胶的生成;随着反应的继续进行,温度和压力上升,SiO2溶解度逐渐上升,体系中CaO/SiO2减小,体系中生成雪硅钙石.加入碱性激发剂后雪硅钙石出峰出现得更早,并且水钙铝榴石完全转化为雪硅钙石的时间也会缩短.与未添加碱性激发剂相比,添加NaOH 后产物中硫酸钙出峰消失,氯化钠出峰更加显著,这是由于在氢氧化钠溶液中,硫酸盐优先以溶解度较高的硫酸钠形式存在;而氯化钠的溶解度会由于氢氧化钠中钠离子的抑制效应而降低,故而导致两种盐类出现相反的变化趋势.
从XRD 分析上来看,添加碱性激发剂有利于缩短硅铝酸盐类沸石的转化时间,而且更有利于飞灰重金属的固化稳定化.
图8 为未添加碱性激发剂和添加 0.5 mol/L NaOH 作为碱性激发剂时,水热产物重金属形态分布结果.在未添加碱性激发剂时,随着水热时间的延长,水热产物中Cu 的大部分可还原态转化为残渣态,使残渣态所占组分从8.99%增加到31.85%,但其占比仍较初始飞灰中Cu 的残渣态占比(30.04%)更低,Zn、Cd 也呈现出相似的可还原态向残渣态转变的趋势,Zn 的残渣态由9.45%增加到30.36%,Cd 从10.00%增加到33.79%.Pb 的主要形态变化是由可还原态转化为可氧化态,Cr 中残渣态所占组分最大,其占比在64.76%~76.05%.添加NaOH 作为碱性激发剂时,随着时间的增长,弱酸可溶解态比例逐渐降低.反应达到60 h 时,重金属的稳定性最高,而48 h时重金属的浸出浓度已达标,弱酸可溶解态在整体重金属中的占比低于10%,而48 h 至60 h 重金属稳定性的增长并不算高,出于节约能源的角度考虑,选择48 h 作为最佳反应时间更为合理.
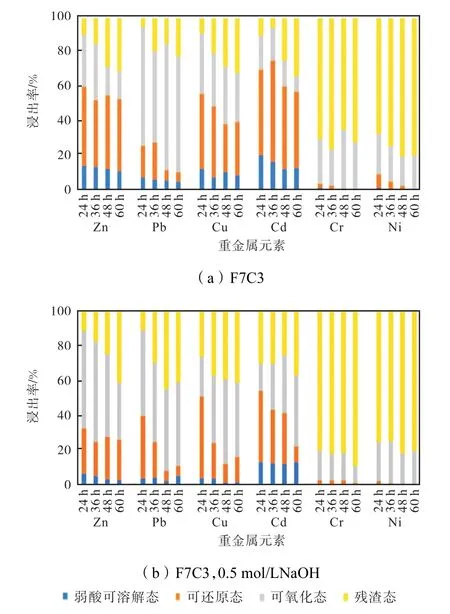
图8 不同时间水热产物重金属形态分布Fig.8 Chemical speciation of heavy metals in HT products of different reaction time
根据上述观点,将48 h、60 h 作为重金属固化效率达到最佳的时间,在此6 种重金属中,Zn 的固化效率相对较低,故推断在飞灰于粉煤灰水热过程中,除了硅铝酸盐对重金属的固定作用以外,还存在其他反应机制.由前述XRF 结果计算可得F7C3 中Si 占比约为7.8%,Al 占比约为7.6%,Bassam[28]研究提出,Si—O 的离子相似特性为44.73%,Pb—O 和Cu—O的离子相似特性为46%和44.73%与Si—O 十分相近,而Zn—O 离子相似特性为55.11%与Si—O 相差甚远.根据Goldschmidt’s rule[29],当竞争离子具有相近的电负性时,它们可以相互取代,形成具有类似离子性质的键,所以在产物中仅允许和Si—O 具有相似电负性的Pb—O 和Cu—O 等来取代Si,被取代的Pb、Cu 等重金属最终被固定在水热产物中,而Zn 不能进行这样的交换,最终表现为,在水热反应进行完全的前提下,Zn 的固化效率相对于其他重金属而言更低.
2.2.3 水热温度及碱度对飞灰水热的影响
当飞灰与粉煤灰掺比为7:3,按照液固比10:1,未添加碱性激发剂和添加0.5 mol/L NaOH 溶液分别于140 ℃、160 ℃、180 ℃、200 ℃下反应24 h 后得到的水热产物,利用醋酸缓冲法和硫酸硝酸法测得其重金属浸出浓度分别列于表8.
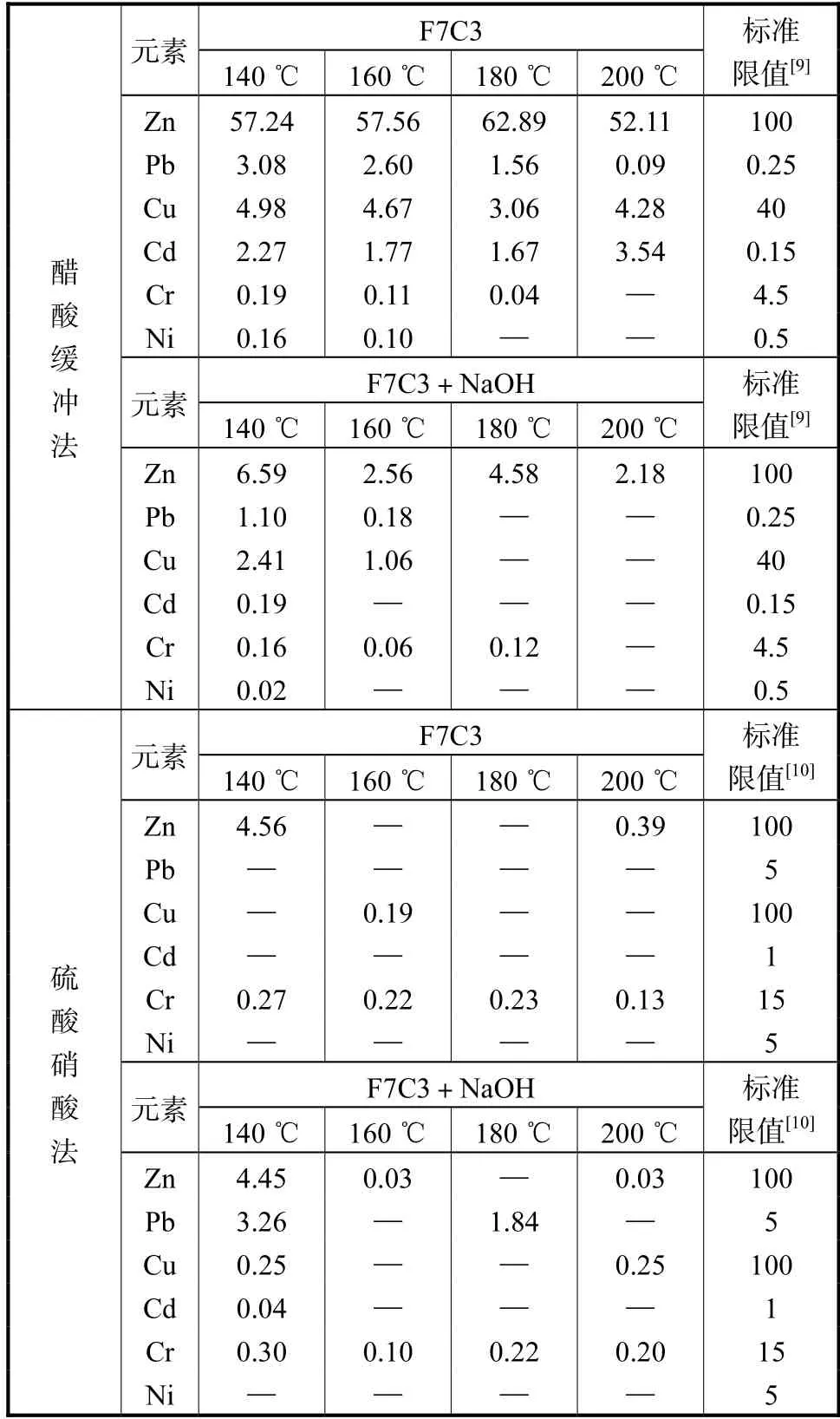
表8 不同温度条件下产物重金属浸出质量浓度Tab.8 Leaching toxicity of heavy metals in HT products of different temperatures (mg/L)
如图9 所示,随着温度的升高,水热产物的重金属固化效率逐渐上升,即重金属固化效率随着温度的升高呈现上升趋势.表8 中数据表明,在未添加碱性激发剂时,Pb 的浸出浓度只有在温度达到200 ℃的情况下才能达标,而Cd 的浸出浓度在实验中所选取的4 个温度条件下均无法达标.当添加0.5 mol/L 的NaOH 作为碱性激发剂后,只有在140 ℃时,水热产物中Pb 和Cd 的浸出浓度超标,其他温度下均未超标,即在添加了碱性激发剂后,160 ℃、180 ℃和200 ℃都可以满足填埋标准.
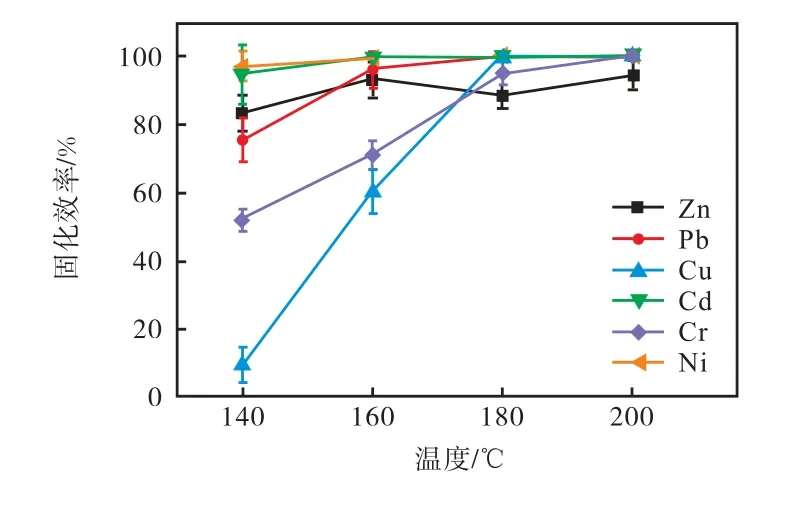
图9 不同温度下水热产物重金属固化效率Fig.9 Immobilization efficiency of heavy metals in HT products of different temperatures
图10 是未添加碱性激发剂和添加0.5 mol/L NaOH 作为碱性激发剂时不同水热产物XRD 结果.从图中可以看出,水热温度为140 ℃时,无论是否添加碱性激发剂,产物中均未出现沸石;温度上升到160 ℃,在相同时间下,未添加碱性激发剂时,出现水钙铝榴石出峰,添加碱性激发剂后,出现雪硅钙石出峰,这是由于碱性的增强加速了水钙铝榴石向雪硅钙石的转化,缩短了转化时间,在未添加碱性激发剂数据中,温度上升到180 ℃才出现雪硅钙石,表明温度上升可以加速雪硅钙石的转化,从而提高重金属稳定化效率.
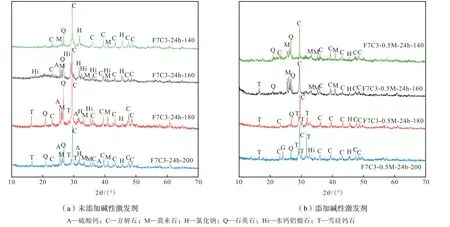
图10 水热液分别为超纯水和0.5 mol/L NaOH时不同水热产物XRD结果Fig.10 XRD pattern of fly ash after HT products
通过BCR 连续提取方法分析水热产物重金属形态分布,如图11 示,当水热温度为140 ℃时,水热产物中除Cr 以外的4 种重金属的弱酸可溶解态占比较高,因此温度过低的水热反应不仅不会对重金属有稳定作用,相反可能会增加重金属的浸出风险.随着温度提高,水热进行更加完全,产物中沸石逐渐成熟,对重金属固化效果更好,表现为重金属稳定性逐步提升,残渣态比例提高,可氧化态、可还原态、弱酸可溶解态比例降低.
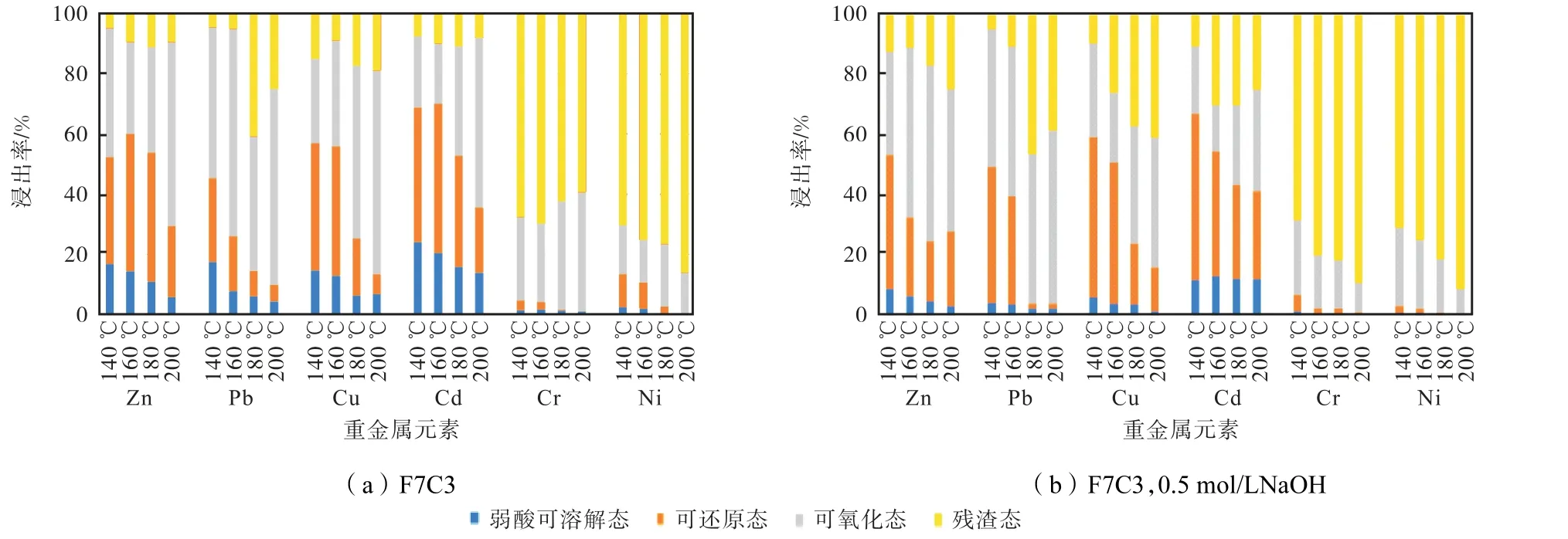
图11 不同温度下水热产物重金属形态分布Fig.11 Chemical speciation of heavy metals in HT products of different temperatures
对于实验过程中产生的水热液相均进行收集并测定其中重金属含量,结果表明水热液相中重金属含量较低,但水热液碱性较强,故后续实验考虑将水热液相进行收集并利用其中的碱度对飞灰及粉煤灰进行循环水热反应,此处未做过多赘述.
综上,虽然温度的提高可以促进重金属的固化,但在160 ℃时,重金属的稳定性高,浸出的风险低,在满足填埋条件的情况下,出于节约能源及降低成本的考虑,无需再升高温度追求更佳的固化效果,因此选择160 ℃作为最佳反应温度.
3 结论
(1) 利用硫酸硝酸法测得飞灰中重金属Pb 和Cd 含量超过危险废物鉴别标准,飞灰属于危险废物;飞灰中Ca 含量高,Si、Al 含量低,导致飞灰直接水热产物中重金属浸出浓度仍超标,粉煤灰的添加可以弥补飞灰中Si、Al 的缺失.
(2) 研究中所使用的飞灰与粉煤灰混合水热反应最佳条件为:飞灰与粉煤灰掺比为7:3、液固比10 mL/g、反应温度 160 ℃、反应时间 48 h、以0.5 mol/L NaOH 作为碱性激发剂,在此条件下水热反应后,产物的重金属浸出浓度均满足生活垃圾填埋场污染控制标准中相关要求.
(3) Ca/(Si+Al)比值是决定硅铝酸盐沸石生成的重要因素.粉煤灰添加量过低时,则无法进一步生成雪硅钙石对重金属起固定作用;粉煤灰添加量过多时,Al3+无法完全取代雪硅钙石中的Si4+,Al3+彻底改变了雪硅钙石的结构,水热产物中出现水钙铝榴石杂质.
(4) 水热反应中Ca(OH)2和CaClOH 作为钙源,SiO2和含Al 化合物作为硅铝源,先生成水钙铝榴石中间产物,后逐步转化成雪硅钙石,将飞灰中重金属固定以降低飞灰中重金属浸出浓度.

