进行性核上性麻痹小脑型的临床特点(附1例报告)
孙虹,董崇,张晶晶,李渊,王慧,毛薇
进行性核上性麻痹(PSP)是以核上性眼肌麻痹、频繁跌倒、颈部和躯干肌张力增高和认知功能下降为主要表现的神经系统变性病。分为PSP-理查德森型(PSP-RS型)、PSP-帕金森病型(PSP-P)、PSP-冻结步态型(PSP-PAGF或PSP-PGF)等多个类型[1]。
依据国际运动障碍病学会PSP诊断标准(2017),小脑共济失调为PSP诊断的排除标准[1]。但有些经病理证实的PSP患者以躯干和肢体共济失调为首发和/或主要症状,应被归类为PSP小脑型(PSP-C),该分型于2009年由日本学者Kanazawa等[2]提出。
目前报道的PSP-C病例数仅二十余例,本文报道了1例经详细文献复习及多学科讨论后诊断的PSP-C患者,为我院首例,国内尚无相关报道。
1 临床资料
患者,男性,61岁,退休干部。主因“行走缓慢两年余,言语不清伴记忆力减退1年”于2021年11月6日收入院。两年余前家属发现患者行走及转身动作缓慢,患者自觉行走时双下肢沉重感,伴兴趣减低,不愿外出活动;1年半前出现行走不稳,左右摇晃,站立时双脚间距增宽,伴起步困难、行走呈小碎步,时有身体前冲,上台阶时出现多次向后跌倒。家人发现患者间断愣神(眼光呆滞),期间意识清楚,可正确对答;有视物模糊、偶有视物成双。外院就诊考虑帕金森综合征,予美多芭125 mg,每日3次,服药后自觉症状无改善停用。1年前患者出现言语含糊,语句顿挫,偶有声音嘶哑及饮水呛咳,记忆力减退(不记得刚做过的事,不记得是否服药),伴情绪淡漠,主动语言少。8个月前出现双手活动缓慢,书写潦草,系扣子、系鞋带、刷牙等精细动作笨拙,需要家人照顾。尿频、尿急,间断尿失禁40年(上高中因精神紧张出现尿频、尿急、尿失禁,之后间断出现,频率无明显增加);睡眠中喊叫2年,无明确肢体挥舞动作;无嗅觉减退、便秘,无幻觉、妄想,无多汗、流涎等症状。30年前有一氧化碳中毒史,否认意识丧失;16年前患“脱髓鞘性脑病”,表现为言语不清,眩晕伴行走不稳,予糖皮质激素治疗1个月(剂量不详)后,言语及行走不稳均较前改善,后口服糖皮质激素6个月(剂量不详),坚持康复训炼5 年后,语言、行走逐渐恢复正常,仍偶有行走时头晕;否认家族遗传病史及类似疾病史。查体:卧立位血压无异常,神清,记忆力及定向力减退,计算力及理解力可,面部表情及瞬目动作减少,构音障碍,双侧眼球水平、垂直运动均受限,眼球活动速度减慢,右侧中枢性面瘫,余颅神经查体均阴性。四肢肌力Ⅴ级,颈肌肌张力增高,四肢快复动作笨拙,下肢为著;双下肢腱反射对称活跃,双侧病理征阳性;双侧指鼻稳准,双侧跟-膝-胫试验欠稳准,步基增宽,一字步不能,后拉试验阳性,鼓掌征阳性。帕金森生活质量评分(PDQ-39)69分。认知测评(大学学历):MMSE 21分,蒙特利尔认知评估量表(MoCA)-A(北京版)15分,MoCA-B 19分。汉密尔顿抑郁量表(HAMD)14分,老年抑郁量表(GDS-30)24分。血常规、便常规、血沉、肿瘤标记物、糖化血红蛋白、维生素B12、叶酸、风湿三项及抗体五项、抗中性粒细胞胞浆抗体、抗心磷脂抗体谱、抗核抗体谱:未见异常。腰穿检查:压力150 mmH2O(1 mmH2O=0.0098 kPa);CSF常规、生化、免疫球蛋白、自身免疫性脑炎和副肿瘤相关抗体均阴性。CSF总tau蛋白含量239.73 pg/ml,总Aβ42蛋白含量28.88 pg/ml,总tau蛋白含量与总Aβ42蛋白含量比值8.30。头颅MRI示中脑萎缩,小脑及小脑上脚萎缩(图1)。黑质超声示双侧侧脑室前角增宽。右侧黑质区域高回声面积0.15 cm2,左侧黑质区域高回声面积0.18 cm2,中缝核连续。膀胱残余尿22.6 ml。头颅脱氧葡萄糖-PET-CT检查示双侧壳核葡萄糖代谢增高;右侧尾状核头代谢轻度减低;双侧小脑半球代谢中重度减低,左侧为著;双侧下颞叶、额叶代谢轻中度减低(图2)。多导睡眠监测示快速动眼期可见阵发肌电活动增高。左旋多巴负荷试验(多巴丝肼片187.5 mg)示统一PD评定量表Ⅲ基线评分32分,服药后2 h最大改善率13%。诊断:很可能的PSP-C。给予卡巴拉汀3 mg/d、美金刚5 mg/d改善智能,坦度螺酮片5 mg每日3次改善行走不稳,患者症状略有改善。嘱患者出院后继续随访、调整治疗方案。
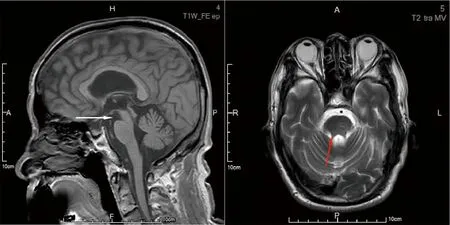
图1 头颅MRI 矢状位示小脑和中脑萎缩(白色箭头),轴位示小脑上脚萎缩(红色箭头)
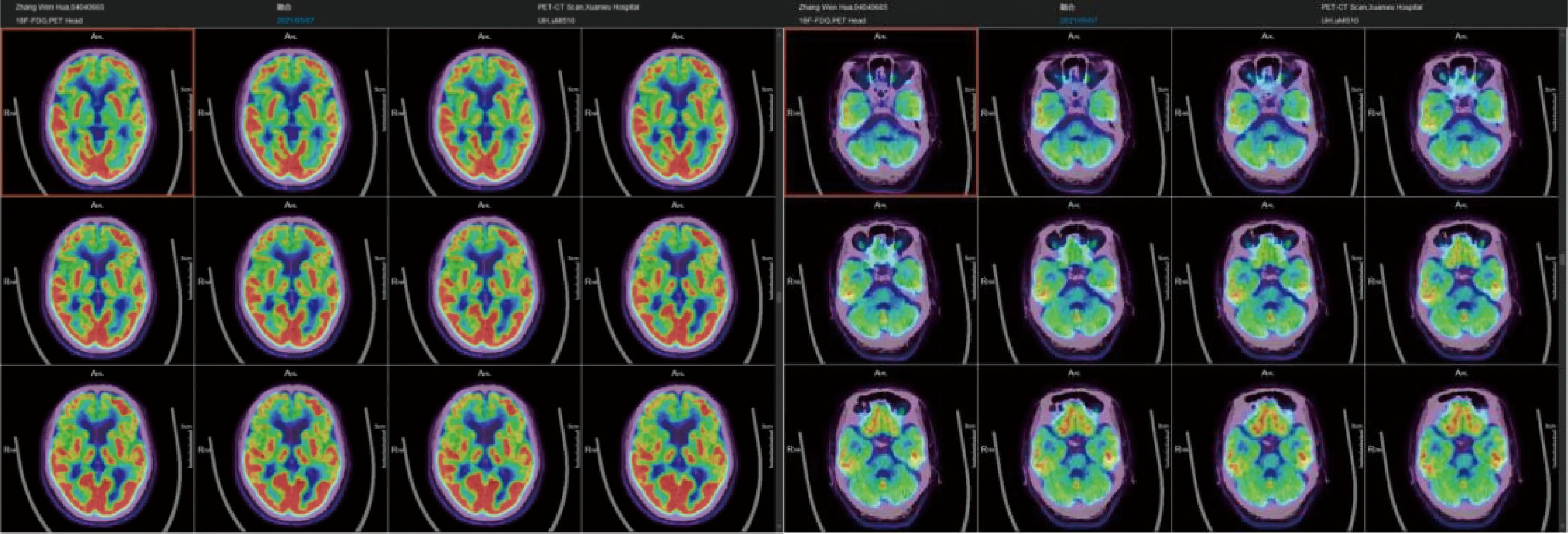
图2 头颅FDG-PET-CT 右侧尾状核头代谢轻度减低;双侧小脑半球代谢中重度减低,左侧为著;双侧下颞叶、额叶代谢轻中度减低
2 讨 论
国际运动障碍病学会PSP诊断标准(2017)中未提及PSP-C的诊断标准[1]。日本Shimohata教授[3]于2015年提出推荐的PSP-C的诊断标准:支持标准包括(A)慢性病程;(B)起病年龄>40岁;(C)核上性眼肌麻痹;(D)2年内出现躯干或肢体共济失调;(E)症状出现2年内因姿势不稳摔跤。排除标准包括突出的植物神经受累和头颅MRI提示脑桥“十字面包征”。很可能PSP-C的标准为 A+B+C+D+E,可能PSP-C 的标准为A+B+D+E。该诊断标准的敏感性、特异性尚未经过验证。
1964年Steele等[4]就有关于PSP共济失调的描述,估计PSP患者存在小脑性共济失调的比例在6%~44%之间[5-6]。因此,对于小脑性共济失调是否可作为PSP排除标准有待进一步商榷。PSP-C的患病率报道差异较大,梅奥诊断脑库[5]的1 085例PSP患者中,仅有3例诊断为PSP-C(0.46%),而在日本学者的一项研究[2]中,22例病理证实的PSP中有3例诊断为PSP-C。亚洲报道发病率明显高于西方国家,环境和遗传可能起到一定的作用。
研究[2,7-9]显示,PSP-C的临床特点为以男性为主(男女比例8∶2);发病年龄57~73岁,平均(67.2±5.6)岁;病程3~11年,平均(6.0±2.6)年;大多数患者以躯干共济失调引起的步态障碍为初始症状,可随疾病进展逐渐消失;发病2年内出现跌倒和核上性凝视麻痹;可出现腭部或眼-腭-咽肌阵挛;直立性低血压和快动眼睡眠行为障碍的发生率远低于α突触核蛋白病。PSP-C 经常被误诊为多系统萎缩(MSA),尤其是伴有突出小脑共济失调的MSA小脑型(MSA-C)。研究比较了经病理证实的 PSP-C和MSA-C 患者的临床特征,相比之下PSP-C特征为发病年龄晚(68.8岁vs.58.3岁),有早期跌倒和垂直凝视麻痹,少有自主神经损害。MSA-C特异性体征还包括凝视诱发的眼震和眼球追踪异常[10]。此外,鉴别诊断还应包括成人散发性小脑性共济失调、脊髓小脑性共济失调2型和3型[11]。
小脑传出通路齿状核-红核-丘脑-皮质通路可能与PSP-C患者共济失调症状最有关系。某些临床研究结果支持这一理论[12],主要包括如下三个方面:(1)PSP 患者的电生理研究显示,小脑经颅磁刺激(TMS)诱发的运动诱发电位(MEPs)减少,提示小脑传出通路功能障碍。(2)MRI结果显示小脑传出通道小脑上脚(SCP)萎缩,Flair信号增高;(3)PSP-C主要为躯干而非肢体共济失调可用齿状核损害来解释,类似于齿状核红核苍白球路易体萎缩(DRPLA)。此外早期跌倒可能与丘脑底核的病理改变关系较大[13]。
PSP-C的MRI表现有特征性,早期小脑、中脑、额叶无明显萎缩,晚期小脑成比例性萎缩,无小脑裂扩大,脑桥小脑池增大,SCP、中脑萎缩,第四脑室中重度增大,小脑或脑干未见异常信号,包括“十字面包征”,有助于和MSA-C相鉴别[14-15]。病程早期小脑萎缩不明显,进展期脑桥小脑池扩大,小脑上脚、中脑萎缩有助于PSP-C与脊髓小脑变性相鉴别[2,8,16]。
针对PSP-C尚缺乏有效的治疗措施,但存在一些潜在的治疗手段。针对小脑的TMS治疗:齿状核对初级运动皮质(M1)具有张力易化作用[17]。小脑TMS治疗可使M1区运动诱发电位幅值降低[18]。一侧小脑深部核团的损害可引起对侧M1兴奋性输入信号的降低,通过对病变对侧齿状核进行神经导向性TMS或后部小脑深部电刺激,可以准确使双侧M1皮质输入信号达到平衡,从而长期改善共济失调[19-20]。针对tau蛋白的疾病修饰治疗:PSP是疾病修饰疗法的候选疾病,因为 PSP 是一个纯粹的tau蛋白病。针对tau蛋白的显像技术,可用于tau蛋白疾病修饰药物的疗效评估[21]。
该例患者发病2年内出现突出的小脑性共济失调及反复向后跌倒的症状,同时合并核上性眼肌麻痹,影像学无桥脑“十字面包征”,MRI示中脑萎缩,小脑和小脑上脚萎缩,PET检查提示小脑代谢重度减低,综合考虑符合很可能的PSP-C诊断标准。临床表现和查体提示小脑受累明显,尿频、尿急、尿失禁提示自主神经受累,为诊断MSA的支持点,但该患者特征性的下视性凝视麻痹、反复向后跌倒,及早期出现的认知功能减退,对诊断PSP具有重要的提示意义。如果该患者完善多巴转运体和tau蛋白PET-CT,将对诊断有进一步的支持和帮助。
总之,PSP-C 是一种成人发病、缓慢进展,以躯干和四肢共济失调、垂直核上性麻痹和频繁跌倒为主要临床表现的PSP新分型。影像学表现缺乏特异性,但应关注小脑上脚和齿状核等部位,MRI新序列及tau PET显像可能对PSP-C的影像识别具有重要意义,MRI 上的“十字面包征”为其排除标准。治疗上,新兴的治疗手段和功能康复治疗可能对于改善小脑共济失调症状具有一定效果。

