黄秋葵MYB转录因子的鉴定及与果实老化关系分析
李永平 白昌辉 薛珠政 朱海生 温庆放
(福建省蔬菜遗传育种重点实验室/福建省农业科学院作物研究所,福建 福州 350013)
黄秋葵(HibiscusesculentusL.),锦葵科草本植物,含有丰富的蛋白质、脂肪、纤维素、多糖等物质[1],同时,幼果中含有大量果胶、牛乳聚糖、阿拉伯聚糖和丰富的膳食纤维[2],是一种高档保健蔬菜[3]。黄秋葵的食用价值较高,但其采收期短;坐果5~7 d内采收适宜,之后果荚快速老化,口感坚韧难嚼,食用性差[4];采收后常温保存1~2 d即失去商品性。
有研究发现,黄秋葵果实老化的生理过程中果荚的维管束细胞壁增厚,纤维素、木质素等大量积累[5-6]。植物次生细胞壁由纤维素、半纤维素和木质素交织构成,除了大量的蛋白与酶参与植物细胞壁的生物合成外,还受到转录因子的级联调控[7]。在植物体内的50多个转录因子家族中,参与次生细胞壁合成的转录因子主要有NAC(NAA、ATAF 1/2、CUC 1/2)和MYB(v-myb avian myeloblastosis viral oncogene homology)类转录因子[8]。MYB类转录因子是植物中数量最庞大、功能最多的转录因子家族。在拟南芥(Arabidopsisthaliana)中已发现近200个MYB成员[9]。植物细胞周期、新陈代谢及环境响应等众多生命活动都有MYB类转录因子的作用。随着生物科学研究的发展,植物中越来越多的MYB类转录因子被鉴定和分析,已成为研究植物基因功能和表达调控的热点[10]。
植物MYB转录因子参与众多生物学过程,包括细胞壁组分合成及类黄酮代谢途径等多种初生和次生代谢反应过程,对纤维素、木质素和木聚糖生物合成与沉积,以及次生细胞壁形成具有重要的调控作用[10]。拟南芥的AtMYB46[11]、AtMYB83、AtMYB58[12]、AtMYB63、AtMYB52、AtMYB54、AtMYB69和AtMYB85[13]正调控纤维素、木质素、木聚糖和半纤维素的合成,影响植物次生细胞壁的形成;AtMYB103调控纤维素的合成,以及参与花粉孢子外壁的形成[14]。拟南芥中AtMYB4、AtMYB32和AtMYB68负调控根部木质素累积[15]。火炬松(Pinustaeda)中PtMYB4[16]和PtMYB8[17]、杨树(Populus)中MYB6[18]以及苹果桉(Eucalyptusgunnii)中EgMYB2[19]等基因均在次生木质部特异表达,调控整个次生壁的合成;金鱼草(Antirrhinummajus)的AmMYB308、AmMYB330[20]和苹果桉中EgMYB1[21]的过表达均能抑制木质素的合成和次生细胞壁形成。黄秋葵中MYB46、MYB83 调节黄秋葵果实纤维素合成[5]。本研究通过显微镜观察其细胞组织结构变化,测定黄秋葵果实发育过程和采后贮存的纤维素、木质素等含量变化,明确其老化原因;并分析黄秋葵MYB家族的10个基因生物序列特征及果实不同时期的表达与纤维素、木质素含量的相关性,初步明确MYB转录因子在黄秋葵老化过程中的作用,以期为黄秋葵的生产、分子育种等提供理论基础。
1 材料与方法
1.1 试验材料
植物材料为种植于福建省农业科学院蔬菜研究室的绿色黄秋葵品种台湾五福。取健康果实[花后2、4、6、8、10 d果实,分别记为花后2、4、6、8、10 d,以及商品果(花后6 d果实)在常温下贮藏0、1、2、3、4 d,记为采后0、1、2、3、4 d],每个处理随机取3个果实混合取样,3次重复,液氮处理后,-80℃条件下保存备用。
1.2 黄秋葵果实细胞组织的形态结构观察
将1.1中试验材料于保存前去芯去籽,迅速放入甲醛-乙酸-乙醇(formalin-aceto-alcohol, FAA)固定液中固定24 h,然后用植物软化液(G1115,武汉塞维尔公司)软化14 d。参照改良的石蜡包埋法[22]制作石蜡切片。将脱蜡的切片用蒸馏水清洗,再将切片放入5%盐酸间苯三酚染色液中染色2~5 min,之后进行蒸馏水冲洗、透明封固。1×51光学显微镜(Olympus,日本)下观察、拍照。木质化的细胞壁呈紫红色,纤维素细胞组织呈蓝绿色。
1.3 纤维素和木质素提取和测定
采用硫酸蒽酮比色法测定纤维素含量[23]、滴定法测木质素含量[24]。差异显著性分析采用SPSS 19软件。
1.4 转录组测序
将1.1中的10个处理样品置于干冰中,寄往广州基迪奥生物科技有限公司,采用Illumina HiSeqTM 2500 PE125系统进行RNA-seq转录组测序,经Trinity序列组装,过滤获得49.6 G的有效数据。
1.5 基因的生物信息学分析软件
用primer premier 5.0软件设计引物序列,ProtScale(http://web.expasy.org/protscale/0)分析基因蛋白的结构与理化性质;在线软件线分析工具ProtComp 9.0(http://linux1.softberry.com)预测分析黄秋葵MYB蛋白亚细胞定位;在线软件Smart预测蛋白序列保守结构域;使用NetPhos2.0Server(http://www.cbs.dtu.dk/services/NetPhos/)软件预测磷酸化位点;MEGA 5.0软件构建进化树。
1.6 实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)分析
依据获得的黄秋葵MYB全长序列和黄秋葵Actin(GenBank: MG792 349.1),应用primer premier 5.0软件设计荧光定量PCR特异引物(表1)。使用Power SYBR Green PCR Master Mix试剂盒(ABI,美国),进行实时荧光定量PCR反应。反应体系为25 μL:PCR Master Mix 12.5 μL,cDNA 1 μL,10 μmol·L-1正反向引物各0.5 μL,加蒸馏水至总体积25 μL。反应程序:95℃预变性45 s;95℃变性5 s,56℃退火30 s,72℃延伸45 s,40个循环。每个反应设3重复,应用ABI 7500软件中的ΔΔCT法分析处理数据并得出目的基因的表达情况。
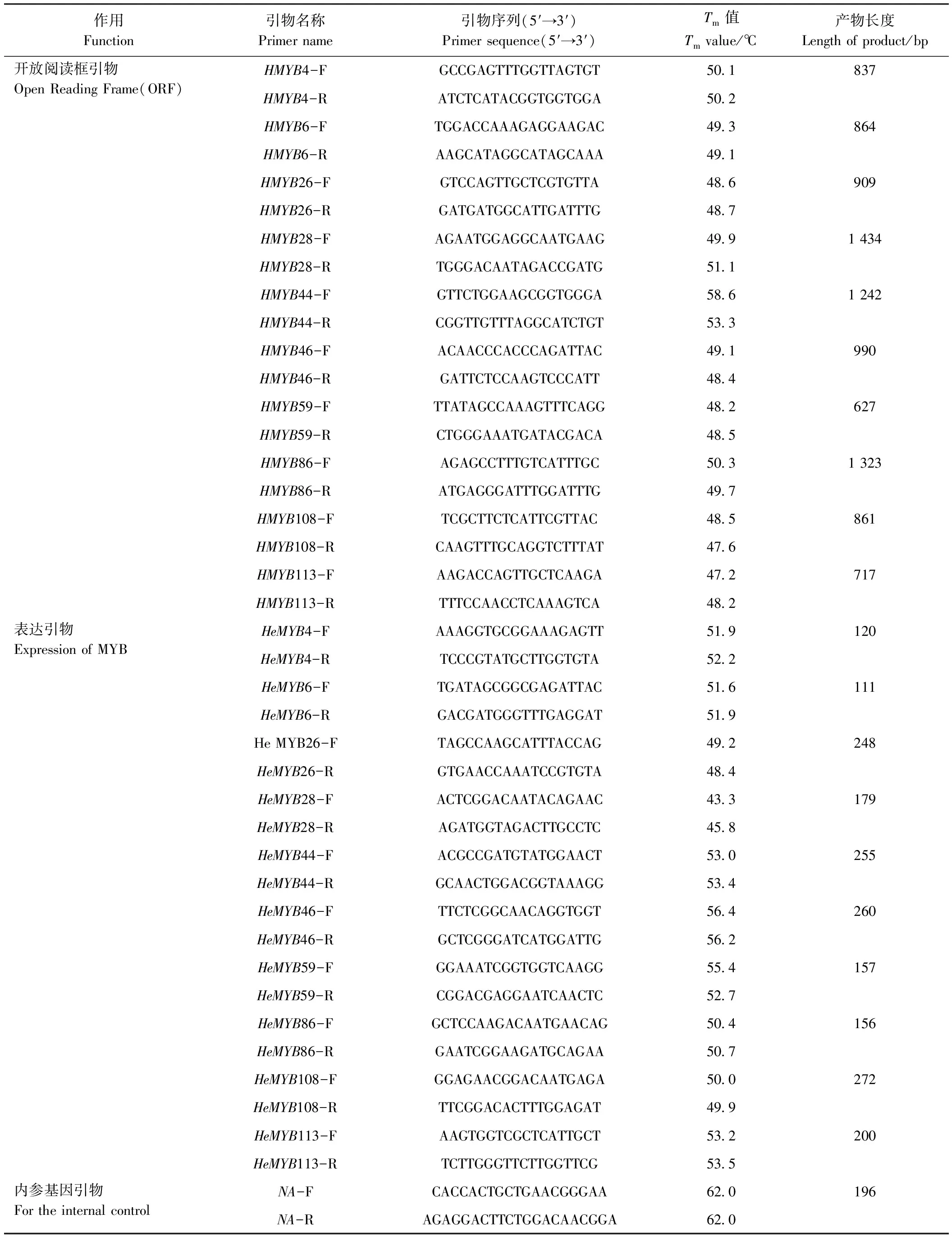
表1 黄秋葵MYB基因验证与表达的引物
2 结果与分析
2.1 黄秋葵果实细胞组织的形态结构观察
观察盐酸间苯三酚染色的石蜡切片,纤维素细胞组织呈绿色,木质素为紫红色。由图1可知,随黄秋葵果实的生长发育,维管束中细胞的细胞壁呈阶梯式增厚,花后2~6 d有增厚但不明显,花后8 d有明显的增厚,花后10 d增厚更加明显;薄壁细胞在花后2~6 d变化不大,花后8~10 d细胞壁中有一定程度增厚。维管束中细胞的细胞壁在采后0~1 d细胞壁增厚不明显,2~4 d细胞壁增厚明显。
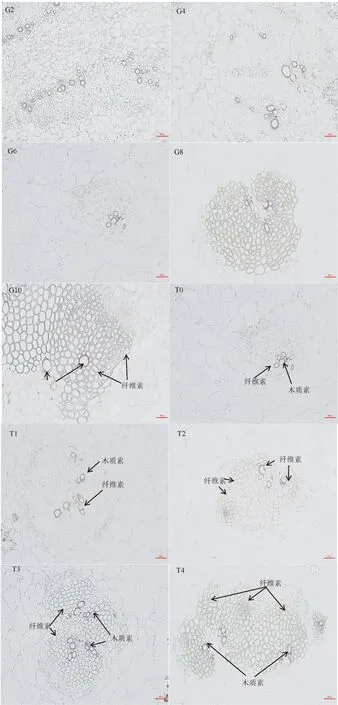
注:盐酸间苯三酚染色200倍视野;G2:花后2 d;G4:花后4 d;G6:花后6 d;G8:花后8 d;G10:花后10 d;T0:采后 0 d;T1:采后1 d;T2:采后2 d;T3:采后3 d;T4:采后4 d;标尺为100 px。
2.2 黄秋葵果实纤维素含量测定
随着黄秋葵果实生长发育,果实中的纤维素含量呈增加趋势,但在花后4~6 d,每相邻2 d的纤维素含量虽有增加,但差异不显著,花后6、8和10 d,果实的纤维素含量增加显著。黄秋葵果实采后处理中,果实采后0~4 d中,纤维素的含量持续显著增加,木质素则在采后2~3 d后增加显著(表2)。
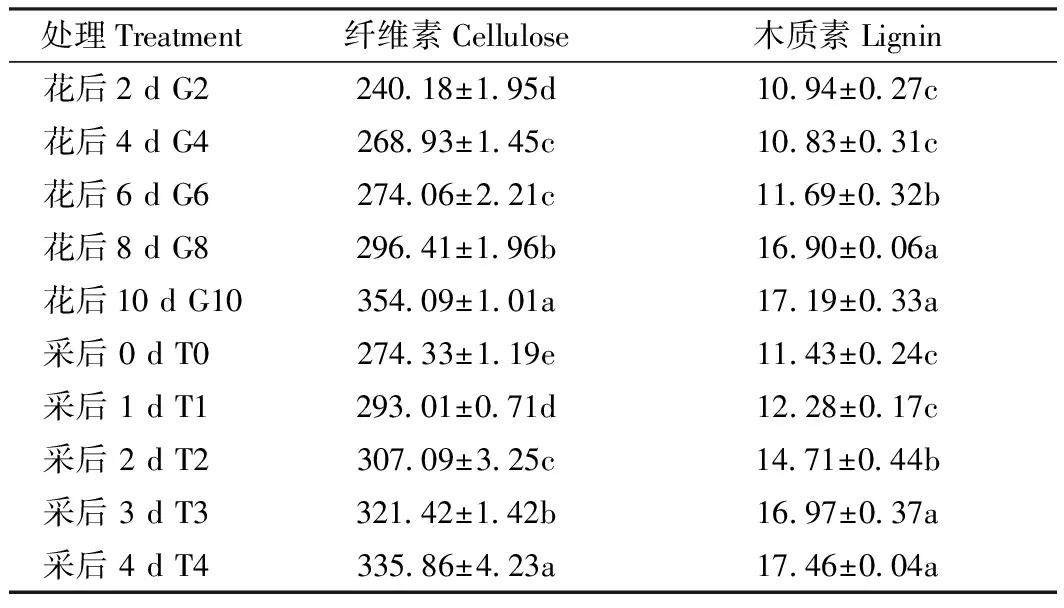
表2 黄秋葵果实发育过程、果实采后处理的纤维素和木质素含量
2.3 黄秋葵MYB基因鉴定
从黄秋葵果实转录组测序数据库中筛选得到10条功能注释为MYB基因的Unigene序列,分别为MYB4(Unigene0000800)、MYB6(Unigene0002945)、MYB26(Unigene0037799)、MYB28(Unigene0024424)、MYB44(Unigene0007347)、MYB46(Unigene0036406)、MYB59(Unigene0043914)、MYB86(Unigene0064389)、MYB108(Unigene0040179)、MYB113(Unigene0031002)。如图2所示,上述10个MYB基因在10个不同处理中均呈现表达差异模式,其中MYB59和MYB113在果实发育进程中呈现下调表达模式,MYB4、MYB6、MYB26、MYB28、MYB44、MYB46、MYB86、MYB108基因表达呈现上调模式;MYB46、MYB59、MYB108在采后常温贮藏1~4 d的果实中的表达量呈上调模式,MYB4、MYB6、MYB26、MYB28、MYB44、MYB86、MYB113则表现为下调。(图2)
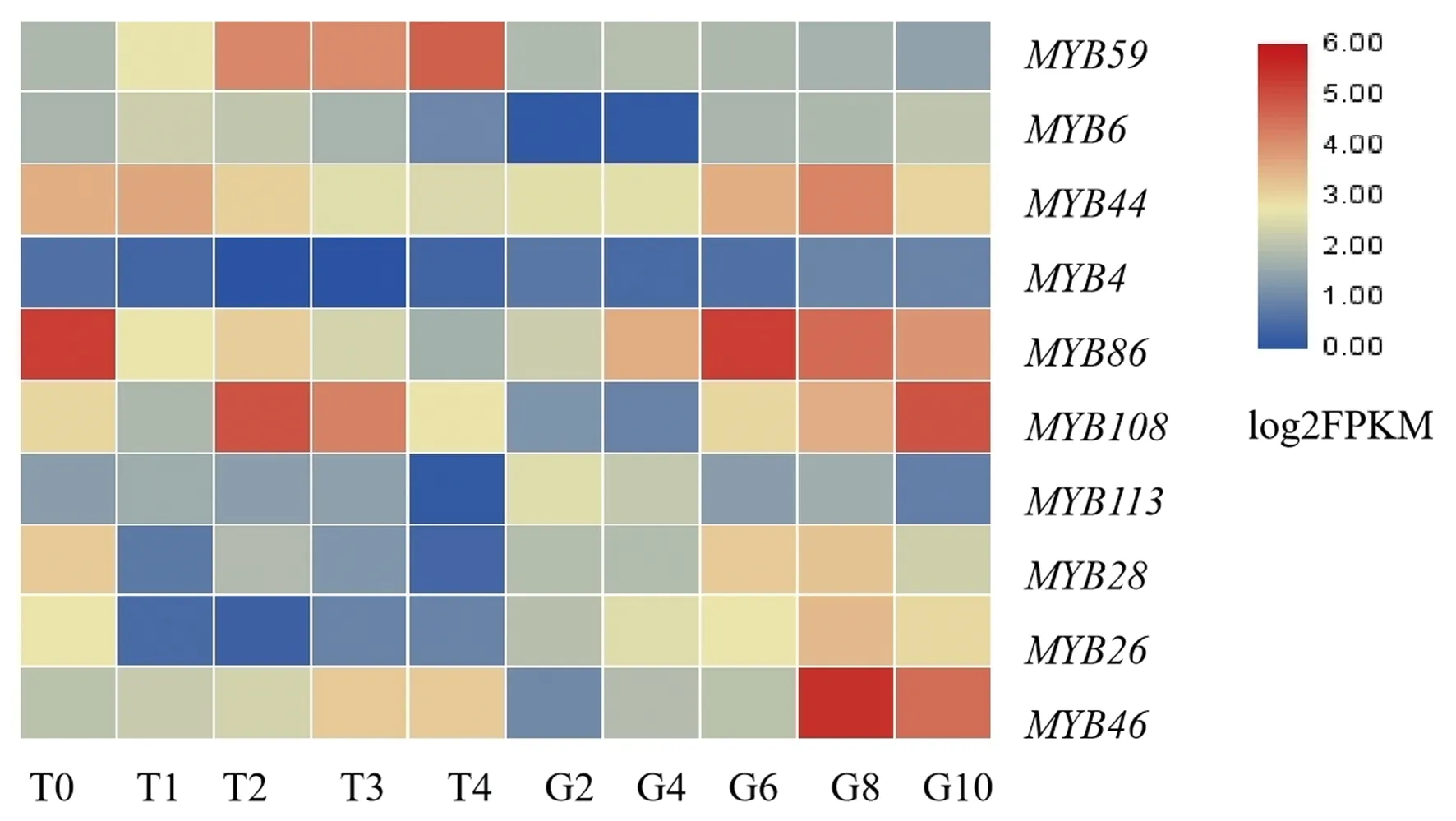
图2 MYB基因在黄秋葵果实RNA-seq数据库的表达分析
2.4 目的基因克隆及序列分析
从黄秋葵果实转录组测序数据库中筛选得到MYB4、MYB6、MYB26、MYB28、MYB44、MYB46、MYB59、MYB86、MYB108、MYB113基因序列,设计引物进行验证。经回收、连结、转化、测序,结果表明,MYB4(登录号:MW363898)、MYB6(登录号:MW363900)、MYB26(登录号:MW363897)、MYB28(登录号:MW363910)、MYB44(登录号:MW363896)、MYB46(登录号:MW674793)、MYB59(登录号:MW363901)、MYB86(登录号:MW363904)、MYB108(登录号:MW363905)、MYB113(登录号:MW363907)基因的全长分别为837、864、909、1 434、1 242、990、627、1 223、861、717 bp,上述基因编码的蛋白分别为278、287、302、477、413、329、208、440、286、238 AA。
2.5 基因的生物信息学分析
2.5.1 编码蛋白的理化性质分析 如表3所示,经克隆验证获得10条黄秋葵MYB的基因全长序列,编码的蛋白208~477 AA,分子量在27 460.13~53 726.88 Da 之间,脂肪族氨基酸指数为56.68~78.48,均为亲水性蛋白,不稳定系数在43.86~67.38之间。HeMYB6、HeMYB26、HeMYB86为碱性,其余7个MYB为弱酸性。10个MYB的蛋白都定位于质膜上。
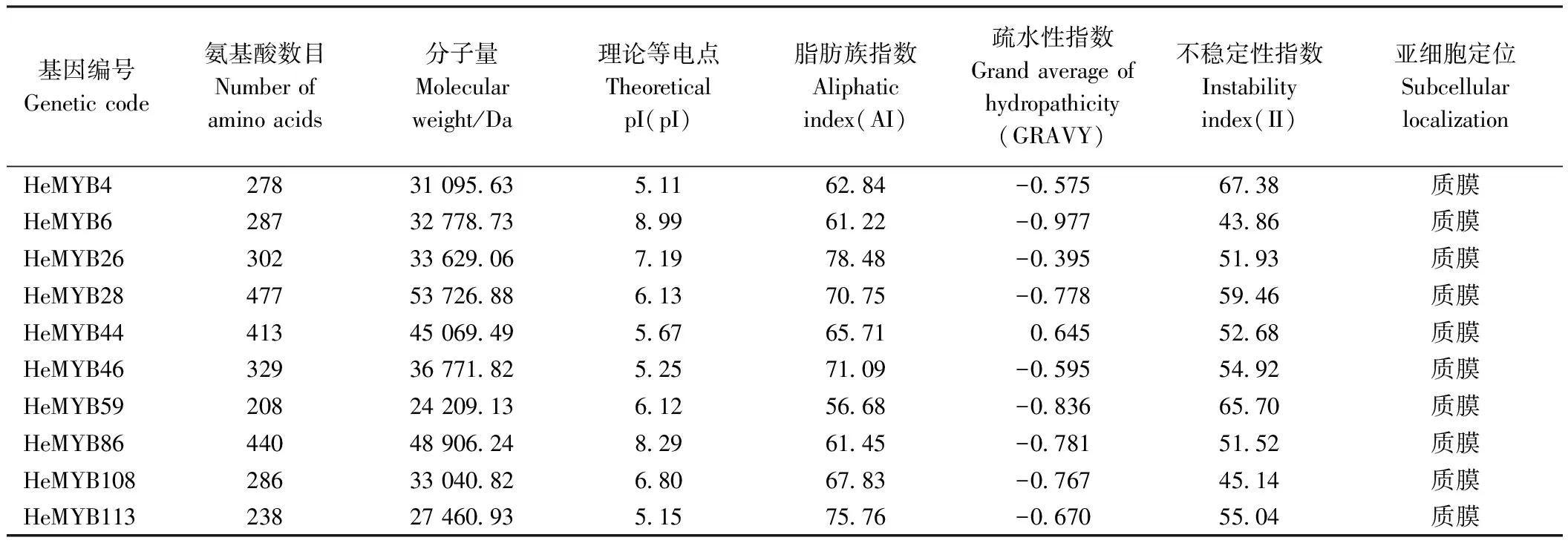
表3 黄秋葵MYB基因家族蛋白理化性质
2.5.2 蛋白磷酸化位点和保守结构域分析 蛋白质磷酸化是生物体内调节和控制蛋白质活力和功能的最基础、最重要的蛋白活性调节机制,在细胞信号转导中起着至关重要的作用[25]。使用NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)软件预测10个HeMYB转录因子的磷酸化位点(图3),丝氨酸(Ser,S)磷酸化位点最多为39个,苏氨酸(Thr,T)磷酸化位点最多为18个,酪氨酸(Tyr,Y)磷酸化位点最多为7个。说明HeMYB 转录因子的磷酸化以丝氨酸磷酸化为优势,同时兼有苏氨酸和酪氨酸磷酸化。
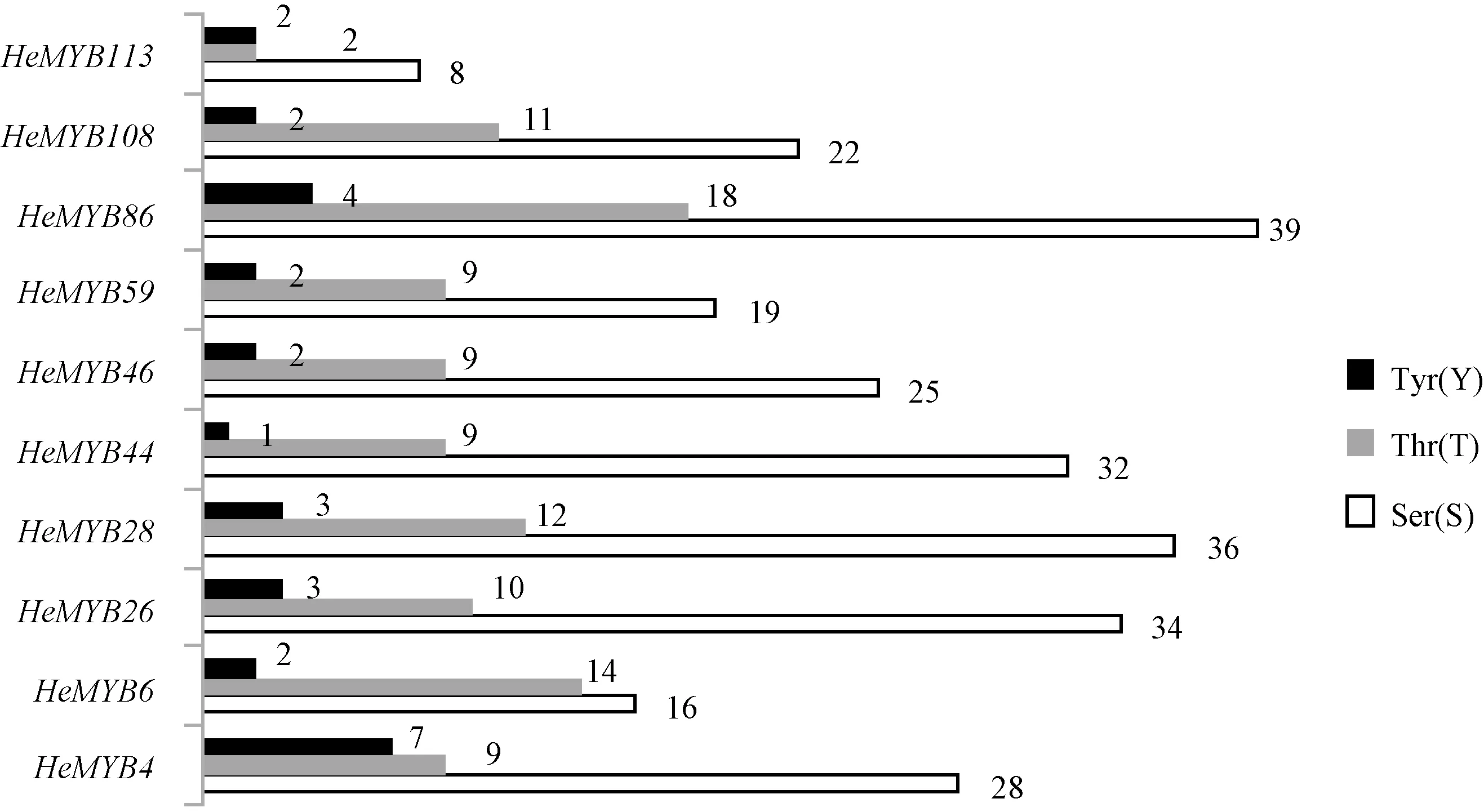
图3 MYB 转录因子的磷酸化位点数量
利用Smart进行保守结构域分析,结果显示除HeMYB59蛋白N末端均含有1个SANT结构域,其余9个HeMYB均含串联的2个R2R3-MYB型转录因子的典型SANT结构域;HeMYB4、HeMYB6、HeMYB28、HeMYB44含有1个ZnF结构域;HeMYB6、HeMYB86、HeMYB108含有1个CARD结构域;HeMYB4、HeMYB46、HeMYB59含有1个FA结构域;HeMYB46含1个KNOX2结构域,KNOX2是同源二聚化所必需的,参与次生细胞壁的合成。
2.5.3 进化分析 将黄秋葵的10个MYB蛋白序列与拟南芥、亚洲棉(Gossypiumhirsutum)、火炬松、毛果杨、苹果桉等49个MYB蛋白序列进行进化分析(图4)。49个MYB蛋白形成5个分支,Group I 包含HeMYB6、HeMYB46、HeMYB86、HeMYB26、HeMYB59、HeMYB108等35个MYB蛋白;GroupⅡ包含HeMYB113、亚洲棉MYB113等4个MYB蛋白;GroupⅢ含HeMYB59、AtMYB59、亚洲棉MYB59等3个MYB蛋白;GroupⅣ包含HeMYB44、AtMYB44、亚洲棉MYB44等6个MYB蛋白;GroupⅤ包含HeMYB28。除亚洲棉MYB4、MYB28外,黄秋葵的MYB蛋白与拟南芥、亚洲棉的相应MYB蛋白均在同一分支,且与亚洲棉的MYB蛋白的同源性更高。

图4 黄秋葵与拟南芥、亚洲棉等MYB家族系统进化树
2.6 基因表达分析
2.6.1 黄秋葵HeMYB基因家族在果实发育中的表达HeMYB46、HeMYB86、HeMYB44、HeMYB28和,HeMYB26 5个基因在黄秋葵果实发育过程中表达量先上升后下降;HeMYB59的表达量在花后2~8 d基本一致,花后10 d表达量下降,HeMYB86表达量的峰值出现在花后6 d,HeMYB44、HeMYB46、HeMYB26、HeMYB28表达量的峰值出现在花后8 d(图5-A)。HeMYB4、HeMYB6、HeMYB108在花后表达持续上升,HeMYB4花后8 d表达急剧增强,花后10 d保持高水平表达,HeMYB6在花后6 d表达量迅速增强,花后8~10 d保持平稳表达,HeMYB108则在花后6 d表达量持续增加,尤其在花后8~10 d表达量迅速增加(图5-B),HeMYB113在果实发育过程中表达量持续降低。
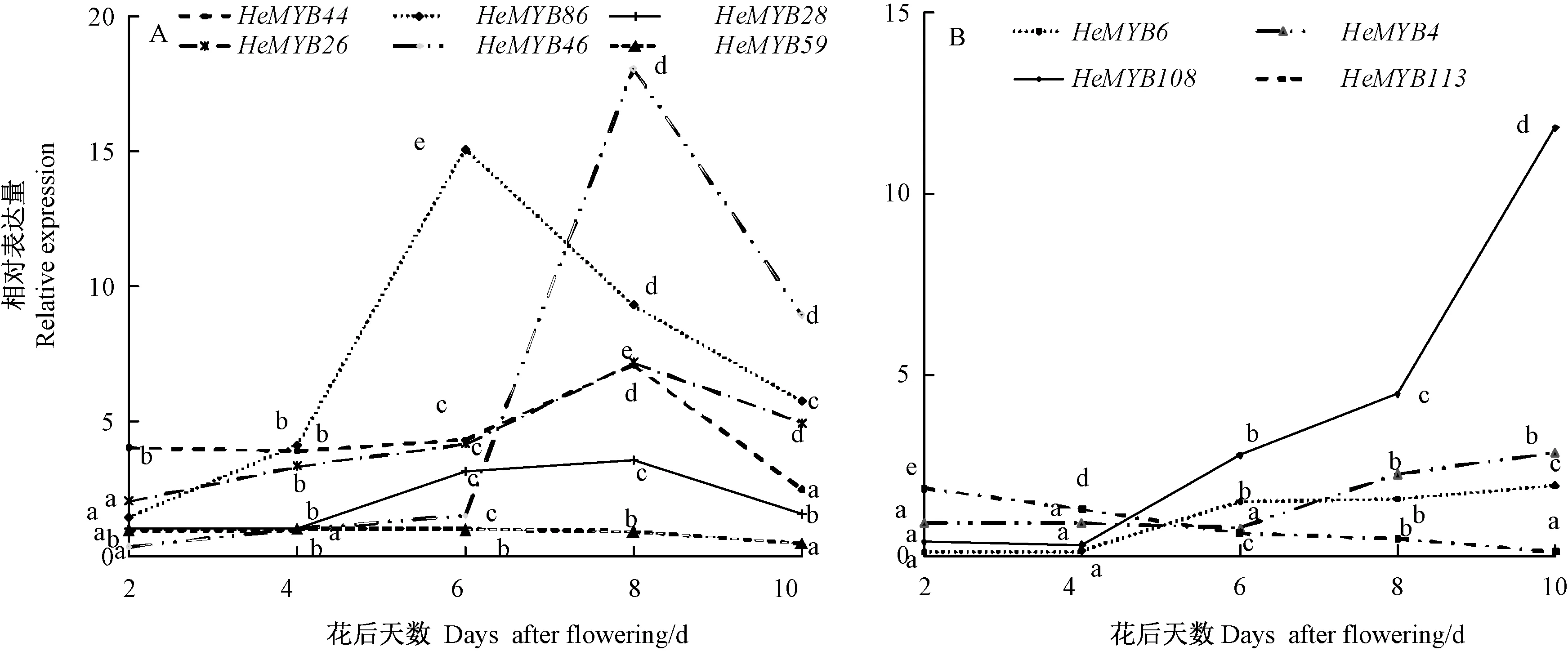
注:同基因不同小写字母表示不同花后天数间差异显著(P<0.05)。下同。
2.6.2 黄秋葵HeMYB基因家族在采后果实中的表达HeMYB46、HeMYB59的表达在采后0~4 d持续增强;HeMYB6、HeMYB44、HeMYB108、HeMYB113果实采后表达量先上升后下降;HeMYB4、HeMYB26、HeMYB28、HeMYB86果实采后0~1 d表达量快速下降,随后表达量平稳下降(图6)。
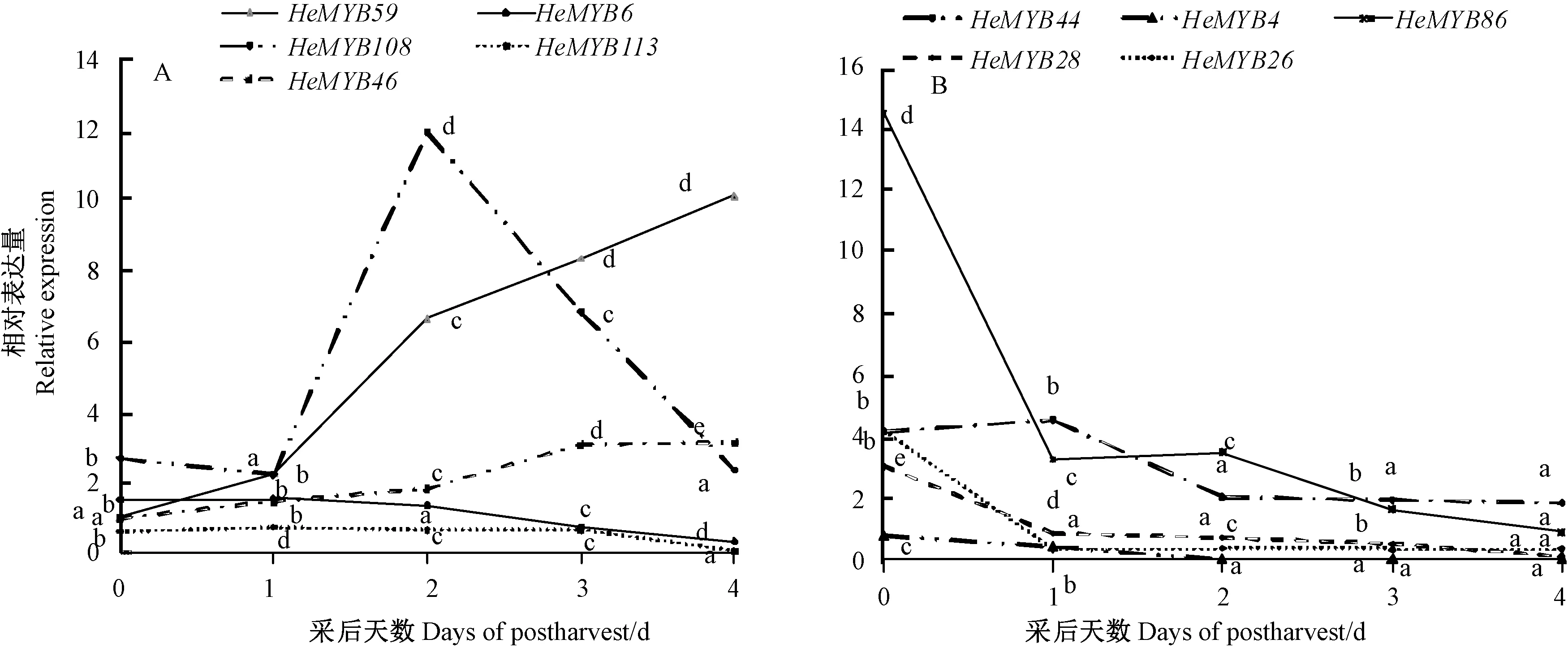
图6 黄秋葵果实采后MYB的表达
2.7 相关性分析
2.7.1 黄秋葵HeMYB基因家族RNA-seq数据库的表达与qRT-PCR表达的相关性分析 通过相关性分析发现,黄秋葵HeMYB基因家族RNA-seq数据库的表达与qRT-PCR表达相关性较好,相关系数R2为0.854 2(图7)。说明转录组RNA-seq测得HeMYB基因的表达量与应用qRT-PCR得到的表达值的变化趋势基本一致。
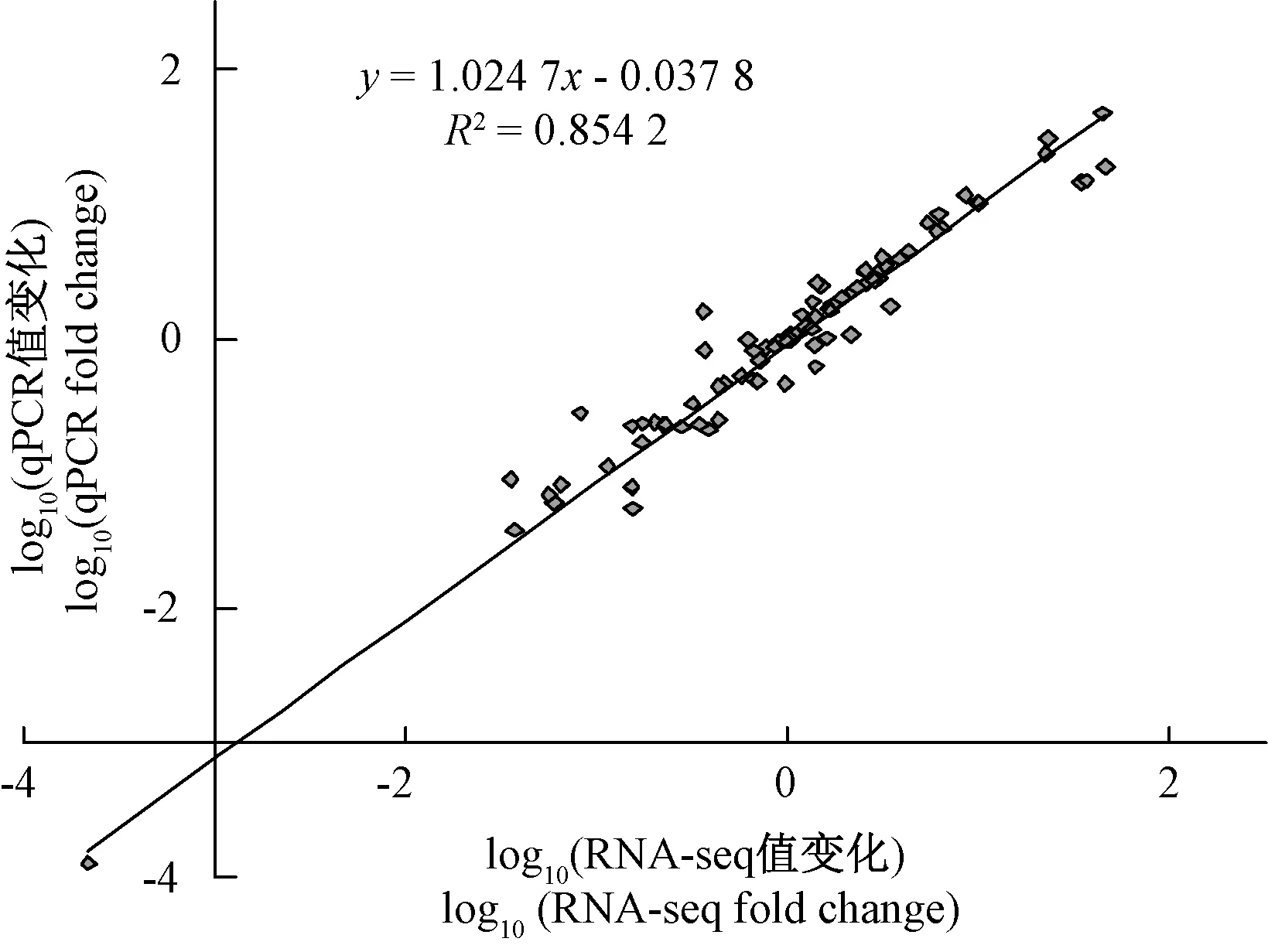
图7 黄秋葵HeMYB基因家族RNA-seq数据库的表达与qRT-PCR表达的相关性分析
2.7.2 黄秋葵HeMYB基因qRT-PCR表达与纤维素、木质素含量变化的相关性分析 相关性分析发现(表4),黄秋葵果实发育时期HeMYB46、HeMYB59、HeMYB86、HeMYB108与纤维素含量呈显著或极显著正相关,10个基因除HeMYB4、HeMYB28、HeMYB86外均与木质素含量呈显著或极显著相关;黄秋葵果实采后处理过程除HeMYB6、HeMYB26外,其余8个基因均与纤维素含量呈显著或极显著相关,HeMYB26、HeMYB108外其余8个基因均与木质素含量呈显著或极显著相关;HeMYB46、HeMYB86、HeMYB108表达量与纤维素含量呈极显著正相关,HeMYB46、HeMYB59均与木质素含量呈极显著相关,HeMYB4、HeMYB113与纤维素、木质素含量呈显著负相关。
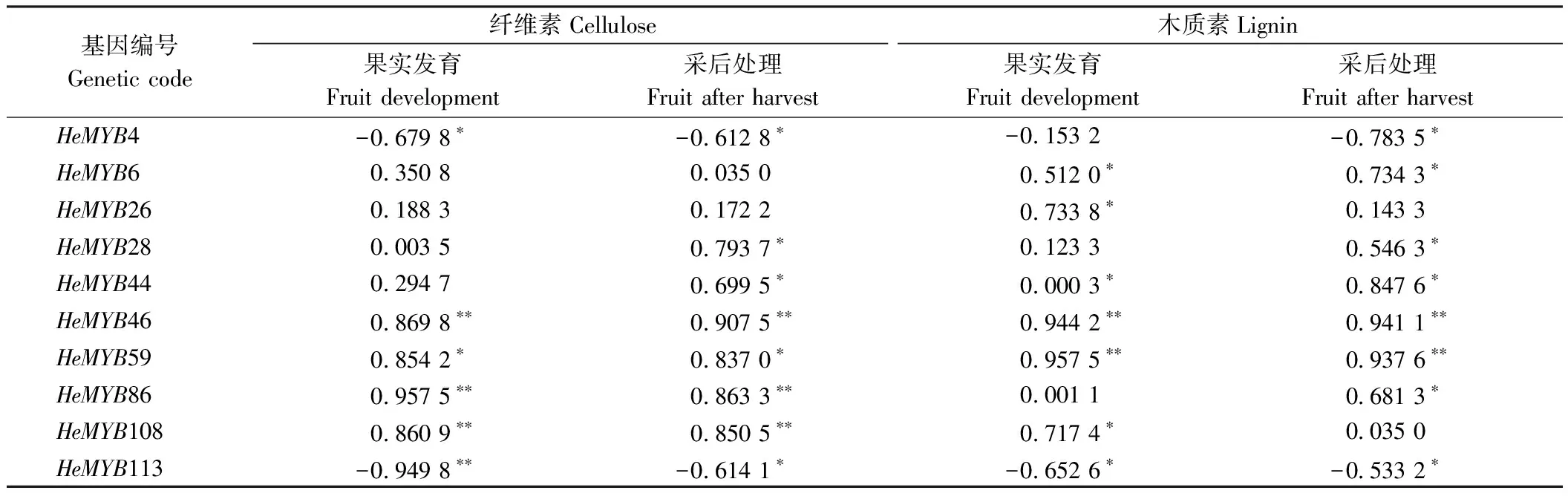
表4 黄秋葵转录因子MYB基因家族qRT-PCR表达量与纤维素含量变化的相关性分析
3 讨论
许多果实的老化由木质化和纤维化引起,其中木质素和纤维素的产生及调控与果实老化息息相关。黄秋葵果实花后8 d或采后常温贮存3 d就无法食用,此时果实纤维素和木质素均大量积累,细胞壁增厚明显[6]。植物MYB转录因子参与木质素和纤维素生物合成与沉积,在次生细胞壁形成中具有重要的调控作用。Yang等[26]研究发现,拟南芥AtMYB26基因可以调控花药内皮层次生细胞壁合成;过量表达AtMYB26基因,可以诱导次生壁合成相关基因的表达,导致次生壁异位沉积。AtMYB46/83、PtrMYB003和PtrMYB020可以激活纤维素、半纤维素和木质素的生物合成导致植株细胞次生壁异位沉积。AtMYB58与AtMYB63是木质素合成的特异调控基因,在次生壁加厚的纤维和导管中发现有上述基因的特异性表达,抑制其表达则会导致次生壁缺陷、木质素含量降低,而过量表达两者则会激活木质素合成基因的表达且伴随木质素异位沉积[27]。本研究表明,与次生壁形成相关的MYB转录因子具有较高的同源性,在不同物种间的结构和生物学功能较为保守。Du等[28]分析玉米、拟南芥等的MYB序列进化、结构及功能,发现有4个亚组的MYB与木质素合成以及次生壁增厚相关。Zhao等[29]对拟南芥、水稻、玉米、杨树以及柳枝稷MYB转录因子进行功能分组,得到一致的结论。MYB类转录因子成员之间同源性越高,其功能的相似程度越大,因此可以通过拟南芥中MYB类转录因子家族成员已有的功能研究,预测同一分支上其他MYB类转录因子家族成员的功能特性。本研究从黄秋葵果实中获得HeMYB4、HeMYB6、HeMYB26、HeMYB28、HeMYB44、HeMYB46、HeMYB59、HeMYB86、HeMY108、HeMYB113等10个MYB家族基因,10个MYB基因均定位于质膜上,进化分析发现与拟南芥等物种中参与纤维素和木质素合成的MYB蛋白亲缘关系较近,其中,黄秋葵中HeMYB46、HeMYB59、HeMYB86、HeMYB108与次生壁增厚相关的AtMYB58、AtMYB46、AtMYB63、AtMYB85、AtMYB26、PtrMYB020等基因同源性高,黄秋葵中HeMYB4、HeMYB113分别与负调控次生壁合成的AtMYB75、AtMYB68基因同源性高,暗示HeMYB46、HeMYB59、HeMYB86、HeMYB108在黄秋葵次生壁增厚及果实老化过程中起着重要作用。
MYB类转录因子基因家族,是一个多基因家族,不同的MYB家族成员在木质素和纤维素生物合成调控及果实老化中的作用可能不同。AtMYB4、AtMYB32、AtMYB58、AtMYB75负调控次生壁合成相关基因的表达,AtMYB32过量表达会造成花药的扭曲,影响花药细胞壁的形成[15],AtMYB75缺失,木质纤维和束间纤维的次生壁加厚增强,纤维素、木聚糖和木质素增加[30]。棉花(GossypiumherbaceumL.)GhMYB1和GhMYB25参与了毛状体的分化与发育,在烟草中过量表达的GhMYB25叶表皮毛分支增加,相关试验也证明GhMYB25在有纤维起始细胞中富集表达[31]。烟草中过量表达火炬松PtMYB4和苹果桉EgMYB2基因,使次生细胞壁加厚显著并且木质素异位沉积[16,19]。玉米(Zeamays)ZmMYB31通过增强CAD基因的表达,ZmMYB4则下调C4H和CAD的表达,进而影响木质素的积累,玉米ZmMYB31和ZmMYB4过量表达木质素含量降低[32];柳枝稷(Panicumvirgatum)PvMYB4基因与参与木质素生物合成途径的基因中AC元素结合,进而影响木质素的合成,过量表达的柳枝稷木质素含量显著下降[33]。本研究从黄秋葵果实中获得HeMYB4、HeMYB6、HeMYB26、HeMYB28、HeMYB44、HeMYB46、HeMYB59、HeMYB86、HeMY108、HeMYB113等10个MYB家族基因,利用实时荧光定量PCR分析黄秋葵MYB基因家族10个基因在果实发育过程、采后常温贮藏的表达,不同黄秋葵MYB基因家族呈现出不同的表达模式。对黄秋葵MYB基因家族表达与纤维素及木质素含量的相关性分析发现,HeMYB46、HeMYB86、HeMY108的表达量与纤维素含量呈极显著正相关,推测上述基因在黄秋葵果实衰老过程纤维素合成中起重要作用,HeMYB46、HeMYB59的表达量与木质素含量呈极显著正相关,推测其在木质素合成中起到重要调控作用。本研究初步明确黄秋葵MYB转录因子在黄秋葵老化过程中的作用,为黄秋葵的生产、分子育种等提供理论基础。
4 结论
本研究通过显微镜观察黄秋葵果实发育过程和采后贮藏期间细胞纤维素组织结构变化及纤维素含量变化,发现纤维素和木质素大量积累是黄秋葵果实老化的主要因素。通过对10个HeMYB基因的生物信息及qRT-PCR表达分析,推测在黄秋葵果实老化过程中,HeMYB46、HeMYB86、HeMYB108对纤维素合成起重要作用,HeMYB46、HeMYB59对木质素合成起重要调控作用;HeMYB46、HeMYB59、HeMYB86、HeMYB108在黄秋葵果实老化中起重要调控作用。

