新兴肿瘤免疫检查点的研究进展
林雅欣,鲁明骞
(三峡大学第一临床医学院肿瘤防治中心/宜昌市中心人民医院肿瘤科,湖北 宜昌 443000)
0 引言
中国是恶性肿瘤新发人数最多的国家同时也是因恶性肿瘤死亡人数最多的国家[1]。恶性肿瘤已经给各个国家造成经济及医疗上沉重的负担,早期的预防和有效治疗方案是重中之重。免疫治疗是继传统肿瘤治疗手段,如外科手术、放化疗、靶向治疗后的另一个重要的治疗突破口。相对于手术来说,可以弥补手术治疗后的容易复发转移,放化疗的毒副反应难以耐受等的不足,目前可以说是肿瘤治疗研究的风口。目前进入临床应用的免疫检查点抑制剂(ICIs)主要包括抗程序性细胞死亡蛋白-1/程序性细胞死亡配体-1(PD-1/PD-L1)和抗细胞毒性T淋巴细胞相关抗原-4(CTLA-4)单克隆抗体,这些免疫检查点抑制剂展现了某些特定癌肿良好的治疗前景。尽管ICIs在某些肿瘤中展现出令人信服的临床疗效,但大部分患者仍然表现出特征迥异的耐药性。目前,针对免疫检查点疗法的总体疗效仍不令人满意,总体有效率不高,继续探索新型免疫检查点是一个热门研究课题。最近研究发现了一些新的免疫检查靶点,如ITIM结构域(TIGIT)和LAG-3(淋巴细胞激活基因-3)、TIM-3(T细胞免疫球蛋白黏蛋白-3)等。上述新的免疫治疗靶点在临床前研究和临床试验中产生了令人欣喜的结果。本文主要对这些新的免疫检查点分子的研究进展进行汇报。
1 免疫检查点目前应用
过去的十余年见证了免疫疗法的快速进展,现在免疫治疗被认为是控制恶性肿瘤的关键策略。在以往临床运用中免疫检查点抑制剂(ICIs)[2]、嵌合抗原受体T细胞[3]、双特异性抗体[4]是最有前途的免疫治疗策略。2018年诺贝尔生理学和医学奖便颁布给该项发现。此外,陈列平博士对PD-L1(CD274,B7-H1)的发现做出了开创性的贡献[5]。现在,这些免疫检查点目标已经实现了从实验室到临床应用的转变。
CTLA-4是一种与CD28相关的细胞表面受体,与配体CD80(B7-1)和CD86(B7-2)结合。CTLA-4与CD80/CD86的结合通过降低CD28对CD80/CD86的利用率,向T细胞的激活传递负信号。Ipilimumab作为第一个临床应用的抗CTLA-4单克隆抗体[6],于2011年获得了治疗恶性黑色素瘤患者的使用许可[7]。属于CD28超家族的PD-1[8]与其配体PD-L1/L2的结合抑制T细胞的激活和功能,进而下调免疫反应发生发展[9,10]。Pembrolizumab是首个针对PD-1的人源化单克隆抗体[11]随后其治疗适应证不断扩大至多个癌种。但是值得注意的的是,目前临床应用的药物都是针对PD-1/PD-L1或CTLA-4的免疫检查点阻断剂。
2 新出现的免疫检查点
可以确定的是,肿瘤免疫治疗首先需要关注的问题是T细胞上相关免疫靶点。新的免疫检查点分子随着研究手段的不断进步也接二连三地得到验证。有证据表明,这些新发现的免疫检查点试验药物与当前临床使用的抗PD-1/L1和/或抗CTLA-4单克隆抗体组合使用,可以产生协同抑制效应。Huang RY等为了研究卵巢癌免疫治疗效果,通过建立小鼠模型来研究同时阻断LAG-3和PD-1通路会产生何种影响[12]。其结果显示,同时抑制LAG-3和PD-1通路会增强肿瘤微环境(TME)中的CD8肿瘤浸润性T细胞(TILs)和减少调节性T细胞(Tregs),使免疫治疗效果增强并抑制肿瘤进展。此外,抗PD-1单抗治疗小鼠时,检查发现LAG-3和CTLA-4的水平同时升高,但有趣的是,单独应用抗LAG-3单抗时小鼠体内的PD-1水平也会升高[13]。以上实验结果表明,单个免疫检查点靶点被阻断可能会导致TME中其他靶点受体代偿性上调。在肺癌[14]、黑色素瘤[15]中观察到TIM-3和PD-1之间有类似作用。这些实验室检查结果提示在不同类型的癌种中可观察到类似变化。以此为契机,后续的临床试验正在开展中。
3 淋巴细胞活化基因3 (Lymphocyte activation Gene-3,LAG-3)
1990年Triebel等就发现了LAG-3(CD223)[16],LAG-3基因与12号染色体上的CD4基因相邻,氨基酸序列的进一步分析显示,LAG-3基因与CD4基因的同源性约为20%[16]。成熟的LAG-3蛋白包括四个部分, 细胞质区、细胞外区、疏水区、跨膜区。由四个免疫球蛋白(IG)超家族样结构域(D1-D4)组成胞外区[17]。细胞膜外侧的D1结构域包含一个独特的短氨基酸序列,即所谓的“额外环”(图1)。与其他靶点不同的是,LAG-3的细胞质结构域有丝氨酸磷酸化位点、KIEELE基序和谷氨酸-脯氨酸重复序列三个保守结构域,LAG-3发挥抑制功能所必需的结构域是KIEELE序列[18]。KIEELE基序传递抑制信号,阻止T细胞进入复制周期,下调T细胞扩增能力[19]。金属蛋白酶(Metalloproteases)可以在胞膜近端D4结构域和跨膜结构域之间的连接肽内切割LAG-3,产生可溶性LAG-3(sLAG-3)[20]。一些研究表明,sLAG-3可以限制T细胞免疫反应的程度[21]。LAG-3通常在活化的CD4+和CD8+T细胞[16]、Tregs[22]、自然杀伤(NK)细胞[23]、B细胞[24]和浆细胞样树突状细胞(pDCs)[20]上表达。大量证据表明,LAG-3信号在辅助性T细胞1(Th1)的激活、增殖和细胞因子分泌中发挥负调节作用[25]。在肿瘤发生和进展过程中,恶性肿瘤细胞即利用这一途径逃避免疫监视。
目前根据重组sLAG-3分子与经辐照的肿瘤细胞联合应用可以抑制肿瘤生长的实验结果,早期临床工作主要集中在研制 sLAG-3-Ig[26]。IMP321(Eftilagimod alpha)最初是作为疫苗免疫佐剂开发的[27]。在转移性肾细胞癌(mRCC)患者中进行了首次Ⅰ期试验[28]。结果显示,与IMP321有关的不良事件(AEs)极少,而且IMP321增加了激活的CD8+T细胞亚群,这与肿瘤活性减少相关联。在IMMP321高剂量组(>6mg)中,8名患者中有7名病情稳定,而在低剂量组中,11名患者中只有3名病情稳定。IMP321单一疗法在癌症治疗中显示出合适的疗效,因此将该药物尝试与其他化疗药物联合使用。因此在转移性乳腺癌(MBC)[29]和晚期胰腺癌[30]中进行了另外两项临床试验。最终,前Ⅰ/Ⅱ期试验显示,在治疗结束有50%的患者达到客观反应,这与既往约25%的化疗反应率相比是明显有意义的[29]。此外,作者发现表达MHC Ⅱ类的APCs、NK细胞和CD8+T细胞群的绝对值和比例增加,这些亚群与抗肿瘤活性有关[29]。这一令人鼓舞的结果促使人们进一步开展Ⅱb期多中心临床试验,目前正在招募MBC患者[31]。遗憾的是,后来的Ⅰ期临床试验旨在评估IMP321和吉西他滨作为胰腺癌患者一线治疗的作用,但没有显示出有意义的客观反应[30]。目前IMP321与其他免疫疗法联合使用或作为癌症疫苗的佐剂的作用正在探索之中[32]。
Relatlimab,也被命名为BMS-986016,是首个针对LAG-3的商业化单克隆抗体[33]。许多临床前小鼠模型显示,PD-1/PD-L1阻断后,LAG-3或其他免疫检查点的上调是一种代偿机制[34]。这些数据引起了人们对联合治疗策略的进一步探索。Relatlimab的第一阶段临床试验于2013年开始[13]。该临床试验的目的是评估Relatlimab作为单一疗法的作用或与Nivolumab(抗PD-1抗体)在包括黑色素瘤,NSCLC和RCC在内的各种晚期恶性肿瘤患者中的疗效。在2017年ESMO大会上,研究人员公布了68名接受过免疫治疗的黑色素瘤患者的最新疗效和安全性结果。其中61名患者的ORR为11.5%,仅1名患者达CR,6名患者PR。值得注意的是,LAG-3表达高的患者中ORR更高≥1%,不良事件可耐受[35]。
4 T细胞免疫球蛋白黏蛋白 3(T cell immunoglobulin and mucin domain-3,TIM-3)
TIM-3是目前恶性肿瘤免疫治疗的另一个热门研究靶点,也可称为甲型肝炎病毒细胞受体2(HAVCR2),其呈现出一些独特的特征使其研究者兴趣大增。在2002年它首次被确定为一种在CD4+Th1和CD8+T细胞毒性1(Tc1)细胞上选择性表达的蛋白质[36]。但现在它通常被归类为类似于CTLA-4和PD-1的免疫检查点分子。基因组分析表明,TIM基因家族由位于人类染色体5q33.2上的三个基因组成,即TIM-1、TIM-3、TIM-4[37]。它属于免疫球蛋白超家族(Ig超家族),具有N-末端Ig可变区(IgV)样结构域、膜-近端粘蛋白样结构域、单一跨膜区和C-末端细胞质尾部(图1)。有N-连接的糖基化位点位于粘蛋白和跨膜之间[37]。TIM-3的表达在B细胞,调节性T细胞,自然杀伤细胞,树突状细胞,单核细胞和巨噬细胞中,由此可见其表达不局限于T细胞上。值得注意的是,作为同TIM-3的IgV结构域结合的可溶性配体的Galectin-9和HMGB1,他们之间的结合可以触发Th1细胞内钙离子流动,诱导细胞死亡[38]。此外,Kang等人的一项研究显示Galectin-9还可诱导结肠癌TIM-3CD8+T细胞的凋亡[39]。最重要的是TIM-3的高表达与实体恶性肿瘤的不良预后相关[40],越来越多的临床前模型已经通过调节TME和限制肿瘤生长,特别是与PD-1阻断相结合,验证了TIM-3阻断的治疗益处[41]。
迄今为止,至少有八种TIM-3拮抗性单克隆抗体在临床试验中注册,由Tesaro开发的新型IgG4抗TIM-3单克隆抗体TSR-022(Cobolimab)于2016年进入第一阶段临床试验。这项研究为评估TSR-022与TSR-042单用或联合治疗疗效,其结果已在2018年癌症免疫治疗学会(SITC)年会上发布[42]。研究提示大剂量的抗TIM-3抗体联用确实可以提高患者客观缓解率。MBG453是诺华生产的另一种抗TIM-3单克隆抗体。与TSR-022类似,首次临床试验旨在评估MBG453作为单一药物或与PDR001(抗PD-1单抗)联合应用于晚期恶性肿瘤患者的安全性和有效性。
5 T细胞免疫球蛋白和ITIM结构域(T cell immunoglobulin and ITIM domain,TIGIT)
2009年TIGIT被Yu等首次确定为抑制T细胞激活的免疫检查点[43]。随后,其他研究者也对其进行了描述,每个研究者均给出了不同的名称,包括WUCAM、Vstm 3和Vsig9。TIGIT的表达不同于TIM-3在许多细胞上均存在,其仅在淋巴细胞中表达,主要是T细胞亚群和NK细胞[44]。该蛋白质结构与TIM-3类似,也由胞外IgV区域、跨膜结构域和胞质尾区组成,该区域具有酪氨酸抑制基序(ITIM)(图1)。TIGIT与CD155(又称为PVR或Necl-5)和CD112(nectin-2,也称为PRR2或PVRL2)之间亲和力不同。nectin-3是否是TIGIT的另一个配体仍有疑问[44]。TIGIT通过与其他对应物CD266(DNAM-1)或CD96竞争来发挥其免疫抑制作用[45]。一些研究者报告,TIGIT与其他检查点受体(如PD-1和TIM-3)的联合应用可在抗肿瘤反应中发挥协同效应[46]。
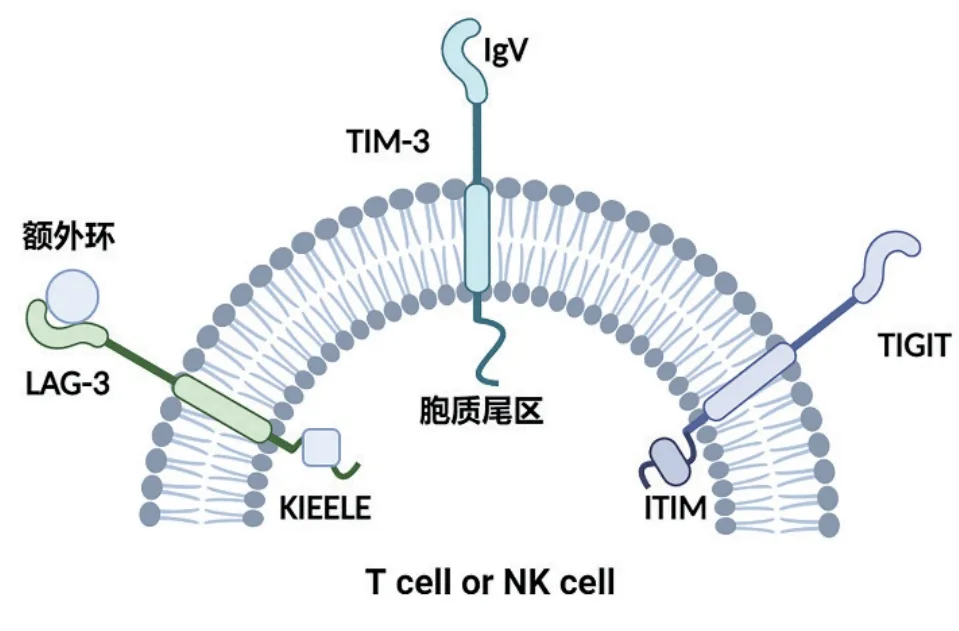
图1 LAG-3、TIM-3、TIGIT均有Ⅰ型跨膜糖蛋白,包括跨膜结构和胞外结构域、胞质尾区
基于目前的临床前结果,以TIGIT为靶点的癌症治疗策略吸引了许多制药公司的注意,特别是与抗PD-1/PD-L1抗体结合。目前默克公司开发的抗TIGIT药物MK-7684进入了一期临床试验[47]。第一阶段的早期数据是在2018年癌症免疫治疗学会年会上公布的。68名受试者被纳入研究,其中34名患者接受单一疗法,34名患者接受联合疗法。最后,在这两组中观察到1例PR和8例PR,疾病控制率分别为35%和47%。此外还有多项研究仍在进行当中。值得注意的是2022年5月11日,罗氏在其官网公布了三期临床试验Skyscraper-01的中期结果,抗TIGIT抗体tiragolumab联合PD-L1抑制剂对比Tecentriq单药一线治疗PD-L1高表达局部晚期或转移性非小细胞肺癌患者未达到PFS的共同主要终点。目前,另一个共同主要终点OS尚未成熟,需要完成下一阶段才能完成分析。这似乎预示TIGIT免疫疗法联合PD-L1一线治疗非小细胞治疗的试验阶段性失败。
6 展望
虽然有相当多的癌肿在治疗实践中提示了免疫治疗的强大疗效,但是在前列腺癌和结直肠癌中抗PD-1疗法并未改善患者的生存时间,这就强调了开发更多更有效的免疫治疗靶点的必要性。我们对免疫检查点通路的基本机制的理解促进了对免疫检查点在肿瘤发生发展中的认识。在过去的二十年里,确定免疫治疗靶点和开发新型抗癌治疗药物取得了重大进展。如前文所述,目前已探索出相当多的免疫检查点,某些靶点已被制药公司作为新的治疗靶点。目前的免疫治疗靶点的局限性已经开始展现,联合使用免疫疗法有望带来“1+1>2”临床疗效,实现抑制肿瘤生长的协同作用。尽管目前还未有任何药物被批准,我们还处于了解这些新的免疫机制早期阶段,为了使更多的候选药物转化到临床领域,并取得比目前免疫检查点抑制剂更大的成功,我们仍需更进一步的研究来评估它们的作用机制和有效性,以期对肿瘤患者提供更多治疗选择。

