赖氨酰氧化酶样蛋白4在人类恶性肿瘤发生与发展中的作用
普元倩, 余 敏, 熊 伟*
(1)大理大学基础医学院生物化学与分子生物学教研室, 云南 大理 671000; 2)云南省高校临床生物化学检验重点实验室, 云南 大理 671000;3)云南大学生命科学学院生物化学与分子生物学实验室, 昆明 650091)
赖氨酰氧化酶(lysyl oxidase, LOX)是一类分泌型铜依赖性胺氧化酶,具有催化弹性蛋白和胶原蛋白在细胞外基质(extracellular matrix, ECM)共价交联的作用。LOX催化ECM弹性蛋白和胶原蛋白中赖氨酸和羟赖氨酸残基的氧化脱氨基反应,产物形成分子内和分子间交联,这种分子间缩合将弹性蛋白或胶原蛋白的可溶性单体转化为细胞外基质中的不可溶性纤维,并能抵抗非特异性蛋白水解酶所引起的弹性蛋白分解和胶原蛋白的溶解,从而发挥稳定细胞外基质的作用[1, 2]。迄今为止,LOX家族共发现有 5 个成员,即 LOX和赖氨酰氧化酶样蛋白1~4(lysyl oxidase like 1-4, LOXL1-4)。其中,LOXL4 是最晚被发现的LOX家族成员,2001年Maki和Asuncion等2个不同的研究小组分别报道了LOXL4基因的完整cDNA序列, 并证明LOXL4是一种分泌型ECM蛋白质[3,4]。目前,已发现 LOX 家族成员在多种人类恶性肿瘤中表达异常[5-8],LOX 的高表达可造成胶原蛋白及弹性蛋白在细胞外过度交联,并可能与肿瘤的增殖、侵袭和转移有关。而对于 LOXL4 的研究发现,LOXL4表达水平与多种人类恶性肿瘤的发生发展密切相关,在不同类型肿瘤中发挥抑制肿瘤或促进肿瘤的双向调节作用。本文主要从LOXL4蛋白的结构、功能以及与人类恶性肿瘤发生发展的关系进行综述,以期为恶性肿瘤的临床诊断、治疗和筛选预后标志物提供理论基础和参考依据。
1 赖氨酰氧化酶样蛋白4基因和蛋白质的结构
LOXL4基因又被命名为LOXC,定位于10q24.2,包含17个外显子,全长cDNA大小为3 597 bp,包含2 271 bp的开放阅读框(Fig.1A)。LOXL4基因与LOX基因有62%的同源性,其mRNA在胰腺、睾丸和骨骼肌组织中呈高表达,在胎盘、肺、肝、脾、前列腺、卵巢和小肠中均有表达,而在心、脑、胸腺和结肠中表达较低[3,4]。Sebban等发现LOXL4基因在浆膜腔积液的转移性肿瘤中选择性剪接,产生2种剪接变异体splv-1和splv-2。对LOXL4 mRNA序列分析显示,外显子8和外显子9共同被翻译成一个功能单元并形成SRCR4[9]。这些变异体缺乏外显子9(splv-1)或同时缺乏外显子8和外显子9(splv-2),进而导致 SRCR4 的结构发生改变,影响LOXL4基因表达产物的功能,使其从肿瘤抑制因子转变为致癌因子(Fig.1A)。
LOXL4基因编码的蛋白质全长由756个氨基酸组成,分子量为84.5 kD。LOXL4蛋白N-末端的1~24个氨基酸是一段具有切割位点的信号肽[3,4,9]。LOXL4主要定位于细胞质和ECM,但也存在于细胞核[3,4,9]。LOXL4 由血管平滑肌细胞(vascular smooth muscle cells, VSMC)分泌,通过N-末端信号肽靶向输送到ECM中。LOXL4蛋白的C-末端区域含有所有LOX家族蛋白质都具有的LOX结构域,包含铜离子结合位点、赖氨酸酪氨酸酰基醌(lysine tyrosylquinone, LTQ)残基和细胞因子受体样(cytokine receptor-like, CRL)结构域,并且与它们的催化活性相关。LOXL4的这个结构域中酪氨酸残基(tyr-693)与赖氨酸残基(lys-638)一起形成赖氨酸酪氨酸酰醌辅助因子。LOXL4的N末端区域含有 4 个富含半胱氨酸结构域的清道夫受体 (scavenger receptor cysteine-rich domain, SRCR) (Fig.1B),它与LOXL2和LOXL3形成LOX蛋白质家族中的一个亚家族。其特征是存在4个SRCR结构域,而LOX和LOXL1不含SRCR。这些SRCR存在于多种分泌蛋白质和细胞表面蛋白质中,通过参与蛋白质间的相互作用来调节细胞黏附和细胞信号转导[10]。在人纤维肉瘤细胞HT-1080中表达的重组LOXL4被分泌到培养基中,未发生明显的蛋白质水解过程。研究表明,LOXL4会发生糖基化修饰,推测LOXL4在信号肽序列切割位点后出现了3个O-糖基化位点和2个N-糖基化位点[3](Fig.1B)。
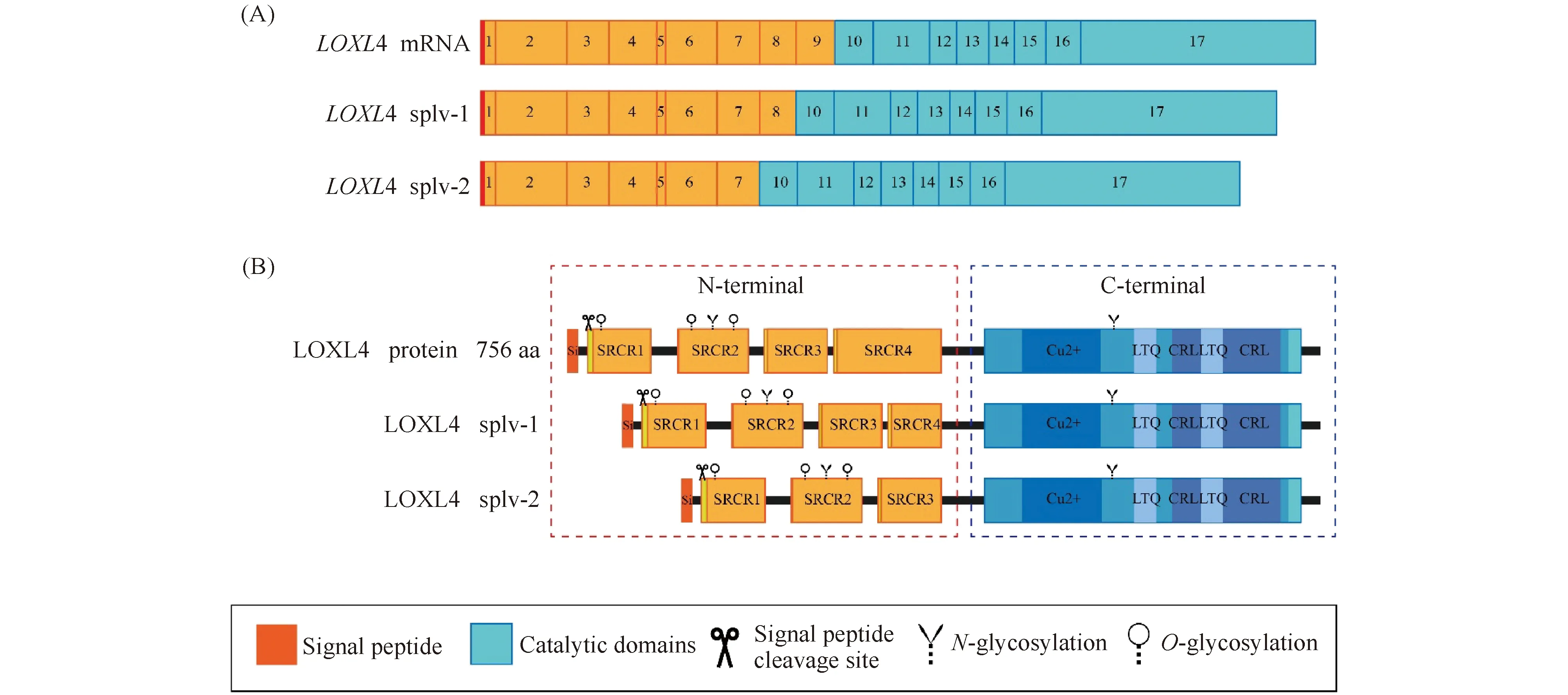
Fig.1 Schematic diagram of the exon structure and protein encoded by the LOXL4 gene (A) LOXL4 exon structure, 1-17: exon 1-exon 17; (B) The LOXL4 protein
2 赖氨酰氧化酶样蛋白4的促癌或抑癌功能
LOXL4 作为 LOX 蛋白质家族的新成员,催化细胞外基质中胶原蛋白和弹性蛋白赖氨酸衍生交联的形成,调节结缔组织结构的完整性和拉伸强度。同时,LOXL4 具有促进肿瘤或抑制肿瘤发生发展,调控细胞发育和衰老,诱导细胞趋化性等作用[11]。LOXL4 功能的变化具有组织特异性,在不同类型实体肿瘤中具有不同的作用。LOXL4通过多种不同的机制,调控信号转导通路,参与多种肿瘤的发生与发展。
2.1 LOXL4的促癌功能
LOXL4基因的选择性剪接是癌症发生和进展的标志。LOXL4基因的2种剪接变异体splv-1和splv-2对体外细胞转移潜能和体内肿瘤进展都有积极影响。相反,全长LOXL4不会促进肿瘤转移,甚至被认为可能是肿瘤抑制因子。此外,Sebban等还发现,LOXL4可能是富含丝氨酸/精氨酸的剪接因子1(serine/arginine-rich splicing factor 1, SRSF1)和核内不均一RNA核糖核蛋白A1(heterogeneous nuclear ribonucleoprotein A1, hnRNP A1)这2种致癌剪接因子的剪接靶点。LOXL4剪接变异体splv-1和splv-2对体外培养的肿瘤细胞具有促转移作用,同时影响体内肿瘤进展和侵袭性[9,12]。
外泌体(exosome)介导分泌的LOXL4促进肿瘤细胞的侵袭和转移。TGF-β是肿瘤细胞中LOXL4表达的关键调节因子,它可以诱导LOXL4的表达。肿瘤细胞分泌的外泌体在细胞之间转移LOXL4,LOXL4通过氧化其底物的赖氨酸残基产生过氧化氢(H2O2),H2O2的存在可增加Src和FAK的磷酸化,直接激活FAK/Src信号通路,并通过其催化活性促进细胞基质黏附和细胞迁移[13]。LOXL4 还能通过外泌体促进自身的迁移及上皮细胞的增殖、迁移和血管的形成,导致肿瘤侵袭和转移[13]。外泌体介导的LOXL4会通过激活PI3K/Akt信号通路来促进肿瘤细胞的增殖和免疫逃逸[14]。LOXL4也是TGF-β1信号传导的靶点,TGF-β1通过Smad和JunB/Fra2诱导血管内皮细胞中LOXL4的表达,促进内皮细胞迁移和与纤维化相关的血管形成,参与血管基质重塑[15]。此外,LOXL4及其下游信号级联在肿瘤发生和肿瘤后续进展的免疫抑制微环境中发挥重要作用。LOXL4的这种作用可能通过塑造巨噬细胞来实现的,一方面,招募更多的浸润巨噬细胞;另一方面,调节巨噬细胞STAT1/STAT3介导的呈递抑制性检查点分子程序性死亡配体 1(programmed death ligand 1, PD-L1),进而削弱细胞毒性T细胞介导的免疫监视[16](Fig.2)。
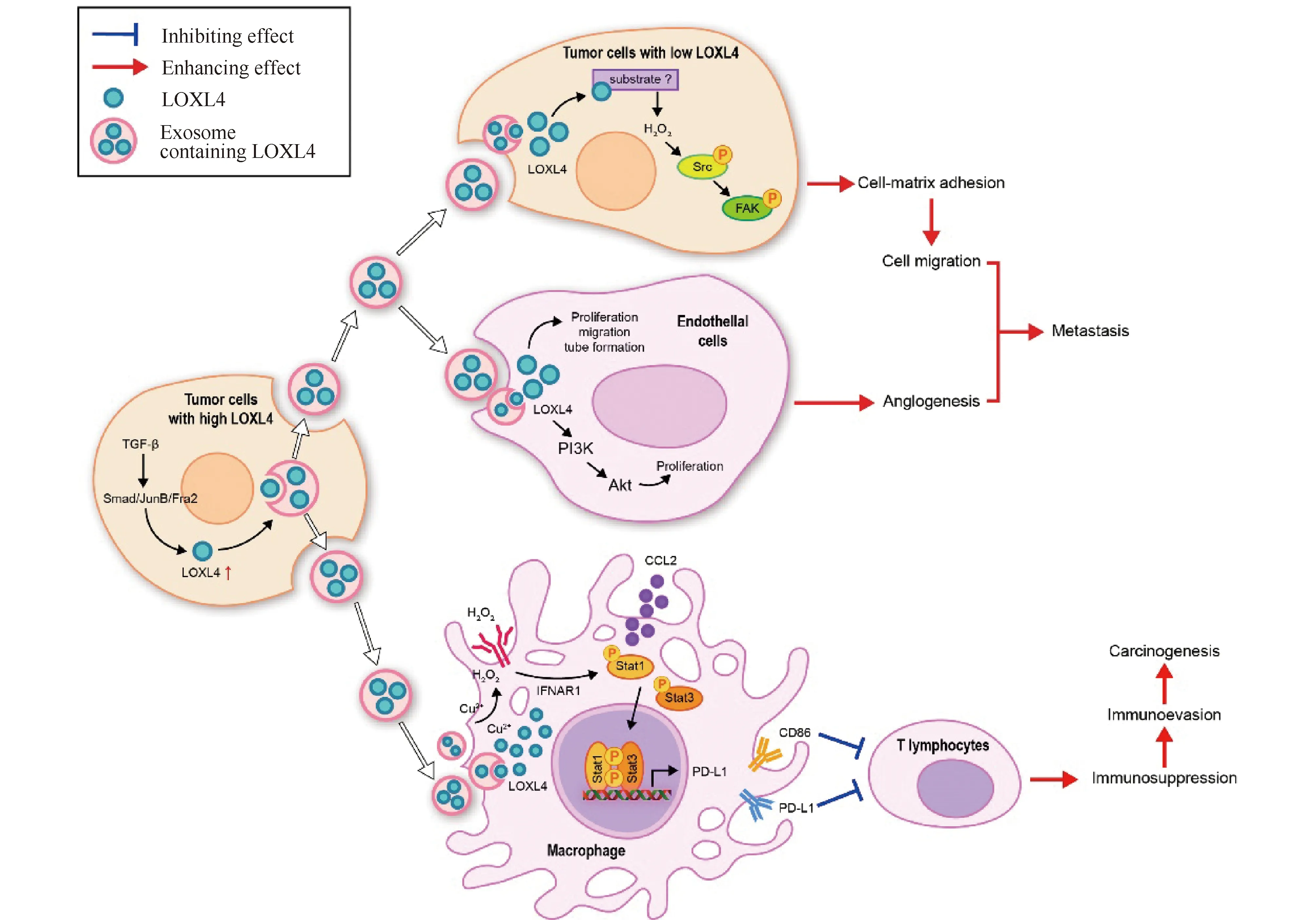
Fig.2 The possible mechanism of LOXL4 in promoting the pathogenesis and development of human malignant tumors LOXL4 in tumor cell exosomes promotes cell matrix adhesion and cell migration by activating the FAK/Src pathway, which is dependent on its amine oxidase activity through a hydrogen peroxide-mediated mechanism. Exosome-mediated LOXL4 can also promote tumor cell proliferation and immune escape by activating the PI3K/Akt signaling pathway. LOXL4 can be transported to macrophages via exosomes in tumor cells, and further activate the immunosuppression function of cells and the expression of programmed death ligand 1 (PD-L1) via STAT1- and STAT3-mediated signaling pathways, and then trigger the immunosuppressive function of macrophages and promote the immune escape of tumor cells
2.2 LOXL4的抑癌功能
LOXL4还能发挥抑癌功能。研究表明,LOXL4是一种新的p53激活调节因子。Shao等研究发现,5-氮杂胞苷(5-azacytidine, 5-aza-CR)诱导LOXL4表达上调,随后LOXL4通过其低等电点区域与p53的基本结构域结合。LOXL4和p53之间的相互作用诱导受损p53的重新激活,导致细胞死亡和肿瘤消退[17]。LOXL4基因过表达可以拮抗Ras基因激活细胞外信号调节激酶(extracellular regulated protein kinases, ERK)的信号转导通路。在膀胱癌中,LOXL4基因可以作为肿瘤抑制基因,通过抑制Ras/ERK信号转导通路发挥抗肿瘤功能[18](Fig.3)。
3 赖氨酰氧化酶样蛋白4在人类恶性肿瘤发生和发展中的作用
Northern印迹杂交分析显示,LOXL4 mRNA在很多正常组织中均有表达,而在各种恶性肿瘤细胞系和肿瘤组织中呈现不同的表达[3]。大多数的研究结果表明,与对应的正常组织相比,LOXL4 在肝癌、胃癌、乳腺癌、宫颈癌、头颈鳞癌、食管癌和结直肠癌中表达上调[19-23],而在人类膀胱癌和肺癌中表达下调并抑制肿瘤的生长[18,24],表明LOXL4在不同类型的人类恶性肿瘤中具有抑癌或促癌的双向作用(Table 1)。
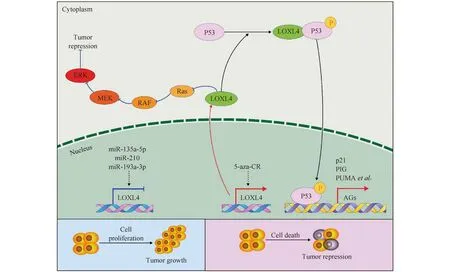
Fig.3 The possible mechanism of LOXL4 in inhibiting tumorigenesis and development of human malignant tumors LOXL4 exerts tumor suppressive function by activating p53 and inhibiting the Ras/ERK signaling transduction pathway

Table 1 The dual role of LOXL4 in various types of human cancers
3.1 LOXL4在肝癌发生和发展中的作用
原发性肝癌是全球最常见的恶性肿瘤之一,其恶性程度高、发展迅速和治疗困难,长期以来都是医学界研究的重大难题。Li等研究发现[19],LOXL4 在肝癌组织中高表达,LOXL4 的表达上调与肿瘤分化程度、血管侵袭和TNM分期显著相关,而与性别、年龄、肝硬化、肿瘤体积、病理分级及临床分期之间无相关性。该研究还进一步分析了 LOXL4 与肝癌患者预后的关系,结果表明,LOXL4 高表达的患者预后不良。通过体外研究过表达或干扰LOXL4基因,观察到LOXL4过表达能明显促进肝癌细胞的侵袭和迁移,而LOXL4的敲低在体外抑制了肝癌细胞的侵袭和迁移。在体内,LOXL4的过表达促进了肝癌的肝内和肺转移,而对细胞的增殖无明显的影响[19]。进一步检测LOXL4对FAK/Src信号通路的调控作用,结果显示,LOXL4可导致肝癌细胞 FAK/Src信号通路的激活,并增强肿瘤细胞与 ECM 的黏附。通过ExoCarta数据库分析、细胞免疫荧光、扫描电镜和免疫印迹方法,证实了 LOXL4 出现在外泌体中。LOXL4 可通过外泌体促进自身的迁移及人脐静脉内皮细胞(HUVEC)的增殖、迁移和血管形成,导致肿瘤侵袭和转移[13]。Tan 等研究表明,LOXL4通过巨噬细胞的外源性作用调节肝癌细胞的生长和进展。肿瘤细胞中的 LOXL4可以经外泌体转运至巨噬细胞,进一步通过STAT1和STAT3介导的信号通路激活细胞免疫抑制功能和激活 PD-L1表达,触发巨噬细胞的免疫抑制功能,促进肿瘤细胞的免疫逃逸,导致恶性肿瘤的发生[16]。然而,一些研究持有不同的观点。Shao 等研究发现,5-aza-CR可上调LOXL4的表达,导致LOXL4与野生型p53结合,从而增加p53蛋白第15位丝氨酸位点的磷酸化,导致野生型p53蛋白被激活[17]。LOXL4-p53相互作用的增强在体外和体内都显著降低了肿瘤细胞的生长。Kim等研究证明[25],LOXL4有抑制转化生长因子β1(TGF-β1)的作用。LOXL4通过抑制ECM相关基因和基质金属蛋白酶-2(matrix metalloproteinase 2, MMP2)活性,负调控肝癌细胞株PLC/PRF/5的增殖和侵袭,表明LOXL4作为肿瘤抑制因子在肝癌中是通过杂合子丢失和甲基化作用失活来实现的。Tian等对28对肝癌标本进行LOXL4 mRNA表达分析,用组织芯片对298例肝癌患者进行LOXL4免疫组化染色分析,并评价LOXL4的预后和诊断价值。结果表明,LOXL4在肝癌组织中显著下调,肝细胞癌组织中LOXL4 mRNA表达明显低于癌旁组织[26]。LOXL4表达下调与根治性切除术后较高的复发率和较低的生存率相关,这与之前的研究结果相反。近年来,更多的证据表明表观遗传学改变是导致癌症中抑癌基因失活的重要分子机制。LOXL4在肝癌中是否具有抑癌作用仍需要进一步研究。综上所述,LOXL4 在肝癌的侵袭转移中发挥重要作用,也是一种新的调节因子,有助于肝癌p53的激活,并且LOXL4在肝癌发生过程中促进免疫抑制微环境的作用,这些功能提示LOXL4可能成为肝癌新的诊断标志物和治疗靶点。
3.2 LOXL4在肺癌发生和发展中的作用
在全球所有癌症中,肺癌是第二常见的癌症,其发病率仅次于乳腺癌,但死亡率位居全球第一[27]。Zhang 等的研究表明,miR-135a-5p在肺癌细胞中显著上调,miR-135a-5p的沉默能够抑制肺癌的进展。LOXL4基因是miR-135a-5p的作用靶点之一。在裸鼠异种移植瘤模型中,miR-135a-5p通过抑制LOXL4基因表达而促进肺癌的进展[28]。Xie等研究发现,相较于人正常肺上皮细胞BEAS‐2B,miR-210在肺腺癌细胞A549和H1650中显著上调,促进细胞的增殖、迁移和侵袭。LOXL4基因作为miR-210的下游靶基因,miR-210的过表达可以抑制A549和H1650细胞中LOXL4 mRNA的表达。在以上2种细胞中,通过siRNA敲低LOXL4基因的表达成功逆转了miR-210抑制剂对肺腺癌的抑制作用[24]。因此,LOXL4在肺癌中发挥抑制肿瘤的作用,提示LOXL4可能为肺癌的诊疗研究提供了一个新的视角。
3.3 LOXL4在胃癌发生和发展中的作用
胃癌是是世界上最常见的胃肠道肿瘤之一,也是全球范围内癌症死亡的第四大原因[27]。Li等研究表明,LOXL4在胃癌组织中相对于配对的非肿瘤组织表达上调,这种过表达与肿瘤浸润程度、肿瘤大小、淋巴结转移和 TNM分期呈正相关,并可导致胃癌患者较低的总生存率(overall survival, OS)。LOXL4过表达在体外对胃癌细胞增殖、迁移和侵袭有促进作用,而敲低LOXL4表达对胃癌细胞则能抑制细胞增殖、迁移和侵袭[19]。此外,重组人LOXL4蛋白也能促进胃癌细胞的增殖和迁移,并通过激活FAK/Src通路,增强细胞外基质黏附[19]。另有研究表明,LOXL1、LOXL3和LOXL4蛋白质的表达与肿瘤浸润、淋巴结转移、淋巴管和静脉侵犯有关。LOXL1、LOXL3 或 LOXL4 阳性表达患者的总生存率低于LOXL4阴性表达的患者。LOXL3和LOXL4 mRNA在具有高侵袭能力的弥漫型胃癌细胞中显著高表达。TGF-β 能够降低 LOXL1 表达并增加 LOXL3 和 LOXL4 的表达[29]。因此,LOXL4可能作为胃癌潜在的独立预后标志物和治疗靶点。
3.4 LOXL4在膀胱癌发生和发展中的作用
膀胱癌(bladder cancer, BCa)是全球男性第二常见的癌症类型,因其化疗耐药,手术后容易复发,被认为是治疗最昂贵和最难控制的癌症类型之一。Wu 等研究发现,LOXL4基因在人类膀胱癌细胞中经常发生沉默,并且这种沉默主要与启动子甲基化有关[18]。甲基化是导致膀胱癌中LOXL4表达缺失的主要原因。在膀胱癌中,LOXL4基因存在体细胞突变和多态性,这些突变和多态性聚集在编码SRCR4结构域的外显子8中。LOXL4基因在人类膀胱癌细胞中的过表达会导致细胞集落形成显著减少。研究表明,LOXL4在膀胱癌中可以作为抑癌基因,通过抑制Ras/ERK信号通路发挥作用[18]。Deng 等的研究发现,miR-193a-3p通过抑制LOXL4基因(miR-193a-3p的直接靶点)促进膀胱癌多药耐药表型。LOXL4介导miR-193a-3p对BCa化疗耐药的作用主要通过其对氧化应激途径的作用来实现。LOXL4水平与BCa耐药中氧化应激通路活性呈负相关[30]。杨宗珂等通过采用RT-PCR方法检测 58 例膀胱癌组织、12例对照膀胱组织LOXL4 mRNA的表达及其与临床分期、病理分级的关系。研究发现,膀胱癌组LOXL4 mRNA表达水平明显低于正常对照组,LOXL4 mRNA的表达与膀胱癌的临床分期和病理分级呈负相[31]。LOXL4 基因可以作为预测膀胱癌进展的一个新指标。同时,LOXL4 属于甲基化基因,还可用于膀胱癌诊断的潜在 DNA 标记,有助于癌症的早期发现[31]。
3.5 LOXL4在乳腺癌发生和发展中的作用
乳腺癌是女性中最常见的恶性肿瘤。Yin等研究发现,EZH2促进了LOXL4的表达,EZH2介导的miR-29b或miR-30d的表观遗传沉默重编程了LOXL4的表达,从而影响乳腺癌进展过程中的细胞增殖和转移。研究明确了一个重要的转录轴,由EZH2、miR-29b/miR-30d和LOXL4组成,它们通过调节巨噬细胞的活化参与了乳腺癌的发生。抑制LOXL4或EZH2或miR-29b/miR-30d的过表达,可以降低乳腺癌细胞在体内外的增殖、迁移和转移。LOXL4被鉴定为miR-29b和miR-30d的直接靶点。抑制EZH2可降低乳腺癌细胞中LOXL4的表达。EZH2复合物在miR-29b和miR-30d启动子处聚合以抑制其表达。人乳腺癌标本的免疫组化分析和小鼠肿瘤浸润巨噬细胞的流式细胞术分析显示,EZH2与LOXL4表达和巨噬细胞浸润呈正相关。证实了EZH2-miR-29b/miR-30d-LOXL4信号通路调控乳腺癌巨噬细胞浸润和胶原重塑,参与了乳腺癌的发生,提示表观遗传调控是通过控制巨噬细胞活化来治疗乳腺癌的一个潜在靶点。miR-29b和miR-30d的过表达抑制LOXL4基因的表达,进而负调控乳腺癌细胞的增殖和迁移,抑制肿瘤发生和转移[20]。缺氧是LOX蛋白质家族的主要调节因素。Semenza等报道,当不同的转移性人类乳腺癌细胞系缺氧时,LOXL4以缺氧诱导因子(hypoxia-inducible factor, HIF)依赖的方式表达。相较于配对的癌旁组织,LOXL4在不同类型的原发性人类乳腺癌中也呈现高表达。在缺氧诱导LOX和LOXL4表达的MDA-MB-231细胞中,HIF-1α和HIF-2α基因敲除或同时阻断缺氧诱导的LOX和LOXL4表达及体外胶原重塑,阻断荷瘤小鼠肺胶原重塑和骨髓树突状细胞(bone marrow dendritic cell, BMDC)募集,这与抑制LOX或LOXL4表达的效果相似。这表明缺氧可诱导不同乳腺癌细胞系中LOX家族各成员的表达,但HIF-1α在这些细胞系中的抑制作用足以显著抑制LOX家族成员的表达,抑制转移生态位的形成和随后乳腺癌向肺部的转移[32]。Choi等研究表明,LOXL4在MDA-MB-231细胞中的表达比其他类型的人类乳腺癌细胞高。在MDA-MB-231乳腺癌细胞异种移植模型中,LOXL4表达的下调促进了原发性肿瘤生长和肺转移。肿瘤的生长和转移的进展伴随着胶原的合成、沉积和结构的改变,特别是纤维束厚度的增加。此外,还发现LOXL4低表达与乳腺癌患者总体生存率较低相关。这种相关性在三阴性乳腺癌(triple negative breast cancer, TNBC)患者中最强。检测shRNA介导的LOXL4基因敲低对MDA-MB-231细胞的影响,发现LOXL4的敲低促进了细胞的迁移和侵袭能力。The BreastMark网站公共数据库分析发现,LOXL4的低表达也与乳腺癌患者的较低OS相关,这表明LOXL4的表达可能是乳腺癌的一个有用的预后标志物。低LOXL4和高IV型胶原表达的TNBC患者的OS最差。这些结果表明,LOXL4的低表达通过诱导胶原合成、沉积和结构改变导致细胞外基质重塑。这些改变反过来促进肿瘤生长和转移,并与TNBC的不良临床结局相关[33]。这些发现与先前的报道不一致,即高LOXL4 mRNA水平可能促进乳腺癌的肿瘤发生。在细胞系和异种移植模型中获得的看似矛盾的结果的解释仍然不清楚。可能是由于使用了不同的乳腺癌肺转移模型,以及宿主小鼠肿瘤微环境的差异。因此,LOXL4的作用可能取决于不同类型乳腺癌的异质性特征,仍需要进一步阐明LOXL4在乳腺癌各个亚型中的不同作用。
3.6 LOXL4在宫颈癌发生和发展中的作用
宫颈癌是发生于子宫颈上皮,发生率仅次于乳腺癌的妇科恶性肿瘤。王秀萍等研究发现,LOXL4 mRNA在3种人宫颈癌细胞株中存在不同程度的表达,蛋白质翻译水平与mRNA基因表达一致,以HeLa细胞表达为最高,ME180细胞次之,HCC94 细胞表达最低。以上研究提示,LOXL4基因表达可能与宫颈癌细胞的侵袭和迁移有关[21,34]。
3.7 LOXL4在头颈癌发生和发展中的作用
头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)是全球常见的癌症之一,几乎95%的肿瘤起源于上呼吸道的粘膜鳞状上皮。Gorogh等研究结果表明,与正常鳞状上皮细胞和组织相比,LOXL4 mRNA和蛋白质在HNSCC细胞和组织中均呈过表达。LOXL4表达水平与局部淋巴结转移与原发肿瘤类型和更高肿瘤分期之间呈显著正相关。免疫细胞化学检测显示,在HNSCC细胞中,LOXL4的过表达和mRNA转录增加相关。荧光原位杂交(FISH)显示,HNSCC细胞系在染色体10q24上的LOXL4基因位点拷贝数显著增加。除了HNSCC中的基因扩增外,LOXL4基因可能通过其启动子中CpG岛的去甲基化而上调。这些结果提示,LOXL4在侵袭性头颈癌的分子发病机制中发挥功能作用[22]。HNSCC中淋巴结转移的数量增加与LOXL4的高表达相关,LOXL4与肿瘤细胞扩散、疾病进展和恶性潜能增加相关。由于淋巴结转移是HNSCC临床进程的主要决定因素之一,除了原发性肿瘤中LOXL4的表达外,LOXL4还具有潜在的预后意义。Scola等研究表明,LOXL4可作为原发性和转移性头颈癌的选择性分子标记物[35]。Holtmeier等研究证明,LOXL4基因在HNSCC中从头转录,但在正常鳞状上皮细胞中不转录。研究中选取LOXL4基因转录起始位点上游-960到-1约959 bp核苷酸序列作为连续启动子区域,分析确定了几种转录因子的结合位点。含有特定启动子区域和一致结合位点的启动子结构在HNSCC细胞中显示出显著增加的报告基因活性,但在瞬时共表达实验中,在正常上皮细胞中未见增加。在2种细胞类型中,其中一些结构的活性谱相似,表明HNSCC细胞中基本转录调控机制的元件保持完整。DNA结合研究表明,与正常上皮细胞相比,HNSCC细胞的核提取物对TATA(-25)和SP1(-181)位点的结合活性增加,表明这些转录因子参与HNSCC中LOXL4基因表达的上调[36]。Gorogh等的研究中,用LOXL4特异性肽免疫的Balb/c小鼠脾细胞融合产生的单克隆抗体(mAb)对15株与LOXL4过表达相关的HNSCC细胞株进行治疗效果评估。在异种移植实验中,使用41只严重联合免疫缺陷(SCID)小鼠分析LOXL4单克隆抗体介导的肿瘤消退。结果表明,LOXL4单抗具有强大的抗肿瘤活性,并表明其适合作为治疗性免疫制剂,适用于LOXL4基因肿瘤特异性表达上调的HNSCC[37]。Weise等的研究数据表明,LOXL4在HNSCC诊疗中既是肿瘤标记物又是治疗靶点。值得一提的是,除了LOXL4基因的诊断价值外,另有研究表明,表达LOXL4的基因工程树突状细胞能刺激T细胞,增加抗肿瘤细胞因子干扰素-γ(IFNγ)的分泌,这些树突状细胞可用作治疗HNSCC患者的疫苗接种策略,该策略适用于具有肿瘤特异性LOXL4上调的癌症患者[38]。总之,LOXL4在HNSCC中具有促癌作用。
3.8 LOXL4在食管鳞状细胞癌发生和发展中的作用
食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)是全球第七大最常见的恶性肿瘤,也是最常见的致命癌症。Du等研究表明,LOXL4在ESCC中上调,Kaplan-Meier分析证实LOXL4的高表达与患者的低存活率相关。LOXL4表达水平较低的ESCC患者生存期较长[23]。Xie等的研究检测了7种ESCC细胞系和15对ESCC临床组织样本中LOXL4的mRNA 表达。结果表明,即使手术根治性切除后,LOXL4 的表达上调也与ESCC患者的不良预后相关。利用生物信息学分析,确定LOXL4的表达与II型胶原蛋白α1链(collagen type II alpha 1, COL2A1)和色斑3-9 抑制因子同源物1(suppressor of variegation 3-9 homolog 1, SUV39H1)的表达相关。LOXL4、SUV39H1和COL2A1是ESCC患者的潜在生物标志物,并且这些基因的高表达均与ESCC患者的不良预后相关。基于蛋白质-蛋白质相互作用网络的分析,描述了 LOXL4 及其相关蛋白质的表达及其功能,表明 LOXL4 及其相关蛋白质可能在 ESCC 的发生和进展中发挥重要作用[39]。孟芳等的研究结果表明,miR-193a-3p可能通过下调LOXL4的表达来增加食管鳞癌的放射耐受。这不仅有助于理解食管癌放疗耐受机制,而且对食管癌临床个体化放射及诊断具有重要意义。miR-193a-3p和LOXL4可能成为食管癌放射耐受和放射敏感的一个潜在标志物[40]。
3.9 LOXL4在结直肠癌发生和发展中的作用
结直肠癌是常见的恶性肿瘤之一,包括直肠癌和结肠癌。Kim等对104 例结直肠癌患者的肿瘤组织和配对的正常组织标本进行了实时qPCR分析。LOXL4基因的表达与肿瘤位置、分期、生长类型或分化状态无统计学相关性。然而,LOXL4在结肠直肠癌中的表达上调与无淋巴血管浸润显著相关。研究表明,肿瘤内部或周围的氧分压可能是 LOXL4差异表达的重要调节因子,LOXL4基因表达上调可能与结直肠癌侵袭性和转移潜力增加有关[41]。Barker等研究表明,LOXL4基因在结直肠组织中表达上调,且能显著促进结直肠癌患者的放疗和化疗敏感性[42]。
4 问题与展望
LOXL4作为LOX蛋白质家族的新成员,参与人类恶性肿瘤的发生发展,在不同的人类癌症类型中表现出抑制肿瘤或促进肿瘤的双向作用。LOXL4在多种人类恶性肿瘤中高表达,通过肿瘤细胞分泌的外泌体在细胞间转移LOXL4,激活Src/FAK信号通路,促进肿瘤细胞的侵袭和转移,并与恶性肿瘤的预后不良相关。LOXL4基因甲基化在原发性肿瘤细胞中与表达缺失有关,甲基化LOXL4基因是潜在候选肿瘤抑制基因,提示LOXL4 基因可被作为肿瘤抑癌基因并被用于基因治疗的新靶点,有助于早期发现癌症,LOXL4基因可作为癌症分期、分级及复发的辅助判断或预测指标,也是癌症放射耐受和敏感性的一个潜在标志物。此外,LOXL4抑制剂的发展对LOXL4基因过表达的癌症患者有益。LOXL4基因靶向分子治疗可能会改善癌症患者的预后。值得一提的是,为了全面理解LOXL4在肿瘤发生和发展中的作用,需要解决以下几个问题:(1)目前,大部分的研究是针对肿瘤细胞系中LOXL4基因的下游靶点进行剖析,但LOXL4如何被上游基因进行表达调控及其降解过程仍不清楚。(2)为了更深入地明确LOXL4基因在肿瘤发生和进展中的作用,应建立基因敲入小鼠和基因敲除小鼠等工程小鼠模型,充分开展实验动物模型的体内研究。(3)需要进一步开发LOXL4的单克隆抗体,同时对LOXL4蛋白的小分子抑制剂进行高通量筛选,以发现针对LOXL4基因高表达的人类恶性肿瘤的特异性抑制剂。
- 中国生物化学与分子生物学报的其它文章
- PM2.5通过激活NLRP3/Caspse-1通路诱导大鼠子宫炎症反应
- “金课”背景下生物化学课程教学的创新与实践
- EHD2 Affects the Proliferation of Esophageal Squamous Cell Carcinoma by Regulating the Cyclin D1-CDK4-pRb Signaling Axis
- Therapeutic Effect of Mesenchymal Stem Cells Overexpressing Interleukin-10 on Inflammatory Bowel Disease
- miR-31改善2型糖尿病小鼠的肝损伤
- 干扰NSUN2通过调控细胞周期蛋白表达抑制黑素瘤细胞增殖