三阴性乳腺癌靶向治疗相关信号通路及其临床应用
纪 妍, 刘 森
(发酵工程教育部重点实验室,细胞调控与分子药物“111”引智基地,生物工程与食品学院,湖北工业大学,武汉 430068)
癌组织免疫组化检查中将雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)均为阴性的乳腺癌定义为三阴性乳腺癌(triple-negative breast cancer, TNBC)。TNBC占全部乳腺癌病例的15%~20%,是一种侵袭性高、复发风险高、治愈率较差的恶性肿瘤,截至目前仍缺乏有效的靶向治疗策略。
TNBC也是一类高度异质性的肿瘤。随着研究的深入,研究人员根据TNBC的病理学特征、临床异质性、mRNA表达分析、基因突变特征、肿瘤代谢通路等依据将TNBC分为不同的亚型,不同的亚型具有不同的分子特征及临床表现,因此表现出高度的异质性。例如,Metzger-Filho等[1]根据临床异质性将TNBC细分为基底样(basal-like)亚型、乳腺癌易感基因(breast cancer susceptibility gene mutated, BRCA)突变亚型、细胞角蛋白(cytokeratin, CK)和表皮生长因子受体蛋白高表达(epidermal growth factor receptor, EGFR)亚型、Claudin-low亚型、免疫系统亚型和其他病理亚型等6种亚型。邵志敏等[2]根据TNBC不同基因突变特征将其分为免疫调节型、腔面雄激素受体型、基底样免疫抑制型、间质型等4个亚型(即“复旦分型”)。随后邵志敏等[3]又更进一步从肿瘤代谢通路的角度将TNBC分为脂质合成型、糖酵解型以及混合型等3种亚型(即“代谢分型”)。TNBC在组织形态、免疫表型、临床特征、治疗反应等方面都表现出复杂多样性,而三阴性仅仅是复杂异质性的共同表现,导致TNBC成为乳腺癌临床治疗上最复杂和最棘手的问题。
在临床实践中,针对TNBC异质性及其临床特征,化疗、放疗和手术切除等手段成为治疗的首选方法。但这些方法不仅对患者的身体造成过度损害,而且造成了患者心理上的沉重负担。由于传统治疗方法并不能显著的提高TNBC患者的生存率,寻求分子靶向治疗方法上的突破逐渐成为了关注的焦点。而现阶段TNBC的分子靶向治疗仍然停留在基础研究阶段,进入临床实践中分子靶向疗法仍旧屈指可数,所以TNBC分子靶向治疗方法的开发依然任重道远。综上,本文对近年来TNBC分子靶向治疗方面的研究进行了综述。
1 三阴性乳腺癌中经典的分子靶向治疗相关信号通路
1.1 TNBC中“合成致死”通路
目前,TNBC治疗的主要手段是化疗、放疗和手术切除。然而这些方法仍存在不能特异性识别癌细胞,容易导致对机体的过度损伤、容易引起复发和转移等不足之处[1]。因此,有研究认为在TNBC的治疗中,“盲目”的非靶向治疗是不长远的,仍需要更多有效的靶向治疗方法[4]。
细胞中常见的DNA修复方式主要包括碱基切除修复(base excision repair, BER)和同源重组修复(homologous recombination repair, HRR)。在正常情况下,聚(ADP-核糖)聚合酶(poly(ADP-ribosome) polymerase, PARP)和乳腺癌易感蛋白(breast cancer susceptibility protein, BRCA)共同参与并调控乳腺癌细胞的DNA修复过程,其中PARP主要参与BER过程,BRCA主要参与HRR过程。研究[1]发现,大多数TNBC患者出现BRCA基因突变。高志艳等[7]发现,在TNBC中PARP与BRCA的表达水平呈负相关,BRCA基因突变亚型中PARP的表达水平明显升高。PARP是BER过程的关键酶,与DNA损伤位点结合,从而参与DNA修复过程并发挥作用[8]。BRCA基因突变乳腺癌细胞(HRR途径缺陷)的DNA修复依赖于BER途径和PARP。因此,PARP的失活将阻断BRCA基因突变亚型乳腺癌的DNA修复过程,导致肿瘤细胞死亡,这种现象被称为“合成致死(synthetic lethality)”。PARP抑制剂(PARP inhibitors, PARPi)能够有效阻断肿瘤DNA的修复过程,因此,成为一种有前景的潜在治疗药物[2, 3]。
BRCA基因突变亚型的TNBC对DNA损伤类药物特别敏感,例如铂类药物和PARPi。PARPi不仅可以破坏DNA修复过程,还能增强药物对TNBC的化疗和放疗的效果[4]。目前已获批应用于临床试验的PARPi有以下4种:奥拉帕尼(olaparib)[11, 12]、维利帕尼(veliparib)[13]、尼拉帕尼(niraparib)[14]和他拉唑帕尼(talazoparib)[15]。
1.2 TNBC中的PI3K/AKT/mTOR通路
磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/蛋白质激酶B(protein kinase B, AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号转导通路(PI3K/AKT/mTOR通路,简称PAM通路)在肿瘤中发生异常激活,调控肿瘤细胞的增殖、分化和凋亡等生命过程,因而成为抗肿瘤药物研发的重要靶点[16, 17]。
有研究发现,在TNBC中常发生原癌基因(PIK3CA, AKT, mTOR)的激活突变或抑癌基因(INPP4B, PTEN)的失活突变,而这些基因突变都与肿瘤细胞的增殖、TNBC的化疗耐药性增强、致死风险增加和预后恶化表现出相关性[18-21]。经典的靶向PI3K/AKT/mTOR信号通路治疗TNBC的抑制剂有:PI3K抑制剂(例如buparlisib)、AKT抑制剂(例如ipatasertib)、mTOR抑制剂(例如everolimus)已经研究成熟并进入临床试验阶段[22-24]。但是由于PI3K/AKT/mTOR信号通路相关基因容易发生复杂的突变情况,所以作用于PI3K、AKT、mTOR靶点的抑制剂单独作用具有一定的局限性,随之出现了多个靶点抑制剂以及结合化疗药物共同作用的研究。随着研究的深入,采用基因测序技术确定基因突变位点,继而进行靶向治疗已经成为当前的研究热点,相关的临床试验也在进行当中。
总而言之,有许多的靶向PI3K/AKT/mTOR通路的抑制剂正处于研发阶段,其中部分抑制剂已经进入了临床试验并取得了令人欣喜的结果,为TNBC的靶向治疗带来新的希望。
1.3 TNBC中免疫检查点通路
在肿瘤的发生和发展过程中,机体的免疫系统可识别并消除肿瘤细胞。T细胞在识别肿瘤抗原和激活免疫反应以消灭肿瘤细胞的过程中扮演着关键角色。但是,只依赖机体的免疫系统并不能消灭所有的肿瘤细胞,肿瘤细胞有多种机制来逃避免疫性细胞死亡[25-27]。例如,程序性细胞死亡蛋白-1(programmed cell death protein-1, PD-1)和程序性细胞死亡蛋白配体 1(programmed cell death-ligand 1, PD-L1),当肿瘤细胞膜上的PD-L1与T细胞上的PD-1结合时,就会导致T细胞杀伤肿瘤的功能受到抑制,诱导肿瘤细胞免疫逃逸和避免死亡[28-29]。
由于TNBC容易发生基因突变而且具有高度异质性,因而更具有抗原性,可以有效地激活免疫系统。研究表明,TNBC中PD-L1表达水平高于其他乳腺癌亚型,约为19%,提示靶向PD-1/PD-L1可能是针对TNBC的一种有效的免疫疗法[30]。
目前,针对PD-1/PD-L1的免疫疗法(又称PD-1/PD-L1免疫检查点阻断疗法)已经有了相对成熟的研究,并已经应用于TNBC的临床治疗,有效地改善了患者的预后。Nanda等[31]首次报道,在临床研究中对TNBC患者静脉注射靶向PD-1免疫治疗药物帕博利珠单抗(pembrolizumab,商品名Keytruda,FDA批准的首个抗PD-1药物),结果发现,Pembrolizumab表示出良好的抗肿瘤活性和临床安全性。在随后的KEYNOTE-086、KEYNOTE-119、KEYNOTE-522临床实验中,继续研究了相关pembrolizumab结合化疗方法在TNBC治疗中有效性和安全性[32-34]。此外,阿特珠单抗(atezolizumab,商品名为Tecentriq)可靶向抑制PD-L1,以激活T细胞消灭肿瘤细胞。IMpassion130临床试验[35]发现atezolizumab联合白蛋白-紫杉醇(Nab-Paclitaxel)可使疾病恶化或死亡的风险显著降低。Atezolizumab联合Nab-Paclitaxel用于PD-L1阳性、转移性三阴性乳腺癌的临床试验正在进行当中。
尽管TNBC具有相对较强的免疫原性,以及较高的免疫细胞浸润水平,但靶向PD-L1/PD-1的临床疗效仍旧有限。陈列平等[36]提出“免疫正常化(immunity normalization)”理论,认为阻断PD-1/PD-L1免疫通路,恢复因肿瘤生长而减弱的机体免疫能力,才是TNBC免疫治疗的关键。免疫球蛋白B7H3与PD-L1一样是一个极其重要的免疫检查点分子,在调节肿瘤免疫应答发挥了重要作用。唐军等人[37]发现,TNBC细胞高表达FUT8蛋白,通过催化B7H3发生糖基化修饰而使B7H3不容易发生泛素蛋白酶体降解,并稳定在细胞膜上表达,从而抑制肿瘤免疫应答反应,导致TNBC细胞逃避免疫攻击和避免死亡。因此,B7H3可能是促使TNBC“免疫正常化”的候选靶标。
靶向PD-1/PD-L1的免疫疗法是TNBC治疗的一种重要的方法,具有高特异性、机体损伤小、可激发机体产生免疫记忆等特点,临床治疗研究中已经取得了一定疗效,但有的TNBC患者对抗PD-1/PD-L1免疫治疗方法无效,因此,有必要进一步探索其他的免疫检查点治疗的靶点。
2 三阴性乳腺癌中新兴的靶向治疗相关信号通路
在研究人员不断的探索下,TNBC肿瘤微环境中更多新的代谢通路和生物途径被发现,为TNBC治疗提供了新的潜在靶点。近几年比较具有潜力的TNBC靶向治疗相关信号通路主要包括血管生成、肿瘤转移、肿瘤干细胞的激活和凋亡、免疫反应激活和癌细胞代谢途径等。这些信号通路的深入研究,将有望为TNBC的临床治疗提供更多的可能和选择。
2.1 RhoC/ROCK1/SMAD5通路
恶性肿瘤的快速生长需要高效的血管网络来提供足够的氧气和营养。肿瘤新血管形成(neovasculogenesis)在TNBC的发生发展中发挥重要作用,靶向肿瘤组织血管生成途径是TNBC治疗的重要策略之一[38]。肿瘤组织新血管生成途径主要包括内皮血管新生(angiogenesis)和肿瘤血管拟态(vasculogenic mimicry, VM)两部分。目前,绝大部分抗血管新生临床治疗策略都是靶向血管内皮生长因子/血管内皮生长因子受体(VEGF/VEGFR)信号通路,并不能很有效的针对VM,因此针对VM的分子靶点是TNBC治疗的一个重要突破[39, 40]。
柳素玲等[41]发现,TNBC肿瘤细胞中特异性高表达肿瘤细胞内皮标志蛋白(tumor endothelial marker 8, TEM8),TEM8通过胞内段结构招募Ras同源家族成员C蛋白(Ras homolog family member C, RhoC)和鸟嘌呤核苷酸结合蛋白质G(s)亚基α亚型短蛋白(guanine nucleotide-binding protein G(s) subunit alpha isoforms short, GNAS),GNAS与RhoC相结合并阻断RhoC信号的失活,导致胞内RhoC/RhoC相关蛋白激酶(Rhoassociated protein kinase, ROCK1)信号增强,直接磷酸化并激活SMAD5,最终促使肿瘤组织血管拟态和干性增强,从而促进了TNBC的发展。继而在异种移植瘤研究中观察到,ROCK1抑制剂能有效的抑制肿瘤组织血管拟态生成和肿瘤生长。此外,与多西他赛(docetaxel)联合使用还可以显著抑制肿瘤干细胞富集现象。
靶向RhoC/ROCK1/SMAD5通路及其相关蛋白可以实现靶向肿瘤血管拟态,为开发针对TNBC的临床治疗策略提供了有力的证据。
2.2 多胺合成、分解代谢通路
多胺是一类小分子烷基链阳离子,哺乳动物细胞中的多胺主要有腐胺、亚精胺和精胺及乙酰化多胺。与健康对照相比,TNBC患者的癌细胞和组织中多胺水平明显上升[42]。研究表明,TNBC癌细胞中多胺水平的上调是由于多胺的合成、分解代谢以及摄取发生失调造成的[43-45]。因此,靶向多胺代谢通路有望成为TNBC治疗的新方法。
多胺合成和分解途径的第一个关键酶为鸟氨酸脱羧酶(ornithine decarboxylase, ODC)。α-二氟甲基鸟氨酸(α-difluoro-methyl-ornithine, DFMO)是ODC的不可逆抑制剂,可有效抑制多胺合成。在细胞实验中,DFMO对于不同分型的乳腺癌细胞的作用程度不同,而且DFMO单药在TNBC临床试验中的作用效果并不是特别理想,可能原因之一是当多胺被耗尽时,多胺转运体系的代偿效应随之增加[46]。Alex等[47]发现,核酸毒性化疗药物—多柔比星(doxorubicin)可降低TNBC细胞中ODC表达水平及活性,与DFMO联合作用,可增强TNBC对化疗药物的敏感性。本课题组近期通过一系列细胞实验研究了ODC和腺苷受体的双重抑制剂ODC-MPI-2对乳腺癌的影响,结果显示,ODC-MPI-2在抑制TNBC细胞系MDA-MB-231的生长、增殖方面优于其他细胞系[48, 49]。
以上研究表明,靶向多胺合成和代谢通路会是一个有应用前景的TNBC治疗策略。
2.3 SLC3A2/LAT1通路
SLC3A2是一种溶质转运蛋白质,与L型氨基酸转运体1(L-type amino transporter, LAT1,又称SLC7A5)结合形成异源二聚体蛋白质,承担膜转运功能,这个体系也被称作System L[50-52]。SLC3A2/LAT1可以转运氨基酸、多胺以及营养物质,供给细胞生长和增殖。有研究发现[53]在DFMO治疗下,乳腺癌细胞中的多胺水平降低,而此时多胺转运体SLC3A2表达上调,通过转运外源多胺以保持多胺水平稳定。Khan等发现[54],AMXT-1501(多胺转运抑制剂)可阻断肿瘤细胞对多胺的代偿作用,但AMXT-1501是否靶向SLC3A2/LAT1转运体系仍不清楚。Ichinoe等[55]在对浸润性乳腺癌中LAT1和CD98hc(又称SLC3A2)表达进行免疫组化分析时发现,在TNBC中观察到更高的LAT1和CD98hc表达水平,并且与肿瘤转移和较差的预后相关。Shennan等[56]研究发现,在MDA-MB-231(TNBC)细胞系中,LAT1过表达,并且与较差的预后相关。当抑制LAT1的转运功能时,能够明显抑制肿瘤的生长和增殖。目前,针对LAT1的研究发现了许多高效的LAT1特异性抑制剂,但是在TNBC的研究和应用还很少报道。因此,靶向SLC3A2/LAT1也被认为是一种有前景的TNBC治疗策略。
2.4 IGF-1/IGF-1R/FAK/YAP信号转导通路
胰岛素样生长因子1(insulin like growth factor-1, IGF-1)与胰岛素样生长因子受体-1(insulin like growth factor receptor-1, IGF-1R)结合,参与乳腺发育、细胞增殖、凋亡以及胰岛素受体信号转导等多种生理过程,可促进多种类型癌细胞的生长、侵袭、转移和抗凋亡。在乳腺癌患者中,IGF-1R高表达和IGF-1水平升高与乳腺癌风险增加和预后不良相关[57,58]。Damiano等[59,60]发现,在TNBC细胞中,IGF-1/IGF-1R系统促进酪氨酸激酶FAK(tyrosine kinase FAK, FAK)信号转导通路的激活,进而调节yes相关蛋白(yes-associated protein, YAP)的积累及其靶蛋白质的表达。IGF-1/IGF-1R-FAK-YAP网络级联触发TNBC细胞的生长潜力,但在不同的实验系统中研究还较少。由此可见,IGF-1/IGF-1R/FAK/YAP信号轴有可能助力于TNBC的靶向治疗。
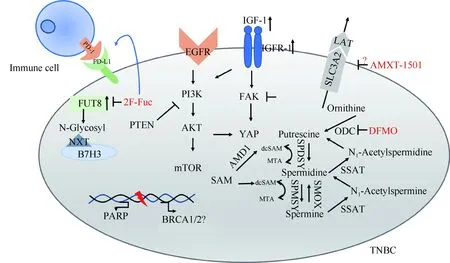
Fig.1 Potential signaling pathways for targeted therapy of TNBC TNBC: triple-negative breast cancer; EGFR: epidermal growth factor receptor; PI3K: phosphoinositide 3-kinase; AKT: protein kinase B; mTOR: mammalian target of rapamycin; PTEN: Phosphatase and tensin homolog; PD-1: programmed cell death protein 1; PD-L1: Programmed cell death 1 ligand 1; FUT8: α-1,6-fucosyltransferase; B7H3: B7 homolog 3 protein; PARP: poly (ADP-ribose) polymerase; BRCA1/2: breast cancer susceptibility gene 1/2; IGF-1: insulin-like growth factors 1; IGF-1R: Insulin-like growth factor receptor 1; FAK: tyrosine kinase B; YAP: Yes-associated protein; LAT:L-type amino acid transporter; SLC3A2: solute cartier family 3 member 2; ODC: ornithine decarboxylase; AMD1: adenosylmethionine decarboxylase 1; SAM: S-Adenosyl methionine; dcSAM: decarboxylated S-adenosylmethionine; MTA: 5’-methylthioadenosine; SPDSY: Spermidine synthase; SPMSY: Spermine synthase; SMOX: Spermine oxidase; SSAT: Spermidine/Spermine-N1-acetyltransferase; polyamine transport inhibitor: AMXT 1501; ODC irreversible inhibitor: DFMO, α-difluoro-methyl-ornithine; fucosyl-transferase inhibitor: 2F-Fuc, 2-Deoxy-2-fluoro-L-fucose
综上,本文对部分TNBC中经典的和新兴的靶向治疗相关信号通路进行了归纳,详见Fig.1。此外,其他信号通路由于仍处于研究阶段且相关报道不多,因而不详细叙述。
3 临床中三阴性乳腺癌的靶向治疗研究
除临床前的研究之外,许多TNBC的靶向治疗相关信号通路已经成熟或者正在进行临床试验,详见Table 1。Domchek等[61]提出,对于BRCA基因突变、HER-2阴性的晚期乳腺癌患者,Durvalumab(PD-L1抗体抑制剂)联合Olaparib(PARPi)表现出协同致死效果,且临床应用效果优于临床前研究。Schmid等[62]提出,Capivasertib(AKTi)联合Paclitaxel可以明显改善PTEN突变的TNBC患者的总生存率,但仍具有一定的毒副作用。同时Sung-Bae Kim等[63]发现,Ipatasertib(AKTi)联合Paclitaxel可以有效改善晚期或者转移性TNBC患者的总生存率。OlympiAD研究[15]针对HER-2阴性且具有BRCA1/2突变的乳腺癌患者,通过口服安全性高的Olaparib(PARPi)为患者带来更好的生活质量。BrighTNess研究[14]中发现,乳腺癌患者接受Paclitaxel+Carboplatin+Veliparib(PARPi)的联合治疗可以有效的提高患者的生存率,但效果不优于Paclitaxel+Carboplatin联合治疗。KEYNOTE 119研究[33]对比了Pembrolizumab与单药化疗对于侵袭性TNBC的治疗效果,发现这两种疗法均未明显改善患者的总生存率。然而,KEYNOTE 522研究[34]发现,Pembrolizumab与化疗联合作用于早期TNBC患者,能够显著改善患者总生存率。
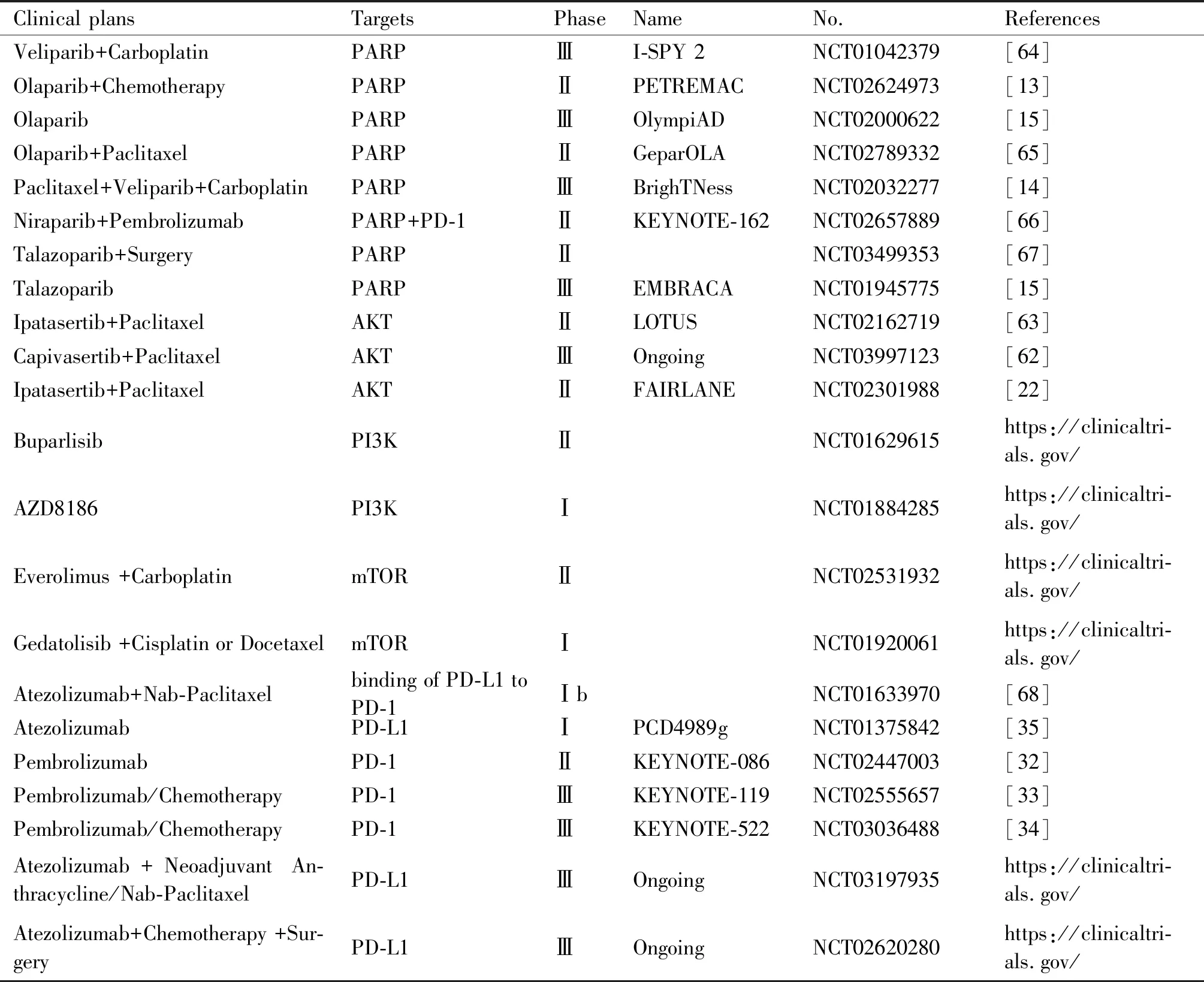
Table 1 Clinical treatment plans for different targeted therapeutic pathways in TNBC
4 问题与展望
TNBC的临床治疗是一个极为复杂的问题,目前仍然缺乏明确的药物作用靶点。无规律的基因突变使其具有很强的异质性,导致TNBC对化学治疗方法产生较差的疗效和预后。新兴的TNBC治疗方法,例如化学辅助疗法、靶向免疫系统疗法、靶向肿瘤新血管生成疗法以及靶向肿瘤细胞表面转运系统等方法,在理论研究上都取得了阶段性的进展,为TNBC的靶向治疗带来了了新的可能和希望,但其临床应用仍有待深入探索。在这些新兴的方法中,“精确分型,精准治疗”的治疗策略得到了深入的探索,并部分进入了临床实践。通过对三阴性乳腺癌进行精确分型来深入探究不同亚型的TNBC的异质性,将更加有利于发现更多的特异性靶点,进而针对不同类型的TNBC选择精准的治疗策略。例如,邵志敏等[5]根据“复旦分型”,精确分析了免疫调节型、腔面雄激素受体型等亚型TNBC的临床特征,然后选择免疫治疗、靶向治疗等策略进行精准治疗,成功将治疗后肿瘤缩小患者的比例由10%提升至29%,其中腔面雄激素受体亚型TNBC患者的肿瘤缩小比例高达100%。此后,邵志敏等[6]在“复旦分型”的基础上,从肿瘤代谢通路的角度提出了“代谢分型”,继而验证了不同“代谢分型”对特定的代谢抑制剂的敏感型差异,证明了代谢分型的有效性,也从代谢通路角度揭示了新的TNBC治疗靶点。
此外,对于TNBC的治疗方法和手段还包括人工智能系统筛查、纳米药物疗法及光动力学治疗等新兴辅助治疗方式。各种治疗方法的不断深入研究必将为TNBC的治疗带来曙光。
- 中国生物化学与分子生物学报的其它文章
- PM2.5通过激活NLRP3/Caspse-1通路诱导大鼠子宫炎症反应
- “金课”背景下生物化学课程教学的创新与实践
- EHD2 Affects the Proliferation of Esophageal Squamous Cell Carcinoma by Regulating the Cyclin D1-CDK4-pRb Signaling Axis
- Therapeutic Effect of Mesenchymal Stem Cells Overexpressing Interleukin-10 on Inflammatory Bowel Disease
- miR-31改善2型糖尿病小鼠的肝损伤
- 干扰NSUN2通过调控细胞周期蛋白表达抑制黑素瘤细胞增殖