lncRNA NRON靶向miR-185-5p调节乳腺癌细胞化疗耐药性的机制研究
汪伶俐,田武国,赵健洁,罗东林
乳腺癌是女性最主要的恶性肿瘤[1]。乳腺癌和其他恶性肿瘤一样,由多种复杂的因素影响细胞增殖与凋亡的失衡、促癌与抑癌基因结构功能的改变、耐药蛋白及信号转导通路的异常,而最终影响细胞行为的进一步恶化[2]。寻找新的抗癌靶点及探寻耐药机制一直是癌症研究的重点。长链非编码RNA(lncRNAs)可海绵化和隔离微小RNA(miRNA)以调节靶蛋白,影响细胞结构及功能机制的改变,因而受到研究者的关注[3]。长链非编码RNA抑制因子活化T细胞(lncRNA NRON)是活化T细胞的非编码抑制物,近来研究发现其在乳腺癌组织中表达降低[4],但lncRNA NRON是否影响乳腺癌化疗耐药性还不明确。miRNA中的miR-185-5p在不同癌症中具有不同作用,已有研究发现,miR-185-5p在乳腺癌中高表达具有促癌及促进耐药性产生的作用[5],但miR-185-5p功能的异常是否受lncRNA NRON的调控,目前还未见研究。本研究用基因预测软件发现lncRNA NRON与miR-185-5p之间有靶向结合关系,并体外培养乳腺癌细胞,探究干预lncRNA NRON表达后,对miR-185-5p调控及耐药性产生的影响,以期为乳腺癌的基因靶向治疗提供新的思路,报道如下。
1 材料与方法
1.1 材料
1.1.1 研究对象:(1)收集2016年7月—2020年7月陆军军医大学大坪医院乳腺甲状腺外科行乳腺癌切除患者26例的癌组织及距癌组织大于2 cm处的癌旁组织标本,于-80℃保存备用。患者均为女性,年龄35~79(56.50±5.20)岁;临床分期:T1~2期20例,T3~4期6例;组织学分级:Ⅰ级5例,Ⅱ级13例,Ⅲ级8例;ER阳性21例,PR阳性20例,HER-2扩增11例;分化程度:高、中分化12例,低分化14例。(2)健康清洁级Balb/c雌性裸鼠,购自广州锐格生物科技有限公司,生产许可证号:SCXK(粤)2021-0059;本实验符合3R原则,经本院动物伦理委员会批准同意[IACUC-01(2021110026)]。(3)正常乳腺上皮细胞系(MCF10A)及乳腺癌细胞系(MCF7、MDA-231、T47D、SKBR3、ZR7530、BT549、HCC1937、BT474)均购自上海淳麦生物科技有限公司。
1.1.2 试药与试剂:5-氟尿嘧啶(5-FU)、顺铂(DDP)、紫杉醇(PTX)等购自上海源叶公司;逆转录试剂盒购自上海研卉生物公司;Lipofectamine 3000转染试剂盒购自上海恒斐生物公司;lncRNA NRON过表达载体(plasmid NRON)及其阴性对照(NC)、miR-185-5p模拟物(miR-185-5p mimic)及阴性对照(mimic NC)等均由生工生物工程(上海)公司提供;胸苷酸合成酶(TS)抗体购自美国abcam公司。
1.1.3 仪器设备:紫外分光光度仪购自上海精密仪器仪表有限公司;FACSCalibur购自美国BD公司;光学显微镜(光镜)购自上海豫光仪器有限公司。
1.2 实验方法 2020年8月—2021年12月于陆军军医大学大坪医院中心实验室进行实验。正常乳腺上皮细胞系及乳腺癌细胞系于37℃水浴复苏,取适量用含10%胎牛血清的DMEM培养基进行传代培养及计数。取对数期MCF7细胞系,按1×105个/孔接种于6孔板内,Lipofectamine 3000转染试剂转染lncRNA-NRON过表达载体(plasmid NRON)及其阴性对照(NC),设置为plasmid NRON组、NC组,每组设置6个复孔。
1.3 检测指标与方法
1.3.1 实时荧光定量聚合酶链反应(qRT-PCR)法检测lncRNA NRON、miR-185-5p基因表达:乳腺癌及癌旁组织标本或细胞经粉碎、匀浆,提取RNA,反转录得到cDNA,行PCR反应,反应体系:上下游引物各1.0 μl,2×SYBR mix 10 μl,H2O 10 μl,10×cDNA模板1 μl。反应条件:95 ℃预变性35 min、95 ℃变性60 s、60 ℃退火70 s、75 ℃延伸35 min,55个循环。lncRNA NRON以三磷酸甘油醛脱氢酶(GAPDH)为内参,miR-185-5p以U6为内参,应用2-ΔΔCT法计算各基因相对表达量。各引物序列由上海生工生物公司合成。
1.3.2 细胞计数(CCK-8)法检测细胞增殖及IC50、R值:取转染后的plasmid NRON组及NC组细胞,分别加入不同浓度的5-FU(0、25、50、100、150、200 mg/L)、DDP(0、1、2.5、5、7.5 mg/L)、PTX(0、1、5、10、20、40 μg/L),培养72 h时,CCK-8试剂20 μl干预培养4 h,紫外分光光度仪(450 nm)上读取吸光度(OD)值,根据OD值绘制生长曲线,计算细胞对5-FU、DDP、PTX的半数抑制浓度(IC50)值,计算耐药指数(R,各组化疗药物IC50值的比值)。plasmid NRON组及NC组细胞在5-FU(100 mg/L)、DDP(5 mg/L)、PTX(10 μg/L)条件下分别培养0 h、24 h、48 h、72 h,CCK-8试剂20 μl干预培养4 h,紫外分光光度仪450 nm处读取OD值,根据OD值绘制生长曲线,计算增殖活性。
1.3.3 流式细胞术检测细胞凋亡率:plasmid NRON组及NC组细胞在5-FU(100 mg/L)、DDP(5 mg/L)、PTX(10 μg/L)条件分别培养72 h,收集细胞,70%乙醇固定,Annexin V-FITC凋亡检测试剂盒和FACSCalibur系统进行细胞凋亡分析,ModFit LT软件分析细胞凋亡率。
1.3.4 Western-blot法检测各组MCF7细胞中胸苷酸合成酶(TS)蛋白表达:细胞粉碎匀浆并提取蛋白,二喹啉甲酸(BCA)法检测蛋白总浓度,取蛋白80 μg行电泳及转膜操作,滴加1∶600的一抗(TS)及1∶900的内参β-actin抗体孵育24 h,辣根过氧化物酶二抗孵育30 min,化学发光液浸膜曝光,Bio-Rad图像扫描条带,Alpha Ease FC软件计算条带灰度值。
1.3.5 裸鼠荷瘤实验检测过表达lncRNA NRON对5-FU、DDP、PTX化疗的敏感性:plasmid NRON组及NC组细胞,调整细胞浓度为1.0×108个/ml,取0.2 ml接种于裸鼠腋下,2周后裸鼠右腋下可触及瘤块,视为接种成功,并分别腹腔注射5-FU(20 mg/kg)[6]、DDP(30 mg/kg)[7]、PTX(15 mg/kg)[8],3天1次,连续干预4周。干预结束后游标卡尺检测瘤体体积(瘤体体积=长径×短径2/2),处死裸鼠,剥离瘤体,精密称重,瘤体组织经4%多聚甲醛固定制成5 μm石蜡切片,脱蜡及透化处理后,加入1∶200兔抗人ki67抗体孵育过夜,生物素IgG二抗孵育1.5 h,苏木精复染并于光镜下观察拍照。
1.3.6 双荧光素酶实验验证lncRNA NRON与miR-185-5p的靶向关系:Starbase网站预测lncRNA NRON与miR-185-5p存在互补配对的碱基序列。建立含有miR-185-5p结合位点的NRON野生型(WT)和突变型(MUT)片段,并分别克隆至荧光素酶报告质粒中,以合成NRON-3'UTR-WT及NRON-3'UTR-MUT质粒,用Lipofectamine 3000转染试剂在293T细胞中共转染mimic NC或miR-185-5p mimic,48 h后,用双荧光素酶报告分析系统检测荧光素酶活性。
1.3.7 过表达miR-185-5p对lncRNA NRON作用的逆转性研究:设置NC组、plasmid NRON组、plasmid NRON+miR-185-5p mimic组、plasmid NRON+mimic NC组,NC组、plasmid NRON组细胞处理同前;plasmid NRON+miR-185-5p mimic组及plasmid NRON+mimic NC组,在plasmid NRON组基础上,分别转染miR-185-5p mimic及mimic NC试剂。转染后分别接种于裸鼠皮下,给予5-FU、DDP、PTX化疗药物干预后,检测瘤体体积及TS蛋白表达情况。
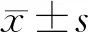
2 结 果
2.1 乳腺癌组织、癌旁组织及细胞系中lncRNA NRON的表达比较 与癌旁组织比较,乳腺癌组织中lncRNA NRON表达降低(P<0.05)。与正常乳腺上皮细胞系(MCF10A)比较,乳腺癌细胞系(MCF7、MDA-231、T47D、SKBR3、ZR7530、BT549、HCC1937、BT474)中lncRNA NRON表达均降低(P<0.05),其中MCF7细胞系中lncRNA NRON表达最低,见表1。
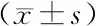
表1 正常乳腺上皮细胞系及乳腺癌细胞系中lncRNA NRON表达比较
2.2 上调lncRNA NRON对MCF7细胞化疗耐药性的影响 与NC组比较,plasmid NRON组细胞lncRNA NRON表达升高(0.45±0.01 vs.1.33±0.06,P<0.05)。
NC组及plasmid NRON组细胞分别经不同浓度5-FU、DDP、PTX干预培养72 h后,与NC组比较,plasmid NRON组细胞IC50值及R值降低(P<0.05),见图1、表2。NC组及plasmid NRON组细胞在5-FU、DDP、PTX干预培养条件下,与NC组比较,plasmid NRON组细胞OD值降低,在72 h时差异最显著(P<0.05),见图2。plasmid NRON组细胞凋亡率及TS蛋白表达升高(P<0.05),见图3、4,表3。裸鼠荷瘤实验发现,接种plasmid NRON细胞的裸鼠,经5-FU、DDP、PTX治疗后,瘤体体积及ki67表达明显低于NC组(P<0.05),见图5、表4。
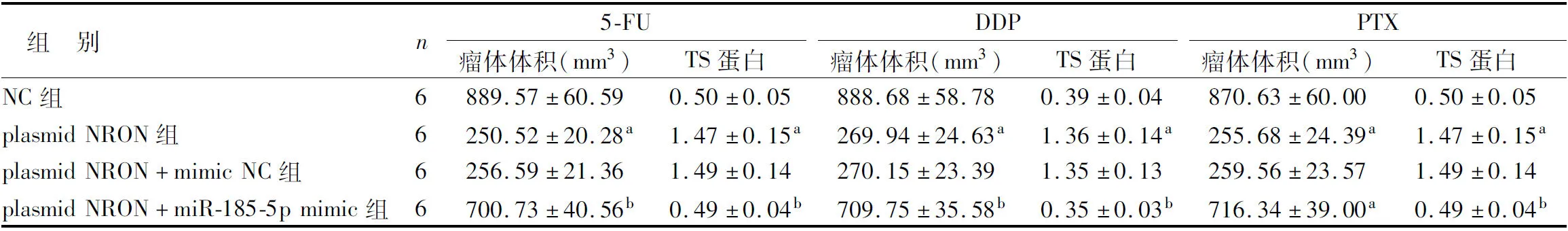
表2 2组MCF7细胞对5-FU、DDP、PTX的IC50及R值比较
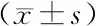
表3 5-FU、DDP、PTX干预培养后2组细胞凋亡率及TS蛋白表达比较
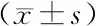
表4 5-FU、DDP、PTX干预培养后2组瘤体体积及ki67表达水平比较

注:与NC组比较,aP<0.05

注:与NC组比较,aP<0.05

图3 2组流式凋亡检测图
注:A.NC组;B.plasmid NRON组

图5 2组瘤体组织ki67免疫组化染色图(×200)
2.3 lncRNA NRON与miR-185-5p的靶向关系 乳腺癌组织中miR-185-5p表达显著高于癌旁组织(3.22±0.21 vs. 1.00±0.13,t=45.833,P<0.001),在癌细胞系中表达高于正常乳腺上皮细胞系(P<0.05),见表5。与NC组比较,lncRNA NRON组MCF7细胞中miR-185-5p表达下调(0.33±0.42 vs. 1.45±1.45)(t=30.333,P<0.05)。
表5 正常乳腺上皮细胞系及乳腺癌细胞系中miR-185-5p表达比较
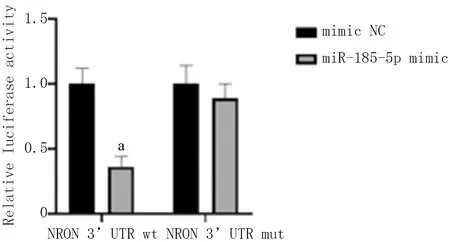
生物信息学Starbase数据库预测试验及双荧光素酶报告试验发现,lncRNA NRON与miR-185-5p之间有靶向结合位点,293T细胞共转染miR-185-5p mimic和无突变的lncRNA NRON-WT载体,可使293T细胞中荧光素酶活性显著下降(P<0.05),而共转染miR-185-5p mimic和发生突变的lncRNA NRON-MUT载体对荧光素酶活性无显著作用(P>0.05),见图6、7。

图6 lncRNA NRON与miR-185-5p靶向结合位点预测
2.4 miR-185-5p过表达对上调lncRNA NRON后癌细胞化疗耐药性的影响 与plasmid NRON组比较,miR-185-5p mimic+plasmid NRON组裸鼠瘤体体积升高,TS蛋白降低(P<0.05),而plasmid NRON组与plasmid NRON+mimic NC组比较上述指标差异无统计学意义(P>0.05),见图8、表6。

表6 经5-FU、DDP、PTX治疗后各组裸鼠瘤体体积及TS蛋白表达比较
注:与mimic NC比较,aP<0.05

注:A.NC组;B.plasmid NRON组;C.plasmid NRON+mimic NC组;D.plasmid NRON+miR-185-5p mimic组
3 讨 论
乳腺癌是一个重大的公共卫生问题,并在全球范围内造成重大的医疗负担[9]。乳腺癌发生发展的潜在机制仍不明确。lncRNA已在各种癌症中得到广泛研究,且已成为乳腺癌干预的新靶点。lncRNA可作为信号分子来调节下游基因的转录,并与蛋白质(通常是转录因子)相互作用而抑制蛋白质的功能,且海绵化和隔离miRNA及调节靶蛋白表达参与细胞周期、抗药产生等生物学行为过程[10]。lncRNA NRON反向定位在9q33.3,长2 730 nt,是T细胞核因子NFAT的非编码RNA抑制物,是常见的影响细胞核运输的RNA[11]。已有研究发现,lncRNA NRON在乳腺癌组织中表达降低,且与乳腺癌患者生存及预后关系密切[12,4]。化疗药物耐药性产生,一直是影响乳腺癌患者生存的关键因素[13]。5-FU、DDP、PTX是目前癌症治疗较为常见的化疗药物[14]。本研究发现,在乳腺癌组织中lncRNA NRON表达明显低于癌旁组织,与Niu等[4]的研究一致,说明lncRNA NRON在乳腺癌中可能发挥抑癌作用。用不同浓度的5-FU、DDP、PTX与乳腺癌细胞系MCF7培养后,随着耐药性的产生,lncRNA NRON表达也随之降低,反之上调lncRNA NRON表达后,MCF7细胞系对5-FU、DDP、PTX的耐药性明显降低,乳腺癌细胞表现为较低的增殖及较高的凋亡水平,提示干预lncRNA NRON表达可能是提高乳腺癌细胞对化疗药物敏感性的潜在策略。但lncRNA NRON参与调控耐药性产生的下游调控机制还不甚明确。
lncRNA NRON可通过海绵化和隔离miRNA来影响细胞功能变化。但lncRNA NRON通过哪种途径调控乳腺癌细胞耐药性产生还不明确。本研究通过基因预测软件发现,lncRNA NRON与miR-185-5p之间有靶向结合关系,且lncRNA NRON可靶向下调miR-185-5p,推测lncRNA NRON很可能通过海绵化和隔离miR-185-5p来发挥增敏作用。查阅大量文献发现,miRNA中的miR-185-5p与乳腺癌异常增殖、凋亡及化疗耐药性产生关系密切[15-16],且miR-185-5p可通过破坏嘧啶核苷酸的合成酶(UMPS)、二氢嘧啶脱氢酶(DPD)、TS等合成,阻扰5-FU、DDP、PTX在癌细胞内分解及代谢,进而减弱化疗药物对癌细胞的毒杀作用[17,5]。本研究发现,miR-185-5p在乳腺癌组织和细胞系中显著高表达,与既往研究一致[5],与lncRNA NRON表达趋势刚好相反,提示miR-185-5p作为促癌因子在乳腺癌中起作用,且可能与lncRNA NRON存在靶向关系,双荧光素酶实验验证了这一推测。此外,过表达lncRNA NRON增加乳腺癌化疗药物敏感性的同时,miR-185-5p表达显著降低,具有促进化疗效率的TS表达却显著升高[18],乳腺癌表现出较低的增殖率和较高的凋亡率,证实lncRNA NRON提高化疗药物敏感性作用可能与调节miR-185-5p有关。为了进一步验证这一推测,本研究在过表达lncRNA NRON的同时上调miR-185-5p表达,并接种于裸鼠体内,经化疗药物干预后,发现裸鼠接种lncRNA NRON及miR-185-5p高表达细胞的瘤体体积增长明显高于单独接种lncRNA NRON高表达的裸鼠,提示miR-185-5p高表达可明显削弱lncRNA NRON发挥的降低化疗药物耐药性作用。说明lncRNA NRON通过靶向负调控miR-185-5p抑制乳腺癌细胞的化疗耐药。
综上所述,lncRNA NRON可通过靶向下调miR-185-5p,来降低乳腺癌对化疗药物的耐药性。这为乳腺癌的化疗治疗提供新的干预策略。但miR-185-5p高表达并不能完全逆转lncRNA NRON降低化疗药物耐药性的作用,提示lncRNA NRON的下游干预机制可能涉及多个miRNA,这需要后续进行深入探究。
利益冲突:所有作者声明无利益冲突
作者贡献声明:
汪伶俐:设计研究方案,实施研究过程,论文撰写;田武国:提出研究思路,分析试验数据,论文审核;赵健洁:实施研究过程,资料搜集整理,论文修改;罗东林:进行统计学分析,课题设计,论文撰写

