气相色谱法鉴别柴辛注射液中的柴胡
于晓辉,王 雷,王 琦,赵富华,杨 星,马秋冉,顾进华*
(1.中国兽医药品监察所,北京 100081;2. 牧原食品股份有限公司,河南南阳 473000)
兽用药柴辛注射液用于治疗马、牛、羊、猪、犬、猫的感冒发热,其生产企业众多,临床应用广泛。该制剂的质量标准现收载于农业农村部公告第1759号[1]中,其中的【鉴别】(2)项是采用气相色谱法对其中的柴胡进行鉴别,具体的方法为“取本品,作为供试品溶液。另取正己酸对照品,加丙酮制成每1 mL含35 μg的溶液,作为对照品溶液。照含量测定项下色谱条件,吸取对照品溶液及供试品溶液各1 μL,注入气相色谱仪,测定。供试品色谱中,应呈现与对照品保留时间相同的色谱峰。”。
在应用上述方法对柴辛注射液进行检验时,发现其存在如下问题:现行质量标准要求采用强极性的硝基对苯二甲酚改性的聚乙二醇(FFAP)为固定相的毛细管色谱柱,对供试品原液直接进样测定。但是,该供试品原液是水溶液,将其直接注入FFAP色谱柱进行测定时,会对色谱柱的固定相造成不可逆的损伤,实验结果表明,进供试品原液5次后,色谱柱的检测限就由5 μg/mL升高至30 μg/mL,即色谱柱的灵敏度快速下降,导致无法准确鉴别供试品中是否含有柴胡,容易出现“假阴性”的实验结果。
为了解决上述问题,本研究新建了一种“柴辛注射液”中柴胡的鉴别方法,以期更好的控制该类产品的质量。
1 材料与方法
1.1 仪器与试剂 AE240电子天平,Mettler公司; 7890A气相色谱仪,Agilent公司; DB-FFAP色谱柱,30 m×0.53 mm, 1.00 μm,Agilent公司;HP-INNOWAX,30 m×0.53 mm, 1.00 μm色谱柱,Agilent公司;DB-624,75 m×0.530 mm,3.00 μm色谱柱,Agilent公司;HP-5,30 m×0.32 mm, 0.25 μm色谱柱,Agilent公司;7694E顶空进样器,Agilent公司;LDZ5-2离心机,京立公司。
正己烷和乙酸乙酯均为色谱纯,其他试剂均为分析纯。
1.2 试药 对照品:正己醛(批号:US7 NB-BK),>98.0%,东京化成工业株式会社。
供试品:共6家企业生产的8批柴辛注射液,规格均为10 mL(相当于原生药30 g)。
1.3 实验方法
取本品5 mL,置于分液漏斗中,加入正己烷5 mL,强力振摇5 min,移至玻璃离心管中,以5000转/分钟的速率离心15 min,取上层溶液作为供试品溶液。另取正己醛对照品适量,加正己烷制成每1 mL含6 μg的溶液,作为对照品溶液。照含量测定项下的色谱条件,吸取对照品溶液和供试品溶液各3 μL,注入气相色谱仪,测定。
气相色谱条件:以硝基对苯二甲酚改性的聚乙二醇(FFAP)为固定相的毛细管色谱柱(柱长30 m,内径0.530 mm,膜厚1.00 μm),柱温为程序升温,初始温度为70 ℃,保持1 min,以每分钟5 ℃的速率升温至170 ℃,保持10 min,再以每分钟5 ℃的速率升温至240 ℃,保持10 min;用氢火焰离子化检测器检测,检测器温度250 ℃;进样口温度210 ℃;以氮气为载气,流速为每分钟5 mL,分流比10∶1。
2 结果与分析
2.1 柴胡标记物的选择 现行质量标准中是以己酸作为柴胡标记物对其进行鉴别的,而在研究过程中发现,以己酸作为标记物存在如下两个问题:
问题① 响应因子较低:采用DB-624色谱柱时,35 μg/mL的己酸丙酮溶液的峰面积仅约为10;采用DB-FFAP色谱柱时,上述溶液的峰面积约为60。以己酸作为标记物,方法的灵敏度较差,容易出现“假阴性”的结果。
问题② 提取困难:当采用DB-FFAP色谱柱进行测定时,无法直接进水溶液,即必须用非极性溶剂将己酸从强极性的供试品溶液中提取出来。本研究曾尝试用乙醚、乙酸乙酯、正己烷等非极性溶剂对己酸进行提取,但均未能成功,这可能是由于己酸极性较强、活性较大、难以从强极性的水溶液中被提取出来。
为了解决上述问题,本研究参考了《中国兽药典》二部柴胡注射液中的标记物[2-3],采用己醛作为柴胡的标记物对其进行了测定。
2.2 色谱柱的选择 分别采用DB-FFAP、DB-624和HP-5色谱柱,按照1.3中的色谱条件进行操作,对浓度为6 μg/ml的己醛正己烷对照品溶液进行测定,比较不同色谱柱条件下,己醛峰面积的差异,结果见表1。

表1 不同色谱柱时己醛的峰面积Tab 1 Peak area of hexanal utilizing different chromatographic columns
根据上述结果得知,三种色谱柱条件下,己醛峰面积值基本一致,表明己醛的响应值几乎不受色谱柱极性的影响。另外,本研究还应用该色谱条件同时测定了甲基丁香酚,所以,为了方便操作,最终选择甲基丁香酚测定时采用的DB-FFAP色谱柱对己醛进行鉴别检查。
2.3 提取方法
2.3.1 提取溶剂的选择 根据制剂的特点及文献查阅的结果,以1号样品为研究对象,分别以正己烷和乙酸乙酯为提取溶剂,比较二者的提取效果。结果,以乙酸乙酯为提取溶剂时,供试品溶液中己醛色谱峰峰形较差,溶剂峰干扰严重;而以正己烷做溶剂时,己醛峰峰形对称,周围的干扰峰较少。二者的色谱图见图1。

图1 不同提取溶剂的比较Fig 1 Comparison of different extraction solvents
2.3.2 正己烷用量的考察 以1、2、3号样品为研究对象,分别取三种供试品各5 mL,平行取样3次,置于9个分液漏斗中,向每个分液漏斗中分别加入正己烷5 mL、10 mL、15 mL,按照1.3中的方法进行操作测定,比较供试品溶液中己醛的峰面积,结果见表2。
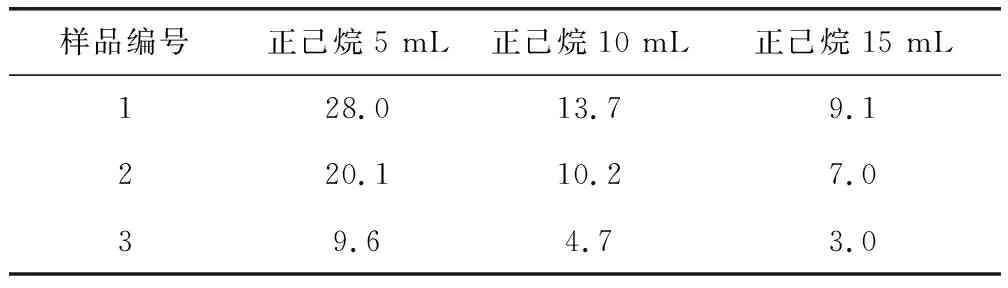
表2 不同量提取溶剂时己醛的峰面积Tab 2 Peak area of hexanal changing with the amount of extraction solvent
根据上述结果得知,随着提取溶剂正己烷用量的增加,供试品溶液中己醛峰面积呈现相应比例的变化,表明5 mL、10 mL和15 mL正己烷的提取效果基本一致。为了便于观察实验结果,本研究最终以己醛响应值较大时正己烷的用量(5 mL)为提取溶剂的用量。
2.3.3 提取时间的考察 以1、2、3号样品为研究对象,分别取三种供试品各5 mL,平行取样3次,置于9个分液漏斗中,加入正己烷5 mL,分别强力振摇2、5和10 min,按照1.3中的方法进行操作测定,比较供试品溶液中己醛的峰面积,结果见表3。

表3 不同提取时间时己醛的峰面积Tab 3 Peak area of hexanal changing with extraction time
根据上述结果得知,强力振摇2分钟、5分钟和10分钟后,供试品溶液中的己醛峰面积基本一致。为了兼顾提取效果和时间效率,本研究最终选择5分钟为提取时间。
2.3.4 乳化问题及离心注意事项 研究过程中发现,向5 mL供试品中加入5 mL正己烷,强力振摇5分钟后,溶液较易出现乳化现象。为了解决乳化问题,我们采用了将乳化液静置过夜、低温加热、加少量氯化钠、离心四种方法。结果显示,前三种方法对乳化问题的解决效果均较差,而离心方式能够快速有效的解决乳化问题。
另外,本研究还比较了塑料材质离心管和玻璃材质离心管的离心效果,结果显示,将乳化液置于塑料离心管中离心15 min后,上清液中会出现干扰物,造成己醛峰面积增加2~3倍。这可能是由于正己烷是一种非极性溶剂,容易将塑料材质中的某些成分浸出,从而对己醛测定产生干扰。
根据上述研究结果,新建方法中采用“玻璃离心管”对乳化液进行离心操作。
2.4 进样方式
2.4.1 提取溶液直接进样与供试品原液顶空进样测定结果比较 为了更准确的测定供试品溶液中的己醛,本研究对1.2中的8批供试品分别采用提取溶液直接进样法与供试品原液顶空进样法两种方式进行己醛含量测定,比较不同进样方式下己醛测定结果之间的差异。其中,顶空进样条件是按照《中国兽药典》二部柴胡注射液【特征图谱】项下的条件进行的(顶空瓶平衡温度85 ℃,平衡时间15 min,进样阀温度100 ℃,传输线温度115 ℃,顶空瓶充压时间0.2 min,定量环填充时间0.2 min,定量环平衡时间0.5 min,进样时间1.0 min)。两种进样方式下,己醛含量测定结果见表4。

表4 不同进样方式时柴辛注射液中的己醛含量Tab 4 Content of hexanal in chaixin injection with different injection mode
从上表结果得知,8批样品中7批样品直接进样的测定结果高于供试品原液顶空进样的结果,尤其7号样品,两种进样方式测得结果之间的差异高达16倍。之所以会出现这样的差异,可能是由于己醛的沸点较高(130~131 ℃),在上述顶空平衡条件下,难以使己醛从供试品中充分挥发出来,以至于顶空进样方式测定结果偏低;另外,不同企业生产的制剂中添加的丙二醇等辅料的量也存在较大差异,这也会造成顶空进样时挥发出的己醛量不充分,从而导致己醛测得结果偏低。
根据上述研究结果,新建方法中采用提取溶液直接进样法对供试品溶液中的己醛进行鉴别。
2.4.2 进样量的考察 由于己醛的响应因子较低,峰面积较小,为了便于观察实验结果,准确判断己醛色谱峰,本研究根据1.3中方法的溶剂类型、进样口温度、色谱柱规格等,计算出供试品溶液的最大进样量为3 μL;如果超过该进样量,有可能造成进样溶液气化后溢出衬管、污染进样口的问题。所以,在应用该方法时,要按照质量标准的要求去操作,尤其注意色谱柱型号和规格的选择,否则容易造成进样不准确。
另外,本研究又通过多次反复进样,考察3 μL的进样量是否会对色谱系统造成残留污染。结果显示,在3 μL的进样量下,重复进供试品溶液约30次,未观察到色谱系统中出现残留物峰。
2.5 己醛对照品溶液浓度的确定 为了确定新建方法中己醛对照品溶液的浓度,本研究以《中国兽药典》二部柴胡注射液【特征图谱】项下的对照品溶液浓度为参考,比较了“柴胡注射液”和“柴辛注射液”二者处方和制法之间的差异,并对差异进行了转换计算,最终确定新建方法中己醛对照品溶液的浓度为“6 μg/mL”。
2.6 专属性考察 按照柴辛注射液的制法,制备不含有柴胡的阴性样品,按照1.3中的方法对阴性样品进行测定,记录色谱图(图2)。结果,阴性样品在己醛对照品色谱峰位置处无吸收峰,表明制剂中的其他成分对己醛的测定无干扰,方法专属性良好。
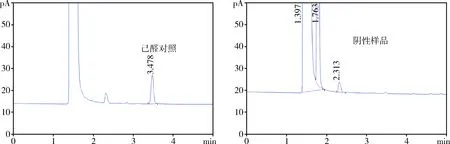
图2 己醛对照图谱和阴性样品图谱Fig 2 the chromatogram of the standard solution and the negative sample solution
2.7 耐用性考察 本研究对1.3中的色谱条件进行了耐用性考察,结果表明,当初始柱温在70 ℃±20 ℃、进样口温度在210 ℃±20 ℃、检测器温度在250 ℃±20 ℃范围内变化时,己醛峰的峰面积和对称性、己醛峰与相邻杂峰的分离度均未见明显变化,方法的适用性良好。
另外,本研究以1号样品为研究对象,比较了不同升温速率条件下,供试品溶液中己醛峰与相邻杂峰的分离度,结果见表5。

表5 升温速率的比较Tab 5 Comparison of heating rates
上述结果表明,升温速率越快,己醛峰与相邻峰的分离度越差。为了兼顾时间效率和分离效果,本研究最终选择5 ℃/min作为升温速率。
2.8 样品测定 按照1.3中的方法对1.2中的8批样品进行己醛鉴别检查,结果8批样品中均呈现与己醛对照品保留时间相同的色谱峰,代表性色谱图见图3。

图3 1号样品的气相色谱图Fig 3 Gas chromatogram of sample 1
3 讨论与结论
研究新建了柴辛注射液中柴胡的鉴别方法[4-5]。通过采用己醛作为柴胡的标记物,解决了原质量标准中以己酸作为标记物而导致的响应因子低、提取困难等问题;通过筛选提取溶剂、优化溶剂使用量和提取时间,解决了原质量标准中直接进样水溶液供试品以至于色谱柱被损伤、灵敏度快速下降等问题;通过比较不同进样方式并优化进样量,保证了己醛峰面积较大、便于结果观察和结果判断。
另外,本研究还对新建方法的专属性和耐用性进行了考察,保证方法准确可靠、适用性良好。应用新建方法对6个厂家生产的8批柴辛注射液进行测定,结果表明,该方法操作简便、专属性强、耐用性好,适用于该类制剂的质量控制[6],为柴辛注射液质量标准的完善和提升提供了实验依据。

