严重急性呼吸综合征冠状病毒2 S蛋白DNA疫苗超螺旋构型纯化工艺的建立
王雪云,吴彦萍,叶才文,梁富,黄致翔,徐尔赞,刘爱和,郭土敬
深圳市卫光生物制品股份有限公司,广东 深圳 518107
严重急性呼吸综合征冠状病毒2(severe acute respiratory symptom coronavirus 2,SARS-CoV-2)可引起新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19),该病是一种呼吸系统疾病,传染性和变异性极高,已在全球范围内传播开来[1-2]。目前,根据WHO报道,截止2022年2月,全球累计确诊病例438 609 586例,累计死亡5 981 281例,由于COVID-19防控难度大,给人类健康和全球经济造成较大影响[3]。接种疫苗是预防COVID-19及降低重症率和死亡率的有效手段。
目前在研疫苗中,核酸疫苗(包括DNA疫苗和mRNA疫苗)相对于传统的灭活疫苗和重组蛋白疫苗,属于新兴领域,且DNA疫苗具有更高的稳定性和安全性,且具有生产工艺简单,成本低等优点[4-7]。目前,DNA疫苗的免疫方式最常用的是肌肉注射,但其免疫原性通常较弱,很难单独诱导出保护性免疫反应[8-12]。本研究DNA疫苗所用质粒(pDRVI3.0-S)采用载体pDRVI3.0,是一种可有效增强SARSCoV-2 S蛋白在体内高效表达的载体[13],解决了DNA疫苗免疫原性弱的缺点。
根据国家药品监督管理局药品审评中心发布的《预防用DNA疫苗临床前研究技术指导原则》,将超螺旋结构的比例作为评价质粒DNA的标准,环状结构的重组质粒所占比例应在90%以上[14]。据相关研究报道,超螺旋DNA的结构更为紧密,更易于进入细胞核,且其是唯一适应于在真核细胞内表现出生物活性的天然完整结构[15-17]。因此,相比于其他拓扑结构,超螺旋DNA在治疗应用中最为有效[18]。
目前常用的分离超螺旋DNA和其他拓扑易购形式质粒DNA的方法是使用cytiva公司商品化的亲和层析填料plasmidselect xtra,其通过Sepharose 6FF为基架与配体2巯吡啶共价结合,通过超螺旋DNA和其他拓扑结构与配体的结合力不同来分离纯化超螺旋DNA[19-23]。但SARS-CoV-2 S蛋白的DNA疫苗(pDRVI3.0-S)质粒较大(>10 000 bp),纯化时极难使其超螺旋含量稳定达到90%以上。而相关研究很少涉及对SARS-CoV-2 DNA疫苗超螺旋构型提升工艺的报道。
本研究对亲和层析填料plasmidselect xtra上样条件进行优化,旨在建立一种纯化效果显著、重复性好的可分离含SARS-CoV-2 S蛋白的DNA疫苗超螺旋质粒DNA和开环质粒DNA的纯化方法,为建立SARS-CoV-2 DNA疫苗的规模化生产工艺奠定基础。
1 材料与方法
1.1 菌株 含重组质粒pDRVI3.0-S的宿主菌E.coliDH5α由中国疾病预防控制中心(Centers for Disease Control and Prevention,CDC)邵一鸣教授惠赠。
1.2 主要试剂及仪器DNA分子量marker购自北京全式金生物技术有限公司;其他常规试剂购自上海阿拉丁生化科技股份有限公司;Sepharose 6FF和plasmidselect xtra纯化介质、AKTA explorer 100液相色谱仪、XK16/70和XK26/40层析柱均购自美国Cytiva公司;BIOTECH-100JSA发酵罐系统购自上海保兴生物设备工程有限公司;核酸蛋白检测仪购自美国Eppendof公司。
1.3E.coli的发酵与收获-70℃取含质粒pDRVI3.0-S的E.coliDH5α菌种,涂布于含卡那霉素(25 μg/mL)的LB固体培养基中,37℃培养12~16 h;接种至3 mL含卡那霉素(50 μg/mL)的LB培养基中,37℃,180~220 r/min培养12~16 h;按1%取样接种至100 mL含卡那霉素(50 μg/mL)的LB培养基中,37℃,180~220 r/min培养12~16 h;将培养菌液全部转入含10 L培养基的发酵罐中,pH 7.0,控制搅拌速度及空气流量,使搅拌速度维持在40%~60%,发酵16 h。发酵液12 230×g离心30 min,收集菌体。
1.4E.coli的裂解与浓缩100 g菌体中加入600 mL溶液Ⅰ(25 mmol/L Tris,50 mmol/L Glu,10 mmol/L EDTA,pH 8.0),充分搅匀;随即加入1 200 mL溶液Ⅱ(0.2 mol/L NaOH,1% SDS),轻柔搅拌5 min;缓慢加入1 200 mL溶液Ⅲ(3 mol/L乙酸钾,2 mol/L冰乙酸,pH 5.5),轻柔搅拌至全部呈蛋花状,静置30 min;200目尼龙布过滤后,分别用5和0.5 μm滤芯过滤澄清,得到澄清裂解液。
采用孔径为300 NMWC的0.5 m2超滤膜包进行浓缩,将2 700 mL浓缩液浓缩至270 mL(10倍浓缩),采用TE缓冲液(10 mmol/L Tris,1 mmol/L EDTA,pH 8.0)等体积洗滤5倍。
1.5 分子筛层析 采用分子筛Sepharose 6FF去除RNA及杂蛋白,用3倍柱体积(CV)溶液A(2.0 mol/L硫酸铵,100 mmol/L Tris,10 mmol/L EDTA,pH 7.5)平衡柱床(线性流速60 cm/h)。将浓缩的样品按线性流速60 cm/h上样,上样量为20%。上样结束后,同样用溶液A按线性流速60 cm/h进行洗脱,得到分子筛层析收集液。取样检测收集液浓度、纯度及超螺旋含量。
1.6 亲和层析上样条件的优化
1.6.1 正交试验设计 根据亲和层析填料的性质对亲和层析上样样品的硫酸铵浓度(A)、氯化钠浓度(B)、上样载量(C)3种因素进行优化,因素水平表见表1,设计方案见表2。

表1 亲和层析上样条件优化试验因素水平表Tab.1 Factors and levels for optimization of condition for sample loading in affinity chromatography
1.6.2 样品溶液的制备 按表2处方,用溶液B(4.0 mol/L硫酸铵,100 mmol/L Tris,10 mmol/L EDTA,pH 7.5)及固体氯化钠调节样品中硫酸铵和氯化钠浓度,按正交试验组别制备样品溶液,备用。

表2 亲和层析上样条件优化正交试验设计Tab.2 Design of orthogonal test for optimization of condition for sample loading in affinity chromatography
1.6.3 亲和层析纯化 用3倍CV溶液A平衡柱床(线性流速120 cm/h),根据样品浓度调节上样体积,根据正交试验组别控制上样载量。上样结束后,用溶液A洗脱开环质粒,溶液C(1.7 mol/L硫酸铵,0.3 mol/L氯化钠,100 mmol/L Tris,10 mmol/L EDTA,pH 7.5)洗脱超螺旋质粒,收集洗脱峰,取样检测纯度、浓度及超螺旋质粒含量。
1.7 不同批次样品的亲和层析纯化 取3批不同批次制备的样品(20200716、20200730、20200813),按1.6项超螺旋含量最优条件处理样品,并进行亲和层析纯化。收集洗脱峰,取样检测纯度、浓度及超螺旋质粒含量。
1.8 纯化质粒DNA的检测
1.8.1 超螺旋含量 采用琼脂糖凝胶电泳分析洗脱样品,用含质粒染色液(gelstain)的0.8%琼脂糖凝胶电泳,图谱分析软件quantity one分析收集样品中的超螺旋构型含量。
1.8.2 纯度及质粒DNA含量 将质粒DNA样品置于核酸蛋白检测仪,选定核酸检测,读取A260/280值及浓度值。
2 结果
2.1 分子筛层析 超滤浓缩液经分子筛Sepharose 6FF处理后,收集的质粒峰经1%琼脂糖凝胶电泳分析,已无RNA条带,其超螺旋质粒DNA和线性质粒DNA见图1。经凝胶电泳成像系统扫描,超螺旋质粒DNA占比为54.71%。
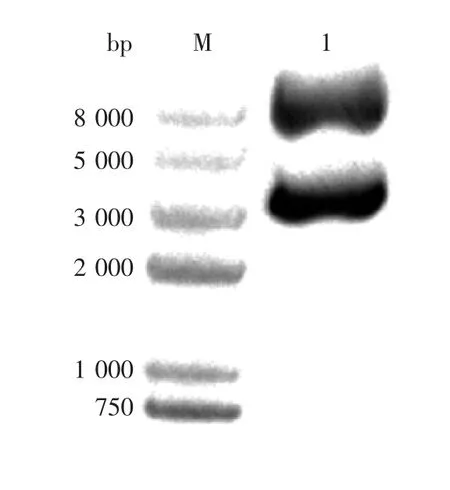
图1 浓缩液分子筛层析收集液超螺旋含量比例分析Fig.1 Percentage of supercoil content in harvest from molecular sieve chromatography of concentrate
2.2 亲和层析上样正交试验优化结果9组处理后样品亲和层析收集液的琼脂糖凝胶电泳图见图2,亲和层析图谱见图3。未经优化前,分子筛层析洗脱收集液经亲和层析处理后,质粒回收率为57.60%,超螺旋含量占比为86.86%,回收率低且超螺旋含量不能达到90%及以上。从正交结果极差分析可知,影响亲和层系质粒回收率及超螺旋含量占比的因素主次顺序均为:硫酸铵浓度>上样量>氯化钠浓度。超螺旋含量占比最优组合为A2B3C1,见表3,即硫酸铵浓度2.3 mol/L,氯化钠浓度0.5 mol/L,上样载量1.0 g/L,超螺旋含量为92.12%。

表3 不同正交组别质粒回收率及超螺旋质粒DNA含量Tab.3 Plasmid recovery rates and supercoiled plasmid DNA contents in various orthogonal groups
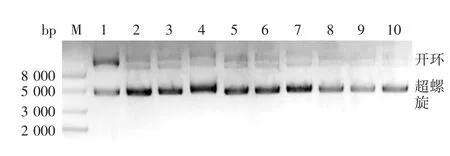
图2 正交设计不同组别亲和层析收集液的琼脂糖凝胶电泳分析Fig.2 Agarose gel electrophoretic profile of harvest from affinity chromatography in various groups in orthogonal design

图3 正交设计不同组别的亲和层析色谱图Fig.3 Affinity chromatograms of various groups in orthogonal design
2.3 不同批次样品亲和层析纯化结果 不同批次样品按优化条件处理后,样品中的超螺旋构型含量稳定在92%以上,见表4及图4。

图4 不同批次样品亲和层析纯化后琼脂糖凝胶电泳结果Fig.4 Agarose gel electrophoretic profile of various batches of samples purified by affinity chromatography

表4 不同批次样品亲和层析纯化后的超螺旋构型含量及质粒回收率(%)Tab.4 Supercoiled configuration contents and plasmid recovery rates in various batches of samples purified by affinity chromatography(%)
3 讨论
超螺旋构象质粒DNA含量占比不小于90%是DNA疫苗药用质量标准中明确指出的关键指标。因此,在DNA疫苗制备过程中非常关注超螺旋构象质粒DNA的纯化工艺。工业化生产中,常采用亲和层析(plasmidselect)柱层析法获得超螺旋构象DNA[24-25]。亲和层析填料Plasmidselect是LEMMENS等基于疏水层析的技术基础上,在体积排阻填料Sepharose 6FF引入芳香硫醇,根据不同结构DNA与其结合力不同来进行分离。
参照现有资料提供的纯化工艺参数[26],本研究采用亲和层析(plasmidselect)柱层析法对pDRVI3.0-S质粒进行纯化,获得的pDRVI3.0-S质粒DNA超螺旋含量在80%~90%之间,即部分非超螺旋结构的DNA杂质也随超螺旋结构DNA同时洗脱下来,不符合药用DNA疫苗的质量标准。究其原因,在现有纯化工艺条件下,本研究所用的含SARS-CoV-2 S蛋白的质粒DNA开环结构与超螺旋结构在plasmidselect填料上的结合力相差不大,出现同时洗脱下来的情况。而开环结构与超螺旋结构最主要的差异为两者的疏水性不同。表明优化硫酸铵浓度和氯化钠浓度,改变其溶液疏水性,可有效地将超螺旋质粒DNA与线性及开环质粒DNA分离开。
本研究对分子筛层析收集的SARS-CoV-2的质粒DNA样品采用正交法进行优化,发现样品中增加硫酸铵及氯化钠终浓度能有效增加质粒DNA超螺旋构型含量。连续3批试验结果可以看出,纯化SARS-CoV-2 DNA疫苗质粒超螺旋构型时,样品中加入2.3 mol/L硫酸铵,0.5 mol/L氯化钠,上样量1 g/L能稳定地将超螺旋质粒DNA含量提高至92%以上。值得注意的是,再次提高硫酸铵或氯化钠浓度可进一步提升质粒pDRVI3.0-S超螺旋构型的含量,但会降低其回收率,这可能与pDRVI3.0-S质粒在高盐条件下结合能力下降有关。
SARS-CoV-2 DNA疫苗的超螺旋构型占比是其是否符合药用质量标准的关键指标。目前学术上未发现有提高pDRVI3.0-S超螺旋构型纯化工艺的报道。本研究基于亲和层析填料plasmidselect xtra,在前期大量研究基础上,优化硫酸铵和氯化钠浓度,有效分离了pDRVI3.0-S的超螺旋构型和线性及开环构型。本研究建立的SARS-CoV-2 S蛋白DNA疫苗超螺旋构型纯化工艺稳定,分辨率高,易于控制且成本低,为pDRVI3.0-S DNA疫苗的规模化生产提供了试验依据,推动了基因治疗的进一步发展。

