人呼吸道合胞病毒疫苗的研究进展
李海,任虎综述,张燕,许文波,2审校
1.国家卫生健康委员会医学病毒和病毒病重点实验室中国疾病预防控制中心病毒病预防控制所世界卫生组织西太平洋地区麻疹/风疹参比实验室,北京 102206;2.中国科学院生物安全大科学研究中心,湖北 武汉 430000
人呼吸道合胞病毒(human respiratory syncytial virus,hRSV)是肺病毒科(Pneumoviridae)正肺病毒属(Orthopneumovirus)中唯一感染人的病毒,因此也称为人正肺病毒[1]。hRSV通过直接接触和飞沫传播,是引起5岁以下儿童急性下呼吸道感染的首要病原[2]。2岁以下婴幼儿几乎均感染过hRSV,常引起下呼吸道感染[3]。hRSV全球流行病学监测网络显示,2015年约320万名5岁以下儿童因感染hRSV住院,导致约59 600名患儿死亡,其中包括27 300名小于6个月的婴儿[4]。hRSV在老年人中同样具有较高的发病率及死亡率[5]。
据统计,全球每年因hRSV感染产生的经济负担高于800亿美元,但尚无有效的药物和疫苗,目前仅帕丽珠单克隆抗体(Palivizumab,Synagis®)可预防早产儿和免疫低下儿童感染hRSV,但尚未引进国内进行临床应用。近几年hRSV抗体药物ALX-0171[6]、Nirsevimab[7]和MK-1654[8]等在临床试验中展现出了良好的效果。hRSV疫苗的研发同样具有极大的商业价值和社会效益,WHO将hRSV疫苗列为全球最优先研发的疫苗之一[9]。
2013年融合前F蛋白(prefusion F protein,Pre-F)构象解析后,以Pre-F为基础的hRSV疫苗研发项目大量出现,本文就hRSV疫苗研发面临的挑战以及最新研究进展作一综述。
1 疫苗研发面临的挑战
自hRSV被发现以来[10],科研人员对hRSV疫苗进行了60多年的研发,至今仍无商品化的疫苗,疫苗研发过程困难重重,挑战巨大[11]。hRSV疫苗一直以临床试验失败率高而著称,目前已有7种进入临床试验的hRSV疫苗宣布“失败”,见表1。其中灭活疫苗FI-RSV[12]、亚单位疫苗BBG2Na[13]和载体疫苗MEDI-534[14]由于安全性原因被叫停,其他4种疫苗(颗粒疫苗ResVax[15]和SynGEM[16]以及亚单位疫苗PFP[17]和MEDI-7510[18])保护效果不足,诱导产生的抗体中和活性较低。除此之外,很多因素和困难制约着疫苗的研发。hRSV缺乏理想的动物感染模型[19],很难开发出一种同时适用于孕妇、儿童和老年人[20]的疫苗。

表1 临床试验失败的hRSV疫苗Tab.1 The hRSV vaccines failed in clinical trials
1.1 F蛋白构象的转变F蛋白包含信号肽(aa 2~20)、信号肽切割位点(aa 21~25)、F2区(aa 26~109)、多肽裂解区(aa 110~136)和F1区(aa 137~574)[21],F蛋白高度保守,以三聚体形式存在,诱导产生的抗体对A和B 2个血清亚型均有中和作用[22],包含Pre-F(长约16 nm)和Post-F(长约11 nm)2种构象。Pre-F是一种亚稳定结构,当病毒与细胞发生融合后,Pre-F转变为稳定的Post-F[23],在Pre-F中均具有目前鉴定的6种抗原表位(siteⅠ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和ø),但Post-F仅具有4种抗原表位(siteⅠ、Ⅱ、Ⅲ和Ⅳ)[24]。2013年,MCLELLAN等[25]对F蛋白进行优化改造,获得了稳定的Pre-F,并发现了新的中和抗体表位ø,Pre-F特有的抗原表位ø产生中和抗体的活性最强,较针对其他表位产生的抗体中和活性高几十倍[26],该成果被评为2013年度科学十大进展之一。针对该表位的预防性单克隆抗体药物Nirsevimab已经进入Ⅲ期临床试验[27]。而2013年前,hRSV疫苗均是针对Post-F设计研发的,这或许解释了疫苗失败的原因。
MedImmune公司研制的亚单位疫苗MEDI-7510对60岁以上老年人进行了Ⅰ期临床试验,发现该疫苗具有良好的安全性[28],但Post-F构象诱导产生的中和抗体滴度较低,不能保护老年人免受hRSV感染[18]。纯化的F蛋白(purified fusion protein,PFP)是冷传代的hRSV A2毒株通过离子交换纯化获得,PFP-3的F蛋白占病毒总蛋白的95%以上,在儿童中能够激活高滴度的中和抗体[17]。但PFP产量低,不能满足市场需要,且F蛋白的构象不能保证。长春百克生物科技股份公司与荷兰Mucosis B.V.公司合作开发的细菌样颗粒疫苗SynGEM,经滴鼻途径免疫小鼠和棉鼠,在鼻内可生成sIgA,但血清中产生的中和抗体滴度低于FI-RSV疫苗[29-30]。该疫苗在英国开展的Ⅰ期临床试验中,滴鼻免疫后志愿者体内未产生针对表位ø的中和抗体,证明该疫苗中F蛋白处于融合后构象[16]。
其中最遗憾的是诺瓦瓦科斯(Novavax)研制的颗粒疫苗ResVax[15],也是目前唯一进入Ⅲ期临床试验的hRSV疫苗,该疫苗在临床前和Ⅱ期临床试验中均具有良好的安全性和免疫效果[31-34]。2016年,在1.2万名60岁以上老年人的Ⅲ期临床试验中保护效果不佳,宣布失败。2019年2月,于4 000多名孕妇中开展的Ⅲ期临床试验,未能达到设定的主要终点指标,对婴儿保护效力不佳[35]。
这4种疫苗失败的主要原因是疫苗开始研发时间较早(2013年前),Pre-F蛋白结构尚未解析,均是基于Post-F蛋白设计的疫苗,诱导产生的中和抗体滴度低,不足以抵抗hRSV感染。
1.2 安全性不足 疫苗的安全性直接关系人类健康,因此必须保证疫苗没有致病性和接种后异常反应。目前有3种hRSV疫苗的临床试验由于安全性原因被叫停:福尔马林灭活疫苗(formalin-inactivated RSV,FI-RSV)接种后引起呼吸道疾病增强作用(enhanced respiratory disease,ERD)[36];亚单位疫苗BBG2Na诱发接种者出现Ⅲ型超敏反应;载体疫苗MEDI-534免疫原性较弱,遗传性状不稳定。
上世纪60年代,接种FI-RSV疫苗的儿童再次感染hRSV,疫苗不仅不能产生保护效果,反而加重接种者病情,导致80%接种者入院并造成2名儿童死亡[12]。后来的研究证明,FI-RSV诱导机体产生大量CD4+T细胞、Th2类细胞因子和嗜酸性粒细胞,而CD8+T细胞和Th1类细胞因子相对减少,引起机体免疫系统失衡(偏向Th2类免疫应答)[36]。FI-RSV病毒颗粒表面的F蛋白均处于融合后构象,因此诱导产生的中和抗体滴度较低,不但不能中和hRSV反而形成大量的免疫复合物沉淀,引起过敏性炎症。也有研究报道hRSV感染可能含有类似于登革病毒引起的抗体依赖性增强作用(antibody-dependent enhancement,ADE)[37]。
通常基于黏附蛋白G设计的亚单位疫苗诱导机体产生偏向Th2类的免疫应答[38],亚单位疫苗BBG-2Na由链球菌白蛋白结合域(binding region,BB)和蛋白G核心保守区(G protein fragment,G2Na)组成[39],在Ⅲ期临床试验中,有一部分接种者出现Ⅲ型超敏反应[13]。
MedImmune公司研制的载体疫苗MEDI-534,以人/牛副流感重组嵌合病毒为载体,在病毒表面表达hRSV F蛋白[14],Ⅰ期临床试验在半岁至2岁的婴幼儿中进行,结果显示其具有良好的安全性和兼容性,但免疫原性较弱,基因组不稳定,会导致鼻塞等副作用,因此该疫苗仅进行了Ⅰ期临床试验[40]。这些接种后异常反应使得临床试验无法继续开展。
1.3 免疫人群不同hRSV疫苗免疫人群包含孕妇、儿童和老年人,这3种人群体内特异性抗体水平、免疫系统成熟程度不同,因此很难开发出同时适用于3种人群的疫苗。婴幼儿免疫系统尚未成熟,体内母源抗体水平不同,对该年龄段婴幼儿进行免疫时须格外小心。可通过免疫孕妇来保护分娩后的婴幼儿,通过胎盘传递的hRSV中和抗体在婴儿体内的半衰期为月1个月,在此期间可阻挡hRSV感染[41]。研究表明,对未接触过hRSV的婴幼儿应避免使用非复制型疫苗(亚单位疫苗或灭活疫苗),尽量使用减毒活疫苗[42]。
老年人已经多次自然感染过hRSV,减毒活疫苗很难诱导产生理想的保护效果,激发的免疫反应不足以阻止再次感染hRSV[20],对该人群可使用亚单位疫苗。因此颗粒疫苗和亚单位疫苗倾向用于孕妇和老年人,减毒疫苗和载体疫苗倾向用于婴幼儿[43]。
1.4 缺乏理想的动物模型 理想感染模型的缺乏也是疫苗发展和致病机理研究的主要障碍,小鼠对hRSV感染有较强抵抗力,不像人类那样被广泛感染,小鼠需高滴度的病毒才能引起肺脏病理变化。尽管有这些限制,但相对较低的成本和易操作等优势,导致目前最常用的动物模型仍是BALB/c小鼠[44]。棉鼠比BALB/c小鼠更易被hRSV感染,与人类感染hRSV非常相似,病毒在下呼吸道的复制主要局限于细支气管上皮,可反复感染hRSV,但不能完全模拟人体hRSV的感染[45]。目前国内尚无商品化的棉鼠,因此,hRSV疫苗的临床前试验均是在BALB/c小鼠中进行的。
hRSV感染不同周龄的小鼠可引起不同的临床症状,周龄较大的小鼠症状更明显,肺脏组织病理变化更严重[46]。幼鼠对hRSV亚单位疫苗的免疫应答反应(中和抗体和细胞免疫应答)要优于老年小鼠[47]。
非洲绿猴和食蟹猴等灵长类动物免疫FI-RSV疫苗可导致与人类ERD非常相似的病理变化,通常在肺脏和支气管组织内含有淋巴细胞、巨噬细胞、嗜酸性粒细胞和多形核细胞的严重浸润。但通常情况下,每个鼻孔需注射几毫升高滴度病毒,有时需要气管内注射,因此并不能真实反映人体的传播类型[19]。
2 处于临床试验阶段的hRSV疫苗
2013年Pre-F结构的成功解析为hRSV疫苗的研发提供了新的靶点,疫苗研发策略和种类迅速增多。截至2021年1月,文献报道的处于临床试验的hRSV疫苗共16种(5种亚单位疫苗、6种载体疫苗、1种颗粒疫苗、4种减毒活疫苗),其中进入Ⅱ期临床试验的疫苗共6种,绝大多数是基于Pre-F设计的(见表2)。
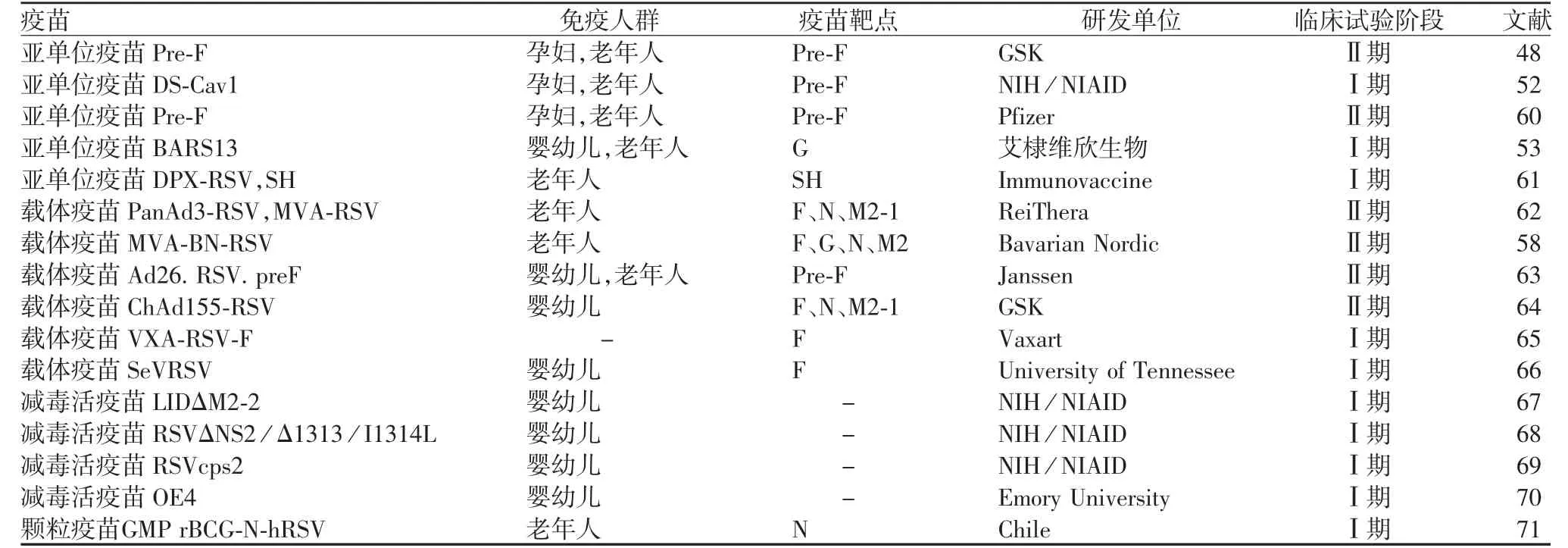
表2 处于临床试验阶段的hRSV疫苗Tab.2 The hRSV vaccines in clinical trials
2.1 亚单位疫苗 目前认为以Pre-F为基础的亚单位疫苗是最有潜力的候选疫苗,科研人员在各种表达系统中均有尝试,包括哺乳细胞、酵母和大肠埃希菌等。GSK公司研发人员通过F蛋白氨基酸的突变和缺失,在C-末端加入GCN4序列,改造的蛋白疫苗Pre-F-GCN4t处于融合前构象,在CHO细胞系中表达纯化后以三聚体形式存在。Pre-F-GCN4t是针对孕妇和老年人设计的,对孕妇进行免疫接种可通过胎盘转移中和抗体为新生儿提供被动保护。对128位18~44岁的健康男性单次肌肉注射60 μg疫苗Pre-F-GCN4t,在免疫60 d后中和抗体滴度增加3.2~4.9倍,但在第180天抗体滴度下降,实验中铝佐剂并未起到增强免疫应答的效果[48]。在18~45岁非妊娠女性中开展的Ⅱ期临床试验中,免疫60 μg抗原后第30天,中和抗体滴度增加3.1~3.9倍,安全性与百白破疫苗相似。后期在400名18~45岁的非妊娠女性中开展的Ⅱ期临床试验未使用铝佐剂,同样具有良好的安全性和保护效果[49]。
McLellan博士基于结构生物学,在2013年率先解析了Pre-F的结构,对F蛋白(1~513氨基酸)进行改造,将155和290位点的丝氨酸替换为半胱氨酸(S155C和S290C,DS)增加1对二硫键,在190和207位点替换2个疏水氨基酸(S190F和V207L,Cav1),使抗原位点ø更稳定,在C-末端增加T4噬菌体的三聚体基序(foldon,Fd)[50],为防止玫瑰花结的形成,对融合肽上的9个氨基酸(位点137~146)进行缺失[51]。改造后的F蛋白称为DS-Cav1,亲和层析纯化后用凝血酶将His标签切除。DS-Cav1含有稳定的抗原位点ø,以稳定的三聚体形式存在。DS-Cav1免疫小鼠和猕猴可产生高滴度的中和抗体,2019年在18~50岁成年人中进行的临床试验也同样产生了令人惊喜的效果:单次肌肉注射后免疫组的中和抗体提高10倍以上,且抗体水平可维持3个月[52]。
辉瑞公司基于Pre-F开发了新型hRSV亚单位疫苗。目前Ⅱ期临床试验(18~49和50~85岁)已经结束,不同剂量组诱导产生的中和抗体水平相当,抗原方面无剂量依赖性,临床结果于2019年hRSV疫苗世界大会上公布。
复旦大学王宾教授领导的团队自主研发的基于G蛋白(原核表达)的hRSV疫苗BARS13,能够利用环孢素A佐剂实现对Treg细胞调控,可对G蛋白引起的炎症反应进行有效控制,增加疫苗的安全性[53]。与艾棣维欣生物制药有限公司(Advaccine)联合在澳大利亚开展的Ⅰ期临床试验(60个健康成年)呈现出较好的应用潜力,这是国内研发的唯一进入临床试验的hRSV疫苗。
小疏水(small hydrophobic,SH)蛋白是一种跨膜糖蛋白,被感染的细胞在细胞膜表面大量表达SH蛋白,针对SH蛋白胞外结构域设计的亚单位疫苗可显著降低小鼠或棉鼠肺脏中的病毒滴度[54]。在50~64岁健康人群中开展了Ⅰ期临床试验,2次肌肉注射显示该疫苗具有较好的安全性和免疫原性[55]。
2.2 病毒载体疫苗 目前已经有多种病毒载体被用于hRSV疫苗,其中进入临床试验的病毒载体包括腺病毒载体、修饰的痘苗安卡拉病毒(modified vaccine Ankara,MVA)载体和仙台病毒(sendai virus,SeV)载体。将hRSV F、N和M2-1蛋白在黑猩猩腺病毒(PanAd3)和MVA载体中表达,滴鼻及肌注免疫小鼠和猕猴均能产生保护效果[56]。在18~50岁健康成年人中进行的Ⅰ期临床试验中,组合疫苗(PanAd3-RSV和MVA-RSV)具有良好的安全性、有效性和兼容性,可诱导机体产生有效的体液和细胞免疫应答。该组合疫苗同样可诱导60~75岁健康老年人产生特异性体液和细胞免疫应答[57]。
SAMY等[58]研发的病毒载体MVA-BN感染细胞后可进行基因的转录表达,但不会形成子代病毒。应用该载体编码hRSV的结构蛋白F和G,以及非结构蛋白N和M2,形成新型疫苗MVA-BN-RSV。在安全性和免疫原性方面,Ⅰ期临床试验中未观察到成人(18~49岁)和老年人(50~65岁)之间的差异,均能诱导广泛的细胞和体液免疫应答。在55岁以上的成年人中开展的Ⅱ期临床试验,MVA-BNRSV诱导的免疫反应持续6个月,但中和抗体增加的倍数较低[59]。
杨森(Janssen)公司应用腺病毒载体(Advac®)开发了一种hRSV候选疫苗,该疫苗应用人腺病毒26和35型载体(Ad26和Ad35)表达F蛋白,肌肉注射免疫棉鼠或猕猴均可诱导持久的体液和细胞免疫应答[59]。应用Ad26载体表达Pre-F,获得疫苗Ad26.RSV.pre-F,Ⅱ期临床试验(60岁以上老年人)中与流感疫苗联合使用,显示该疫苗具有良好的安全性,免疫28 d后hRSV中和抗体滴度增加约2.5倍[63]。
GSK公司利用病毒载体ChAd155表达F、N和M2-1蛋白,获得载体疫苗ChAd155-RSV。在hRSV血清阳性的成年人(18~45岁)中,免疫ChAd155-RSV后60 d,血清中和抗体滴度增加2.3倍,并具有良好的安全性,已经开展针对血清阴性婴幼儿的Ⅲ期临床试验[72]。
Vaxart公司研发的口服疫苗,应用非复制型Ad5表达F蛋白,该疫苗联合Toll样受体(TLR)佐剂已完成Ⅰ期临床试验(NCT02830932),但目前有关该疫苗的临床试验结果尚未有公开的报告[65]。
应用反向遗传技术将hRSVF基因插入至仙台病毒F和HN基因之间构建hRSV病毒载体疫苗SeVRSV,滴鼻免疫非洲绿猴可产生良好的保护效果。在血清阳性的棉鼠中SeVRSV诱导的免疫应答可有效预防RSV感染[73]。临床试验中对17名健康成人鼻内接种SeVRSV,由于成人对hPIV-1和hRSV已有预存抗体,因此SeVRSV核酸存在的时间较短,引起的抗体反应也较小。SeVRSV的目标人群是婴幼儿,未来临床试验应该在血清阴性儿童中进行[66]。
2.3 减毒活疫苗和颗粒疫苗 自20世纪60年代灭活疫苗的临床试验失败后,科学家开始注重减毒活疫苗的研发,早期应用传统的病毒减毒技术筛选温度敏感型减毒疫苗,包括冷传代和化学诱变技术,近年来反向遗传技术应用越来越广泛。减毒活疫苗可通过滴鼻免疫婴幼儿,不受血液中母传抗体的影响,并能激活黏膜免疫,但疫苗使用过程中存在毒力恢复的风险,如果病毒复制能力过度减少可使其免疫原性丧失,因此研发过程必须兼顾疫苗的安全性和免疫原性。经过几十年的发展,目前已有多种减毒活疫苗进入临床试验。
美国NIH和Med-Immune公司研发了一系列的hRSV减毒活疫苗,cpts248/955减毒活疫苗在婴幼儿的临床试验中显示出安全方面的问题,病毒减毒效果较差;cpts248/404减毒活疫苗在临床试验中毒力较低,但引起了部分婴幼儿的鼻塞。研发人员应用反向遗传学技术继续对cpts248/404疫苗进行基因改造,制备的重组减毒活疫苗rA2cp248/404/1030ΔSH(剔除SH基因,并在L基因1030位引入点突变),临床试验(44名1~2个月的hRSV血清阴性的婴儿)显示安全性良好[61],但诱导中和抗体能力有限,之后对其进行39个核苷酸替换,获得的减毒疫苗命名为MEDI-559[74],在血清阴性婴幼儿(5~24个月)中开展临床试验,显示免疫原性和安全性良好[75]。但MEDI-559减毒株的248或1030位点易发生回复突变,为了使MEDI-559更稳定,对其5个核苷酸和1个氨基酸进行替换获得新型疫苗hRSVcps2,临床试验(6~24个月)显示出良好的安全性和较好的免疫原性,且提高了遗传稳定性[69]。
将MEDI-559毒株的NS2基因和1313位点氨基酸缺失,将1314位点的异亮氨基酸替换为亮氨酸形成减毒活疫苗hRSVΔNS2/Δ1313/I1314L,该疫苗是一种温度敏感型毒株,在黑猩猩体内复制能力显著减弱,在hRSV血清阳性儿童(12~59个月)中安全性和有效性良好[68]。
缺失M2-2基因获得MEDIΔM2-2减毒活疫苗,该疫苗可下调病毒RNA复制,上调基因转录和抗原合成,从而增加保护性抗原的表达量,但在hRSV血清阴性儿童体内MEDI△M2-2在复制上受到高度限制[76]。为提高减毒疫苗复制水平,对筛选的另一株hRSV A2病毒进行M2-2基因的剔除,制备减毒疫苗LIDΔM2-2,在婴幼儿(6~24个月)中的临床试验显示安全性和免疫原性良好[67]。
2016年,埃默里大学STOBART等[70]通过基因替换和缺失以及密码子去优化等方法研制的减毒疫苗株OE4:hRSV-A2-dNS1-dNS2-△SH-dGm-Gsnullline19F,病毒高度减毒但免疫原性保持不变,形成的病毒粒子与野毒株相似,具有遗传稳定性,棉鼠试验中免疫效果和安全性优于灭活疫苗。生物技术公司Meissa Vaccines获得埃默里大学的技术授权,目前正在进行Ⅰ期临床试验。
以卡介苗为骨架表达hRSV N蛋白形成GMP rBCG-N-hRSV颗粒疫苗,单次低剂量的GMP rBCG-N-hRSV可诱导T细胞免疫应答保护小鼠免受hRSV感染[71],在人群中开展的Ⅰ期临床试验产生良好的保护效果。
3 hRSV疫苗展望
自然感染hRSV不能产生持久免疫力,易反复感染,成年人即使体内含有较高浓度的hRSV特异性抗体,仍然可以反复感染hRSV,由于hRSV自然感染后抗体中和活性较低,仅能引起短暂的部分免疫保护,不足以抵抗下一次hRSV感染,因此,即使获得安全性和有效性均较高的hRSV疫苗,能否预防婴幼儿和老年人反复感染仍需继续探讨。
虽然目前尚无上市的hRSV疫苗,但随着分子病毒学、免疫学和结构生物学的发展,hRSV感染的免疫学机理和hRSV分子特征越来越清晰,F蛋白的表位及其免疫原性也均取得了显著进展。相信在未来数年内,hRSV疫苗研发领域会有较大突破。hRSV疫苗未来上市后,市场空间值得期待。

