程序性死亡分子1 胞外区的表达及其抗血清对PCV2 增殖的影响
王林青 ,徐朋丽,陈曦艋,李洪炫,陈红英*,赵 丽
(1. 郑州师范学院分子生物学郑州市重点实验室,郑州 450044;2. 河南农业大学动物医学院,郑州 450046;3. 河南牧业经济学院动物医药学院,郑州 450046)
程序性死亡分子1(programmed death 1, PD-1)由日本京都大学的Honjo 及其同事于1992 年发现[1]。PD-1 是主要表达于活化的T 细胞、B 细胞、自然杀伤细胞、单核细胞以及间充质干细胞的一个重要的免疫抑制受体[2],PD-1 属于I 型跨膜糖蛋白,含有IgV 样结构域[3]。由于PD-1 膜近端无半胱氨酸残基,故不能形成二聚体,因此只能以单体形式出现在细胞表面[4]。
PD-1 的配体为PD-L1 和PD-L2[5-6]。研究表明PD-1 的表达与病毒的持续感染相关,一项感染慢性淋巴细胞脉络丛脑膜炎病毒的小鼠试验表明,PD-1的高表达与病毒特异性T 细胞功能障碍有关[3],同样的现象也出现在人类持续感染HIV[7]和HCV[8]中。 PD-1与其配体PD-L1结合可下调CD4+和CD8+细胞的免疫活性[9],减少IL-2 和IFN-γ 的分泌。当阻断PD-1/PD-L1 通路后,效应T细胞数量增加,功能加强[10]。研究表明PD-1/PD-L1 通路的阻断是一种治疗持续性病毒感染的有效方法[11]。
近年来,细菌、寄生虫等病原体尤其是病毒的感染,使全球猪业遭受了难以估量的经济损失。有些病毒也可以引起猪发生持续性感染,但调节机制尚不清楚。猪圆环病毒2 型(PCV2)是危害猪群健康的4 种最主要病毒性传染病原之一。PCV2 感染可引起断奶仔猪多系统衰竭综合征(PMWS),减缓猪群的生长速度,饲料产出比下降,养殖成本增加;而且破坏猪体免疫系统,导致免疫功能减弱;严重消耗机体淋巴细胞,导致免疫细胞数量减少;并出现免疫抑制,极易引起继发其他病原感染并增加其死亡率[12]。预防和控制猪圆环病毒相关疾病的常见措施主要有疫苗接种以及通过改进管理控制合并感染等。由于宿主素、外源因素及病毒自身因素等多种不同影响PCV2 的感染与复制,迄今临床上缺乏有效的抗病毒治疗措施来控制感染。
本研究首先从健康猪舌组织中克隆PD-1全基因,并表达了该PD-1 胞外段蛋白(exPD-1)和制备exPD-1 抗血清,探究其对PCV2 体外在PK-15细胞上增殖的影响,以期为研究PCV2 的致病机制提供参考依据。
1 材料与方法
1.1 组织、细胞、菌种、质粒及试验动物
健康猪舌组织和PK-15 细胞由郑州市猪重大疫病防控重点实验室保存;大肠杆菌DH-5α 和Rosetta(DE3)感受态细胞购自博迈德生物技术有限公司;克隆载体pMD18-T 及原核表达载体pET-28a 购自TaKaRa 公司。新西兰兔购自郑州大学实验动物中心。
1.2 主要试剂
Phanta Max Super-Fidelity DNA Polymerase、HiScript II1stStrand cDNA Synthesis Kit 购自南京诺唯赞生物科技有限公司;DNA Marker 2000、DNA Marker 5000、柱式动物组织总RNA 和DNA 抽提试剂盒购自上海生物工程股份有限公司;低分子量蛋白质Marker、Quick CutTMEcoR I、Quick CutTMSalI及SYBR® PremixExTaq™ II (Tli RNaseH Plus)等购自宝生物工程(大连)有限公司;DAB 显色试剂盒、SDS-PAGE 凝胶配制试剂盒购自武汉博士德生物公司;鼠源6×His 单克隆抗体(MAb)、HRP 标记的羊抗鼠IgG 购自武汉三鹰生物公司。
1.3 引物设计及合成
参照GenBank 登录的PD-1基因(NM_001204379)和PCV2基因(AY035820)序列,利用软件Primer premier 6.0 设计了5 对特异性引物(表1):引物P1/2和P3/4 分别用于扩增PD-1全基因及其胞外域(上、下游引物中分别含有EcoR I 和SalI 位点);S1/2 用于检测PD-1;PCV2F/R 和PD-1F/R 分别为检测PCV2和PD-1的荧光定量PCR 引物。引物由上海生物工程股份有限公司合成。

表1 PCR 引物序列Table 1 Primers used in this study
1.4 重组质粒pET-28a-PD-1 的构建与鉴定
利用柱式动物组织总RNA 抽提纯化试剂盒提取健康猪舌组织总RNA,将其反转录为cDNA。利用引物P1/2,经PCR 扩增PD-1全基因。将纯化的PCR产物克隆到载体pMD18-T 中并进行测序鉴定。以测序正确的重组质粒为模板,利用PD-1特异性引物P3/4,PCR 扩增PD-1胞外域。将纯化的PCR 产物与pMD18-T 连接,构建重组质粒pMD18-PD-1,并对重组质粒进行PCR 测序鉴定构建是否正确。
利用EcoR I和SalI分别酶切质粒pMD18-PD-1和载体pET28-a,将获得的PD-1胞外域片段与pET-28a 进行连接, 构建重组表达质粒pET-28a-PD-1,转化至大肠杆菌Rosetta(DE3)感受态细胞中,筛选阳性单个菌落并进行测序鉴定。
1.5 重组蛋白exPD-1 的诱导表达、纯化、复性及鉴定
将IPTG 浓度设为0.1、0.3、0.5、0.7、1.0 和1.5 mmol·L-1,诱导时间设为2、4、6 和8 h,筛选诱导重组蛋白exPD-1 表达的最佳IPTG 剂量和时间。通过尿素(0.5 ~ 9 mol·L-1)溶液来确定包涵体最佳的洗涤纯化浓度。利用不同浓度的尿素复性缓冲溶液体系 (7、6、5、4、3、2、1 和0.5 mol·L-1和PBS)进行重组蛋白的复性。SDS-PAGE 电泳检测纯化产物,用紫外分光光度计测定重组蛋白浓度。
1.6 兔抗exPD-1 血清的制备、效价的测定及其特异性的检测
首次用纯化的exPD-1 与等量弗氏完全佐剂乳化的油剂(按照每只兔体重1 kg 免疫exPD-1 蛋白1 mg)免疫新西兰兔,2 周后用exPD-1 与等量弗氏不完全佐剂制备的油剂二免。二免后2 周,第3 次免疫,免疫原同二免。三免后1 周,用间接ELISA测定抗血清效价。当血清效价达到1:12 800 时,心脏采血,分离血清,-20℃保存备用。
采用重组蛋白exPD-1 作为抗原,三免后以分离的兔抗exPD-1 血清作为一抗,HRP 标记羊抗兔抗体 (1: 3 000 稀释)作为二抗,经Western Blot检测兔抗exPD-1 血清的特异性[13-14]。
1.7 PCV2 感染PK-15 细胞后PD-1 转录水平检测
将PK-15 细胞均匀铺在12 孔培养板并接种PCV2(剂量为5.78 TCID50/0.1 mL),同时设未接种PCV2 的PK-15 细胞作为阴性对照。37 ℃吸附1 h 后,收获接毒组及阴性对照组的细胞各一孔并于-80℃冻存。其余各孔均在洗涤后加入2%细胞维持液,继续培养6、12、24、36、48 和72 h 时,收获接毒组和阴性对照组细胞,提取各组细胞的mRNA,通过荧光定量PCR 检测PCV2 感染PK-15 细胞后的PD-1转录水平[14-15]。
1.8 PD-1受体的检测及兔抗exPD-1血清对 PCV2增殖的影响
以PK-15 细胞总cDNA 作为模板,利用PD-1特异性引物S1/2,PCR 检测PK-15 细胞中的PD-1受体。PCR 反应程序为:95 ℃ 5 min,95 ℃ 45 s,60 ℃ 25 s, 72 ℃ 30 s,共35 个循环,终延伸72 ℃ 10 min,最后4 ℃ 10 min。
将12 孔培养板的PK-15 细胞分为4 组:抗exPD-1 阳性血清组、阴性血清组、PCV2 组和空白对照组。4 组PK-15 细胞分别37 ℃ 5% CO2培养2 h,后用D’Hanks 洗涤3 次。抗exPD-1 阳性血清组、阴性血清组和PCV2 组分别接种PCV2(剂量为5.78 TCID50/0.1 mL),空白对照组添加等量无血清培养液。37 ℃吸附1 h 后弃去病毒液,D’Hanks 洗涤3次,加入细胞维持液。孵育到12 h 时,收获细胞液,检测PCV2 的增殖情况,并通过荧光引物PD1F/R和PCV2F/R 进行荧光定量PCR 对PD-1转录情况进行检测[13,15]。
2 结果与分析
2.1 重组质粒pET-28a-PD-1 的构建与鉴定结果
以反转录的猪舌组织cDNA 为模板,利用引物P1/2 进行PCR 扩增PD-1全基因。结果显示,从猪舌组织中扩增出产1 条约为948 bp 的目的条带,与预期相符(图1A)。测序显示,所克隆的目的DNA 片段大小为948 bp,与GenBank 中的PD-1全长基因序列对比,PD-1全基因在634—636 位存在AAG 3 个连续碱基缺失外,其余序列与参考序列吻合一致。
以构建PD-1全基因重组质粒为模板,利用PD-1胞外域特异引物P3/4 进行PCR 扩增。结果显示,扩增出1 条约为455 bp 的片段,与预期一致(图1B)。测序结果显示,目的片段为455 bp,与克隆的PD-1全基因序列进行比对,同源性为100%,表明获得的PD-1胞外域基因序列正确。
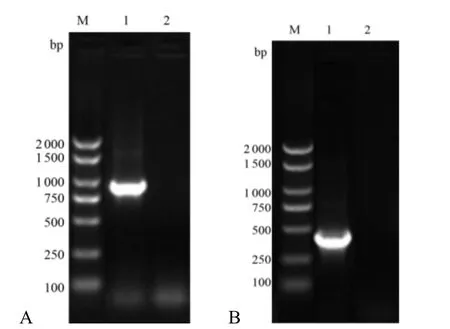
图1 PD-1 全基因(A)及胞外域(B)扩增结果Figure 1 Amplification of complete gene of PD-1(A) and extracellular region gene of PD-1 (B)
重组质粒pET-28a-PD-1 经XhoI 单酶切、电泳出现一条大小约5 824 bp 的带;经EcoR I 和SalI双酶切后电泳出现2 条带:其中一条带为载体质粒,约5 369 bp,另一条带为所克隆的PD-1胞外域基因片段,约455 bp (图2),与预期相符。测序结果证实PD-1基因胞外完全正确地插入到原核表达载体的插入位点,且读码框正确,表明重组质粒pET-28a-PD-1构建正确。
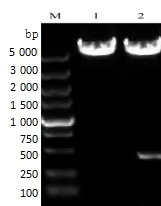
图2 重组质粒的酶切图Figure 2 Identification of the recombinant plasmids
2.2 重组蛋白exPD-1 的诱导表达、纯化、复性及鉴定结果
筛选优化 IPTG 剂量和时间结果显示,在37 ℃、IPTG 为0.5 mmol·L-1时,诱导时间8 h,重组蛋白exPD-1 表达量最高。
利用2~4 mol·L-1尿素溶液进行洗涤纯化、8 mol·L-1尿素溶液进行溶解,采用尿素溶液梯度透析对重组蛋白进行复性,最后蔗糖浓缩。经紫外分光光度计测量,重组蛋白为1.1 mg·mL-1。
SDS-PAGE 结果显示,可清晰地可见1 条约20 kDa 的蛋白条,与预期大小相一致(图3)。Western Blot 结果显示,在约20 kDa 处可见1 条特异性的棕红色阳性条带(图4),证明成功表达目的蛋白。

图3 纯化后的重组质粒pET-28a-PD-1 的表达Figure 3 Expression results of pET-28a-PD1 after purification

图4 兔多抗血清的Western Blot 检测Figure 4 The specificity of rabbits polyclonal serum by Western Blot
重组菌破碎后,上清及沉淀分别进行SDS-PAGE,沉淀中出现1 条约20 kDa 大小的蛋白,与预期结果相符,而上清并未有目的蛋白存在,说明重组蛋白主要以包涵体形式存在。
2.3 兔抗exPD-1 血清的制备、效价的测定及其特异性的检测结果
将重组蛋白exPD-1 免疫兔子3 次后,经ELISA方法检测,兔抗exPD-1血清抗体效价达到1:12 800。Western Blot 鉴定,在约为20 kDa 处有1 条特异的蛋白带,与预期结果相符,表明兔抗PD-1 血清特异性良好(图4)。
2.4 PCV2 感染PK-15 细胞后的PD-1 转录变化
PCV2 感染PK-15 细胞后,分别于0、1、6、12、24、36、48 和72 h 时收取细胞。通过试剂盒提取PK-15 细胞的总RNA 并反转录成cDNA,利用引物PD-1F/R 进行荧光定量PCR 检测,检测PD-1转录情况。结果显示,在PCV2 感染1~48 h 时,PD-1均为转录下调(图5),表明体外条件下PCV2感染可激活PD-1/PD-L1 信号通路。

图5 PCV2 感染PK-15 后PD-1 转录变化Figure 5 The transcriptional profiles of PD-1 after PK-15 cells infected with PCV2
2.5 PD-1 受体的检测结果及兔抗exPD-1 血清对PCV2 增殖的影响
利用引物S1/2,对PK-15 细胞总RNA 反转录的cDNA 进行PCR 扩增、电泳,出现1 条约377 bp的条带(图6),与预期大小相符。表明PK-15 细胞中存在PD-1受体mRNA 的转录。
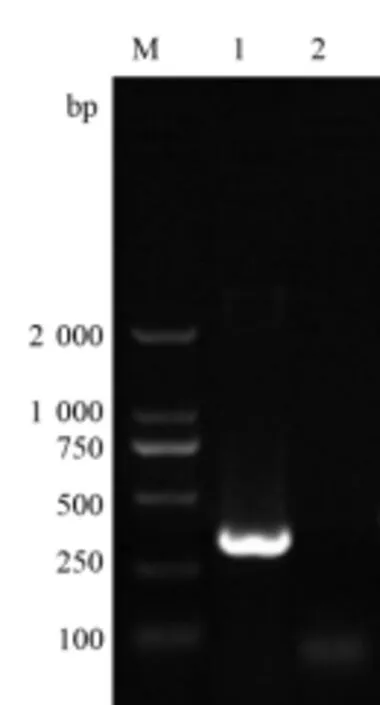
图6 PK-15 细胞中PD-1 检测结果Figure 6 Detection of PD-1 in PK-15
PCV2 感染12 h 时,收取各组细胞,通过荧光引物PD1F/R 和PCV2F/R 进行荧光定量PCR 对PD-1和PCV2进行检测。结果显示,当PD-1 受体被兔抗exPD-1 血清封闭时,抗exPD-1 阳性血清组PD-1转录水平显著上调(P< 0.01) (图7),而阴性血清组、PCV2 组与空白对照组无明显差异。而且,当PD-1 受体被封闭时,与阴性血清处理组及正常PCV2 组相比,抗PD-1 血清组PCV2 增殖明显被抑制(P< 0.01) (图8)。
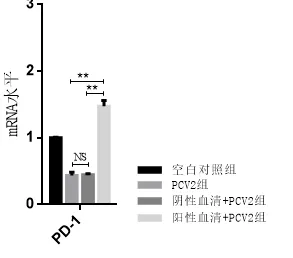
图7 PD-1 受体阻断试验检测结果Figure 7 Detection results of the PD-1 blocking test
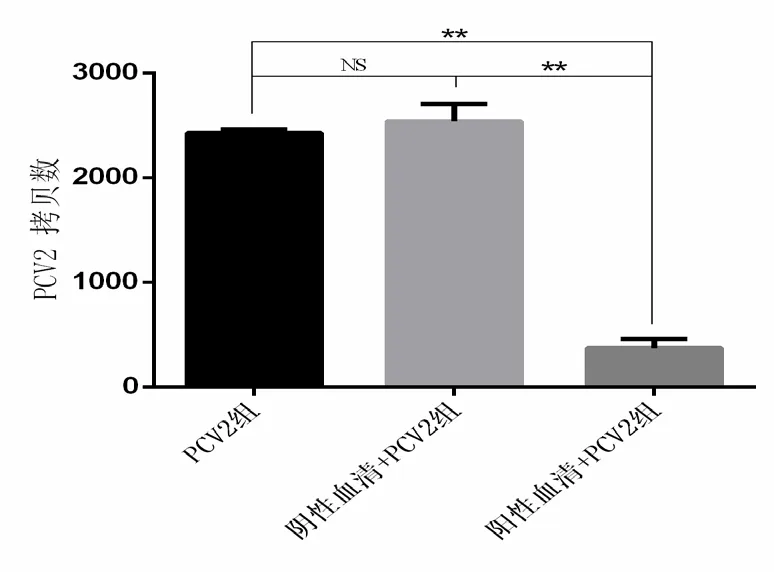
图8 PD-1 受体阻断时PCV2 的增殖情况Figure 8 Detection of PCV2 proliferation in the PD-1 blocking test
3 讨论与结论
本研究从猪舌组织中PCR 扩增获得了PD-1全基因序列,与Peng 等[16]所获全基因进行比对发现,所得PD-1全基因在634—636 位存在AAG 3 个连续碱基的缺失,但不影响蛋白的表达;以PD-1全基因为模板,PCR 扩增获得其胞外域,通过构建原核表达载体pET-28a 进行胞外域结构蛋白表达,通过对其最佳诱导时间、IPTG 最佳诱导浓度,以及纯化和复性条件的摸索最终获得重组蛋白。最佳诱导条件为,在37 ℃条件下,用0.5 mmol·L-1IPTG 诱导8 h 时,目的蛋白的产量最高。可溶性试验显示目的蛋白为包涵体,且2~4 mol·L-1尿素溶液对包涵体具有较好的洗涤效果。利用8 mol·L-1尿素溶液使包涵体蛋白完全变性溶解后,采用尿素溶液梯度透析进行蛋白复性,然后蔗糖浓缩,最终得到浓度为1.1 mg·mL-1的重组蛋白。本研究采用尿素纯化及梯度透析复性的方法,操作简便,价格便宜,同时在纯化过程中目的蛋白损耗较少,除杂彻底。并将获得的重组蛋白exPD-1 经3 次免疫新西兰大白兔制备抗exPD-1 血清。
PD-1 作为一种具有负性调节作用的CD28 家族的协同刺激受体分子,广泛表达于免疫细胞和相关组织细胞的胞膜上[17]。前期研究表明,在某些病毒感染过程中,病原可通过影响PD-1/PD-L1 信号通路的激活与抑制来诱发免疫抑制,以此来促进病毒躲避宿主机体免疫进而造成持续感染;Peng 等[16]在研究PD-1 的表达与猪病毒持续感染的关系时发现,PD-1 能够抑制IFN-γ 和IL-2 的分泌,使其分别下降64%和53%,且猪PD-1/PD-L1 交互作用表现出负调节的模式;Yue 等[18]在探究PD-1 信号通路与CSFV 感染免疫应答损害的关系中发现,当猪感染CSFV 后,猪外周血淋巴细胞中除PD-L1转录水平上调外,PD-1、IFN-γ 及IL-2 表达无明显变化;多项研究表明PD-1/PD-L1 信号通路在介导猪的免疫抑制和持续性感染中或许发挥调节作用[16,18-20]。本研究通过在体外利用PCV2 感染PK-15(非免疫细胞)细胞,初步确定了在体外PCV2感染可引起PD-1转录水平下调,证实了体外条件下PCV2 感染可激活PD-1/PD-L1 信号通路。另外,同样在体外条件下,当PD-1/PD-L1 通路被封闭时,可抑制PCV2增殖。PD-Ls 的过量表达是PMWS 引起免疫抑制的重要分子机制,通过研究PD-1 对PCV2 感染后的免疫调节,为进一步探究PCV2 的免疫抑制机理及抗病毒免疫提供了新方法和新思路,为研究PCV2的新型免疫调节佐剂和致病机制奠定实验基础,对PCV2 相关疾病的治疗和防控、开发新型细胞因子免疫调节佐剂等具有一定的市场应用潜在价值。然而,PCV2 感染时如何激活PD-1/PD-L1 通路,还有待深入探究。

