MDT模式营养支持在肝癌切除术后患者中的应用效果
王 莹 唐惠芳
(厦门大学附属翔安医院,福建 厦门 361000)
肝癌为常见恶性肿瘤之一,是肿瘤相关第3大死因,相关数据报道,全球每年新发肝癌超过80万例,其中我国占全球一半以上[1]。肝癌切除术为临床治疗的主要方法,临床应用广泛,但因患者缺乏健康知识、自我护理能力有限,导致其术后恢复效果较为不理想。同时,肝切除术后因肝功能损伤、毛细血管渗透压改变、机体高分解状态等因素影响,患者术后易并发营养不良。近年有研究发现,5%~25%的恶性肿瘤患者死因并非肿瘤自身,而是营养不良,并指出积极给予营养干预,能帮助患者改善营养状态、预后,减少并发症[2-3]。多学科协作诊治(multi-disciplinary team,MDT)是以患者为中心,通过多学科协作制定具有针对性、全方位的医疗服务[4]。基于此,本研究选取我院63例肝癌患者,以探讨MDT模式营养支持的应用效果,报道如下。
1 资料与方法
1.1 一般资料 选取我院63例肝癌患者(2020年2月至2022年1月),根据临床建档时间不同分为对照组(31例)、观察组(32例),对照组女14例,男17例,年龄38~75岁,平均(56.17±8.44)岁,肿瘤直径3~8 cm,平均(5.44±0.81)cm,受教育年限0~25年,平均(12.61±4.37)年;观察组女11例,男21例,年龄38~75岁,平均(58.04±7.26)岁,肿瘤直径3~8 cm,平均(5.48±0.76)cm,受教育年限0~25年,平均(13.15±4.08)年。两组一般资料(性别、肿瘤直径、年龄、受教育年限)均衡可比(P>0.05)。本研究经我院学术、医学伦理委员会审核批准。患者的临床资料完整,在知情同意书上签字。
1.2 纳入及排除标准
1.2.1 纳入标准 均符合肝癌相关诊断标准[5],并经术后病理检查确诊;肝功能Child-Pugh分级B级;认知功能正常;拟行肝癌切除术治疗,且耐受;认知、视听、理解能力正常;知情本研究,签署同意书;胃肠道功能正常。
1.2.2 排除标准 中枢神经系统性疾病;严重水肿;肾脏疾病;严重心脑血管疾病;药物依赖史;精神类疾病;不能正常站立、行走;不能配合研究或中途退出、失访。
1.3 方法 两组均接受腹腔镜肝癌切除术治疗。
1.3.1 对照组 接受常规营养护理干预。在术后遵医进行静脉营养液滴注,对患者进行饮食指导,如进食易消化、清淡、高蛋白等食物,并强调营养支持的必要性及对疾病治疗的重要性,促使患者保证营养。
1.3.2 观察组 在常规营养护理基础上接受多学科协作诊治(MDT)模式营养支持干预。常规营养护理同对照组,MDT模式营养支持干预具体如下。①组建小组。组建包括护士2名、疾病主治医师1名、营养科医师1名、护士长1名的小组,明确成员职责。对成员进行科室内学习、专题讲座、PPT案例分析等培训,内容包括肝癌专科知识(疾病发生机制、治疗方法、并发症、预后等)、护理干预内容(沟通技巧、护理评价依据及流程等)、营养支持相关内容(应用现状、注意事项、实施步骤、内容等),在培训结束后考核,合格后上岗。小组成员共同对患者病历、临床资料进行分析,了解、分析护理过程中可能出现的情况,制定应对措施,经查阅文献、小组讨论、结合临床实际情况、咨询专家后,为患者制订营养支持的具体流程、方案。②饮食营养干预。根据患者具体情况,营养医师为其计算日所需能量(总热量根据HarrisBenedict公式计算),制订术后饮食康复计划。指导患者多食小米、牛肉、木耳、大麦、海带、鸡肉、海蜇、大豆、猴头菇、鸭肉、香菇、蔬菜、金针菇、鲳鱼、新鲜水果、鲫鱼等,注意严格注意食物卫生,进食尽量多样化,尽量少食多餐,如禁食不新鲜、腐烂变质的食物、隔夜剩饭、生菜,以避免食物病原体污染引起的腹泻。③肠外联合肠内营养支持。第一,肠外营养支持。患者入院后,营养医师对其营养状态进行全面评估,对于较差者,在病情基本稳定、入院后1~2 d,行肠外营养干预。建立中心静脉导管,使用输入泵输注营养液,营养物质主要包括维生素、脂肪乳、微量元素、氨基酸、10%氯化钠、10%氯化钾、胰岛素等,各营养物质比例分配,混合配置后装入袋中,经输注泵输入,18~24 h,时间≤48 h,持续4~7 d后改为经口进食。第二,肠内营养支持。①干预方式。对于可经口进食者,护理人员给予口服肠内营养混悬液,能量维持2 000~2 500 kcal/d,对于无法经口进食者,根据HarrisBenedict公式计算人体静息能量消耗量、日所需营养支持总热量、日营养支持总热量,然后经鼻饲导管输注肠内营养混悬液,可根据患者代谢情况适当调整营养物质比例。②输注剂量。经鼻饲方式为患者提供营养时,应遵循“小剂量、慢速度、低浓度”原则,滴注量500 mL/d、2~3次/日,在患者适应后逐渐增加剂量,浓度由8%~10%逐渐增至20%,滴速30~50 mL/h。3~5 d后,患者若无不适,缓慢过渡至滴注纯营养液,日最大容量≤2 000~2 500 mL,调整过程中可适当增加氮含量,根据患者胃肠道功能恢复情况调整次数、剂量。患者病情稳定后,合理添加牛奶、米汤、蔬菜汤、豆浆、果汁等,2 h/次,以缓慢适应全量肠内营养,为恢复正常饮食奠定基础。③病情观察。在营养支持过程中,尤其是肠内营养干预时,护理人员需定时观察患者营养状况,了解其不良反应,如腹胀、恶心、发热、腹泻、腹痛等,评估其胃肠道耐受情况。护理人员还需定时观察、了解患者血常规、电解质、淀粉酶、肝肾功能等情况,以及时调整营养液输入剂量、浓度。④注意事项。a.每次为患者提供营养液之前,需了解胃内容物情况,若胃内营养液潴留>200 mL,则暂停输注,及时遵医提供促进胃肠蠕动药物,待病情缓解后再输注。b.及时更换输注器械,且营养液需做到现用现配、新鲜配制,每次输注前还可提前加温营养液至37~40 ℃,以减少低温营养液刺激胃肠道,从而减少不良反应。c.每次滴注营养液前,护理人员还需确定胃管位置,然后使用180~200 mL温开水、50 mL生理盐水冲洗管道,确保管道通畅,同时需妥善固定管道,以减少脱管等情况。d.在营养液输注过程中,协助其取半坐位或仰卧位,为患者抬高30°~45°床头,并使其头偏向一侧,为减少、避免胃食管反流需暂停吸痰操作。e.在营养液输注结束后,观察患者舒适情况,提前做好应对措施,以减少消化道、吸入性肺炎等并发症。两组均持续干预至患者出院并随访1个月。
1.3.3 检测方法 抽取患者5 mL静脉血,离心(3 000 r/min,半径10 cm,时间5 min)取血清,使用全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、间接胆红素(IBil)、前白蛋白(PA)、谷氨酰转肽酶(GGT)、血红蛋白(Hb)、天冬氨酸氨基转移酶(AST)、氮平衡(NB)水平。
1.4 观察指标 ①使用营养风险筛查2002(Nutritional Risk Screening2002,NRS2002)评估干预前及干预后1个月两组营养风险,总分≥3分表示存在营养风险,反之则无营养风险。②比较两组干预前及干预后1个月营养指标水平,包括血清ALB、PA、Hb、NB水平。③比较两组干预前及干预后1个月肝功能,包括ALT、IBil、GGT、AST水平。④采用肝癌患者生命质量测定量表(Quality of Life With Liver Cancer,QLICP-LI)评估干预前及干预后1个月两组生活质量,内容由共性模块和特异模块组成,共计9个维度50个条目,共性模块包括共性状态和不良反应(7个条目)、心理功能(12个条目)、社会功能(6个条目)、躯体功能(7个条目),特异模块包括特异心理方面(2个条目)、临床症状(5个条目)、全身表现(8个条目)、并发症(2个条目)、不良反应(1个条目),每个条目按1~5分计分,其中正向条目计1~5分,逆向条目反向计分,总分越高表明生活质量越好[6]。
1.5 统计学分析 采用SPSS22.0对数据进行分析,计量资料(营养指标、肝功能、生活质量)以()表示,t检验,计数资料(营养风险筛查率)以[n(%)]表示,χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 营养风险筛查率 两组干预前营养风险比较,无明显差异(P>0.05);干预后1个月,观察组营养风险发生率较对照组低(P<0.05)。见表1。

表1 两组营养风险筛查率对比[n(%)]
2.2 营养指标 两组干预前血清ALB、PA、Hb、NB水平比较,无明显差异(P>0.05);干预后1个月,两组血清ALB、PA、Hb、NB水平均降低,但观察组较对照组高(P<0.05)。见表2。
表2 两组营养指标对比()

表2 两组营养指标对比()
注:与同组干预前比较,aP<0.05;与同组干预后1个月对照组比较,bP<0.05。
2.3 肝功能 两组干预前血清ALT、IBil、GGT、AST水平比较,无明显差异(P>0.05);干预后1个月,观察组ALT、AST较对照组低,IBil较对照组高(P<0.05),GGT水平比较,无明显差异(P>0.05)。见表3。
表3 两组肝功能指标对比()
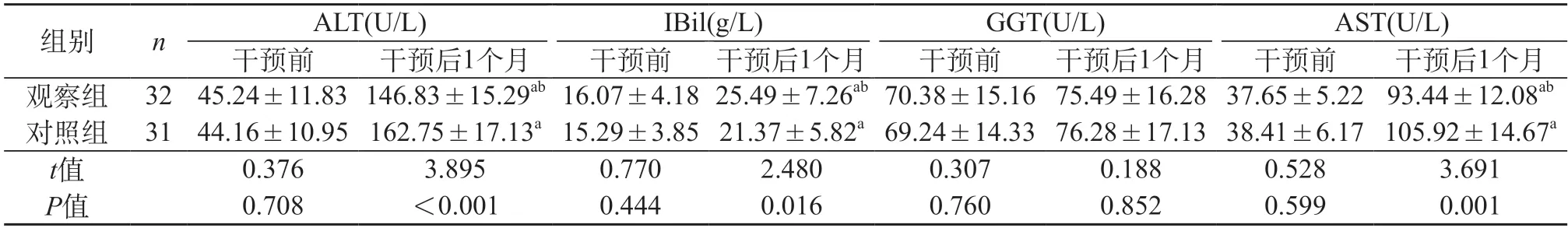
表3 两组肝功能指标对比()
注:与同组干预前比较,aP<0.05;与同组干预后1个月对照组比较,bP<0.05。
2.4 生活质量 两组干预前生活质量比较,无明显差异(P>0.05);干预后1个月,两组生活质量均提升,且观察组更为显著(P<0.05)。见表4。
表4 两组生活质量评分对比(分,)

表4 两组生活质量评分对比(分,)
3 讨论
肝癌发生后,机体处于高代谢水平,营养状态欠佳,加之手术创伤影响,易出现肝损伤,影响ALB等营养物质合成,造成患者营养不良,进而诱发代谢紊乱等,不利于后期治疗[7-8]。故而积极探索肝癌切除术后患者营养支持方式具有重要意义。
MDT模式营养支持对医疗资源进行整合,并促使医护人员发挥自身优势,如护理人员、营养科医师、疾病主治医师,通过为患者制订个性化营养干预计划,能为后续治疗奠定良好基础[9]。MDT模式营养支持为近年新兴干预方法,主要由临床医师、护理人员、营养师等组成多学科团队,从多方面如能力、专业知识、态度等实施跨部门无缝干预,通过适当地识别、沟通问题、调动各方主观能动性来实现干预效果最大化[10-11]。本研究发现,干预后1个月,观察组营养风险发生率较对照组低,且ALB、PA、Hb、NB水平较对照组高,提示MDT模式营养支持干预能有效改善患者营养状态,降低营养不良发生风险。该护理干预方案从多方面,如饮食指导、肠内及肠外营养干预等,为患者提供多形式营养支持,能有效保证机体营养水平,顺利渡过术后应激阶段;且根据患者耐受情况合理给予营养液浓度、剂量等干预,不仅能减少相关并发症,还能提高整体干预效果,进而改善营养水平[12]。
在本研究中,干预后1个月,观察组ALT、AST较对照组低,IBil较对照组高(P<0.05),表明MDT模式营养支持干预能改善患者肝功能。其主要原因可能为:营养支持能为机体自身消耗补充营养,稳定各项生命体征,从而促使各项功能恢复,同时,其还能改善患者术后新陈代谢及内分泌水平、细胞增生速度,能在一定程度上缩短肝细胞再生时间,进而加快肝功能恢复速度。另外,本研究还发现,MDT模式营养支持干预还能提高肝癌切除术后患者生活质量。
综上所述,MDT模式营养支持干预应用于肝癌切除术患者,能改善营养状态、肝功能,降低营养不良发生风险,提高生活质量。

