NKG2D基因多态性与儿童毛细支气管炎易感性及外周炎症细胞因子的关系*
顾 星,卢 薇,徐大琴,张影菊
成都市中西医结合医院儿科,四川成都 610000
毛细支气管炎的特征是反复发作的气道炎症反应、免疫球蛋白(Ig)E过度产生、黏液分泌过多和气道高反应性,全球有超过1亿的患儿[1]。越来越多的证据表明,毛细支气管炎是多因素疾病,是由多种遗传和环境因素相互作用引起的,但其详细机制尚未完全阐明[2-3]。自然杀伤细胞(NK细胞)是先天免疫系统中的特殊淋巴细胞,能够在没有抗原特异性识别和克隆扩增的情况下感知和消除病原体感染的细胞或肿瘤细胞[4]。NK细胞的功能受激活和抑制信号的平衡调节。NK细胞通过主要组织相容性复合体Ⅰ类特异性表面受体接收抑制信号,例如杀伤Ig样抑制受体和CD94-NKG2A异二聚体。NK细胞还有一系列刺激性受体,包括天然细胞毒性受体(NKp46、NKp30、NKp44)、NKG2D和其他孤儿受体。NKG2D在CD8+-a和-b细胞,以及NK细胞上表达,CD8+-a和-b细胞上的NKG2D可作为抗原识别的共刺激分子,通过NK细胞上的NKG2D发出的信号促进NK细胞活性(如增殖)[5-6]。NKG2D还通过激活信号蛋白诱导过敏性和嗜酸性介质[如白细胞介素(IL)-5、IL-13]的释放,导致嗜酸性炎症和IL-33信号减弱[7],这些数据表明NKG2D基因可能参与毛细支气管炎的发病。有研究表明,NKG2D基因多态性与儿童哮喘之间存在关系[8],但少有研究显示NKG2D单基因位点与毛细支气管炎易感性相关。本研究考虑地区和种族的差异,采用聚合酶链反应分析毛细支气管炎患儿的NKG2D基因多态性,研究其与毛细支气管炎和血清炎症因子水平的关系,为该病的预防、诊断和治疗提供依据,现报道如下。
1 资料与方法
1.1一般资料 选取2019年12月至2021年12月本院儿科收治的120例毛细支气管炎患儿作为病例组,其中男58例,女62例。纳入标准:(1)符合毛细支气管炎的诊断;(2)患儿未接受肾上腺皮质激素或免疫调节剂治疗;(3)无家族史的哮喘或其他过敏性疾病。排除标准:(1)营养不良、免疫功能低下、先天性呼吸道畸形、慢性鼻咽炎、佝偻病;(2)严重心血管疾病或其他重大疾病。另选取同期本院门诊行健康体检的98例健康儿童作为对照组,其中男50例,女48例,无任何呼吸道疾病症状。本研究按照赫尔辛基宣言进行,并经本院伦理委员会批准。所有研究对象监护人均知情同意并签署知情同意书。
1.2血常规及一般生化指标检测 抽取所有研究对象清晨空腹静脉抽血5 mL,5 000 r/min分离血清,采用贝克曼库尔特AU-680全自动生化分析仪及希森美康IX-2000全自动血细胞分析仪检测血常规及一般生化指标。
1.3NKG2D 基因的rs48965 单核苷酸多态性检测 根据制造商说明,使用基因组DNA提取试剂盒(NO.DP318,TIANGEN,Biotech,北京,中国)从外周静脉血中分离基因组DNA。Nanodrop2000检测分离的基因组DNA的浓度和纯度;使用琼脂糖凝胶电泳分析其质量和完整性。然后将 DNA 样品储存于-80 ℃。NKG2D基因位点的PCR引物均由Invitrogen(Thermo Fisher Scientific,美国)合成。NKG2D基因启动子区rs48965位点的PCR引物序列如下:正向5′-TCGATCGTGTAGTCGATCGATCGATCGTAG CTAGCTAGCTAGGGTAGCTAGCTGC-3′;反向5′-TGGGGCTGTCGCTAGCTAGCTGACTGCTGA TCGATCGATCGATGCTAGCTAGCTGCTAGTG C-3′。采用Takara LA TaqTM(代码号DRR042A)进行PCR扩增。NKG2D引物PCR扩增条件:95 ℃预变性10 min,94 ℃ 30 s,72 ℃ 1 min,共35个循环,72 ℃延伸5 min。通过琼脂糖凝胶电泳检测PCR产物,制备琼脂糖凝胶(2%)。PCR产物(5 μL)和6×上样缓冲液(1 μL)完全混合后加入上样孔,150 V电压下电泳1 h。凝胶放入数字成像显示系统。如果每对引物均能扩增到亮度均匀、特异性好、大小和位置正确的目的条带,则认为PCR扩增成功。如果没有或出现明显的非特异性条带,则认为PCR扩增失败,重复PCR扩增。PCR产物经ABI 3500xL基因分析仪检测后进行碱基测序,测序结果通过Mutation Surveyor软件进行比对分析,得到相关基因型。
1.4血清炎症因子水平检测 采用MK3酶标仪检测干扰素(IFN)-γ、IL-4、IgE水平,IFN-γ、IL-4、IgE酶联免疫吸附试验试剂盒购于上海雅吉生物科技有限公司(批号:HU-59854、NB-96547、CU-74850)。
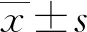
2 结 果
2.1对照组和病例组一般资料比较 病例组白细胞计数(WBC)、γ-谷氨酰转移酶(GGT)、IFN-γ、IL-4、IgE水平均高于对照组,差异均有统计学意义(P<0.05);而两组年龄、体质量指数(BMI)、收缩压、舒张压、血红蛋白(Hb)、血细胞比容(Hct)、血小板计数(PLT)、清蛋白(ALB)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、葡萄糖(GLU)、钙(Ca)、肌酐(Cr)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)等一般资料比较,差异均无统计学意义(P>0.05)。见表1。
表1 对照组和病例组一般资料比较

组别nHct(%)PLT(×109/L)ALB(g/L)AST(U/L)GGT(U/L)对照组980.49±0.05197.57±52.2439.69±3.4850.18±18.5986.28±26.52病例组1200.48±0.06198.27±54.5839.29±4.1849.29±19.36125.48±23.58t1.2961.8351.6881.33511.543P>0.05>0.05>0.05>0.05<0.001

组别nTBIL(μmol/L)DBIL(μmol/L)GLU(mmol/L)Ca(mmol/L)Cr(μmol/L)TC(mmol/L)对照组9826.48±10.505.14±2.5912.36±3.511.93±0.3389.25±10.374.48±3.75病例组12027.29±11.275.36±2.5913.21±3.592.04±0.4991.59±11.244.29±3.48t1.3981.4791.4991.0250.9391.497P>0.05>0.05>0.05>0.05>0.05>0.05
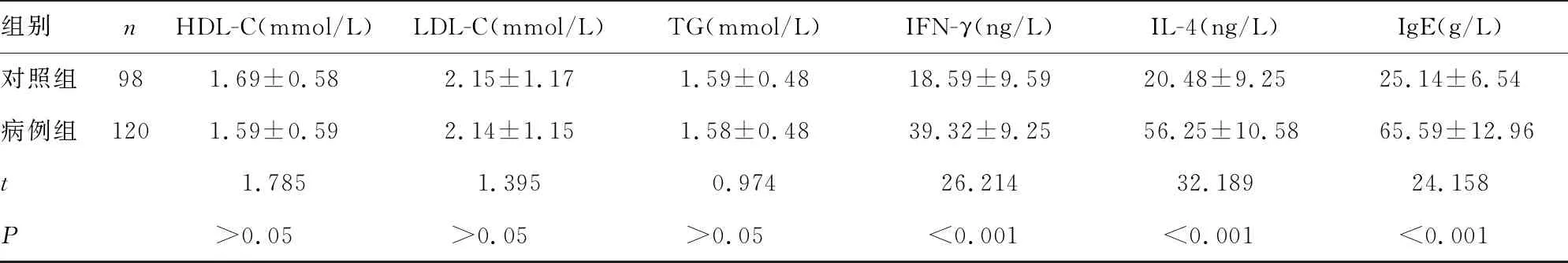
组别nHDL-C(mmol/L)LDL-C(mmol/L)TG(mmol/L)IFN-γ(ng/L)IL-4(ng/L)IgE(g/L)对照组981.69±0.582.15±1.171.59±0.4818.59±9.5920.48±9.2525.14±6.54病例组1201.59±0.592.14±1.151.58±0.4839.32±9.2556.25±10.5865.59±12.96t1.7851.3950.97426.21432.18924.158P>0.05>0.05>0.05<0.001<0.001<0.001
2.2对照组和病例组NKG2D rs48965 AA、AT、TT基因型比例比较 病例组 NKG2D rs48965 AA基因型比例高于对照组, NKG2D rs48965 TT基因型比例低于对照组,差异均有统计学意义(P<0.05)。NKG2D rs48965 AA基因型能增加儿童毛细支气管炎的易感性(OR=1.93,95%CI:1.25~2.93,P<0.05)。见表2。

表2 对照组和病例组NKG2D rs48965 AA、AT、TT基因型比例比较[n(%)]
2.3对照组和病例组 NKG2D rs48965 A、T等位基因频率比例比较 病例组 NKG2D rs48965 A等位基因频率比例高于对照组,NKG2D rs48965 T等位基因频率比例低于对照组,差异均有计学意义(P<0.05)。NKG2D rs48965 A等位基因频率能增加儿童毛细支气管炎的易感性(OR=2.29,95%CI:1.62~3.20,P<0.05)。见表3。

表3 对照组和病例组 NKG2D rs48965 A、T等位基因频率比较[n(%)]
2.4病例组NKG2D rs48965各基因型患儿IFN-γ、IL-4、IgE水平比较 NKG2D rs48965 AA基因型患儿IFN-γ、IL-4、IgE水平均高于AT、TT基因型患儿,差异均有统计学意义(P<0.05);NKG2D rs48965 AT基因型患儿IFN-γ、IL-4、IgE水平均高于TT基因型患儿,差异均有统计学意义(P<0.05)。见表4。
表4 病例组NKG2D rs48965各基因型患儿IFN-γ、IL-4、IgE水平比较
2.5儿童毛细支气管炎发生的多因素Logistic回归分析 以儿童毛细支气管炎发生作为因变量,以NKG2D rs48965等位基因频率等单因素分析差异有统计学意义的因素作为自变量进行多因素Logistic逐步回归分析,结果显示,NKG2D rs48965 AA基因型、NKG2D rs48965 A等位基因频率比例增高为儿童毛细支气管炎发生的独立危险因素(P<0.05)。见表5。
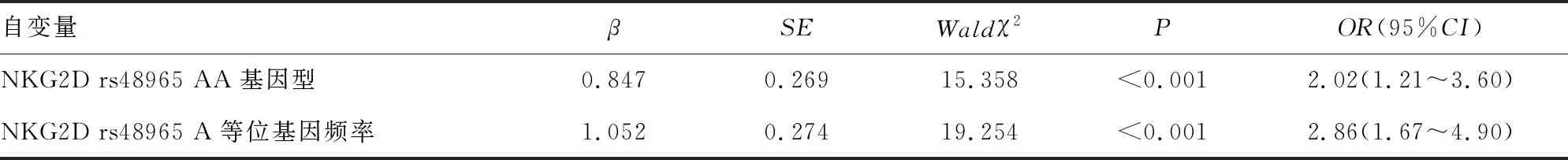
表5 儿童毛细支气管炎发生的多因素Logistic回归分析
3 讨 论
目前有研究认为,毛细支气管炎是一种多基因遗传病,具有明显的家族聚集性和较强的遗传异质性,其遗传率为60%~80%[9]。毛细支气管炎不遵循经典的孟德尔遗传定律,这往往是由多种遗传因素、环境因素及其他易感因素相互作用引起的[10],存在基因-基因和基因-环境的相互作用。有研究表明,细胞因子是毛细支气管炎发作过程中炎症细胞间重要信息的传递者,决定了炎症反应的类型和持续时间[11]。各种炎症介质对气道的作用不同,它们之间的相互作用引起并加重呼吸道高反应性和气道炎症反应,导致IgE水平升高,产生毛细支气管炎的病理、生理特征[12]。IFN-γ、IL-4在IgE合成过程中对细胞因子的调节和信号转导具有重要作用,在调节血清IgE水平和毛细支气管炎的发病机制中也起重要作用[13]。
NKG2D是一种激活的跨膜受体,由人类NK细胞和T细胞亚群表达。NKG2D信号传导参与癌症免疫监视、病毒感染防御和自身免疫性疾病,由于它们在适应性和先天免疫反应中的关键作用,NKG2D及其配体已被认为是潜在的治疗靶点。有研究表明,呼吸道合胞病毒(RSV)感染通过 NKG2D受体激活免疫系统[14],在体外将RSV感染引入人树突状细胞会导致NKG2D配体上调,并导致NK细胞增殖和IFN-γ产生,在来自BALB/c小鼠肺部的NK细胞中也得到了类似的结果。有研究表明,在RSV感染的早期阶段,NKG2D高表达和随后的IFN-γ产生与肺免疫损伤有关[15]。此外,NKG2D还可促进血管内皮细胞增殖,增加内皮细胞内血管细胞黏附分子21的表达,参与毛细支气管炎的发病机制[16]。
NKG2D直接或间接诱导肥大细胞和嗜酸性粒细胞脱颗粒产生支气管高反应性和炎症反应,在哮喘的即刻和延迟反应中起重要作用。此外,NKG2D对B细胞、T 细胞、肥大细胞和嗜酸性粒细胞均具有免疫调节作用[17]。NKG2D基因启动子区的突变C→A on-590位点与哮喘的发生有关,A等位基因可增加IgE水平。新疆维吾尔族哮喘患儿NKG2D基因-590位点T→A分析结果显示,哮喘组AA基因型儿童哮喘发病风险较TT基因型儿童增加7.91倍(OR=8.91,95%CI:1.89~41.98)[18],这些数据表明NKG2D T等位基因可能增加儿童IgE水平和哮喘发生的概率。本研究结果表明,病例组 NKG2D rs48965 AA基因型比例、A等位基因频率比例均高于对照组,NKG2D rs48965 TT基因型比例、T等位基因频率比例均低于对照组。由此表明,NKG2D rs48965 AA基因型、A等位基因频率均能明显增加儿童毛细支气管炎的易感性。
有研究发现,NKG2D基因位点与哮喘和血清IFN-γ、IL-4、IgE水平密切相关[19]。 本研究发现,毛细支气管炎患儿NKG2D rs48965位点存在TT、TA、AA 3种基因型,其基因型比例分别为18.3%、15.0%和66.7%,而对照组比例分别为55.1%、9.2%和35.7%。NKG2D rs48965 AA基因型比例高于对照组,TT基因型比例低于对照组,AA基因型能增加儿童毛细支气管炎的易感性(OR=1.93),提示AA基因型在毛细支气管炎易感性中发挥重要作用。病例组患儿IFN-γ、IL-4、IgE水平均高于对照组,差异均有统计学意义(P<0.05);NKG2D rs48965 AA基因型患儿IFN-γ、IL-4、IgE水平均高于AT、TT基因型患儿,NKG2D rs48965 AT基因型患儿IFN-γ、IL-4、IgE水平均高于TT基因型患儿,提示NKG2D rs48965基因座碱基突变与血清IFN-γ、IL-4、IgE水平相关。这说明NKG2D rs48965 AA基因型比例与毛细支气管炎患儿外周炎症细胞因子具有一定的相关性。本研究发现,NKG2D rs48965 AA基因型、NKG2D rs48965 A等位基因频率比例增高为儿童毛细支气管炎发生的独立危险因素。
综上所述,NKG2D rs48965 AA基因型、NKG2D rs48965 A等位基因能增加儿童毛细支气管炎的易感性,并且与外周炎症细胞因子具有一定的相关性。

