ApoA1/2基因多态性与HDL-C水平在老年冠心病心血管死亡与全因死亡中的交互作用研究*
李少君,李 静,于佳新,张 沛
1.河北省唐山市中医医院检验科,河北唐山 063000;2.河北省唐山市工人医院心内科,河北唐山 063000
《中国心血管健康与疾病报告2019概要》[1]显示,我国冠心病现患病人数达1 100万,城市、农村病死率分别为115.32/100 000、122.04/100 000,由其导致的心血管死亡与全因死亡成为威胁人民生命健康的首要疾病类型,防治形势严峻,因此对此进行研究意义重大。一项共纳入267 500例中国人群的队列研究随访6~19年发现,血脂异常是心血管死亡与全因死亡的相关危险因素,其中高密度脂蛋白胆固醇(HDL-C)<1.3 mmol/L时死亡风险明显增加[2]。临床工作中应用调脂药物进行预防,以期降低心血管死亡与全因死亡的风险,但一部分冠心病患者经规范调脂治疗HDL-C水平达标后,仍遗留较高的心血管剩余风险[3-4]。近年来有研究发现,遗传因素与心血管死亡和全因死亡有关[5-6]。载脂蛋白(Apo)A1、ApoA2基因多态性可影响血脂谱及调脂治疗疗效,并且与冠心病发生有关,由此推测,ApoA1/2基因多态性可影响冠心病患者的预后。基于以上背景,本研究尝试探讨ApoA1/2基因多态性与HDL-C水平在老年冠心病心血管死亡与全因死亡中的交互作用,旨在为其临床预防不良预后提供参考,现报道如下。
1 资料与方法
1.1一般资料 选取2015年1月至2016年1月唐山市中医医院收治的385例老年冠心病患者作为研究对象,其中有36例失访,男164例,女185例,年龄60~82岁,平均(68.09±5.44)岁。根据5年预后情况分为死亡组(61例)和存活组(288例)。两组患者年龄、性别、体质量指数(BMI)、民族、冠心病病程、疾病类型、美国纽约心脏病学会心功能分级(NYHA分级)、加拿大心脏病学会心绞痛严重度分级(CCSC分级)、吸烟、饮酒、合并疾病等一般资料比较,差异均无统计学意义(P>0.05)。见表1。纳入标准:符合《内科学》第8版冠心病诊断标准[7];年龄≥60岁;长期在本地居住;自愿参与本研究并签署知情同意书。排除标准:精神异常、认知障碍等无法配合本研究者;吸毒者;入组前2周有调脂药物应用史者。
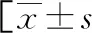
表1 两组患者一般资料比较或n(%)]
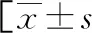
续表1 两组患者一般资料比较或n(%)]
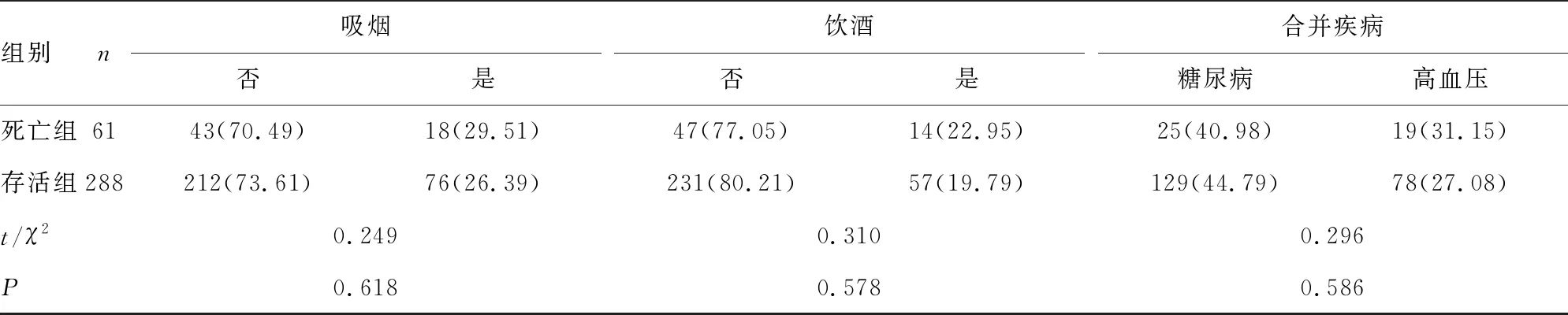
组别n吸烟否是饮酒否是合并疾病糖尿病高血压死亡组6143(70.49)18(29.51)47(77.05)14(22.95)25(40.98)19(31.15)存活组288212(73.61)76(26.39)231(80.21)57(19.79)129(44.79)78(27.08)t/χ20.2490.3100.296P0.6180.5780.586
1.2仪器与试剂 全血基因组提取试剂盒(北京艾德莱生物科技有限公司,批号:252250AX)、PCR试剂盒(美国Genecopoeia公司;批号:CO2011A)、DL2000 DNA Marker(日本Takara公司,批号:D502A)、引物合成(北京擎科新业生物技术有限公司)、全自动生化检测仪(日本日立公司,760)、离心机(美国Eppendorf公司)、实时荧光定量PCR仪(美国ABI公司,QuantStudio 6)、微量分光光度计(上海舜宇恒平科学仪器有限公司,752)、电热恒温水浴锅(北京市长风仪器仪表有限公司,HW-SY11-K P2)、全自动生化分析仪(Olympus公司AU400)。
1.3方法
1.3.1生存状态随访 本研究结局包括心血管死亡与全因死亡,根据国际疾病分类第10版(ICD-10)[8]标准,心血管死亡包括缺血性心脏病(ICD-10编码I20~I25)、脑卒中(ICD-10编码I60~I69)、其他各种类型的心血管疾病(ICD-10编码I00~I99)引起的死亡;全因死亡是指随访期间因任何一种原因所致的死亡,随访方式为电话、微信等,每位患者至少留取3名亲属的联系方式,随访时间5年。
1.3.2一般资料收集方法 采用一般资料调查表收集患者年龄、性别、BMI、民族、冠心病病程、吸烟、饮酒、合并疾病资料,其中BMI=体质量(kg)/身高(m)2,吸烟定义为每日吸烟3支或以上,吸烟史≥6个月,饮酒定义为每周饮酒≥1次,每次折合酒精量>40 g,连续饮酒≥6个月;采用NYHA分级[9]评估心功能,采用CCSC分级[10]评估心绞痛严重程度。所有参与调查人员均经过培训,调查过程遵循《调查员手册》,确保数据的客观性,数据录入时采用双录入法,并进行一致性检验。
1.3.3ApoA1/2基因多态性及HDL-C水平检测 (1)入院时采集患者外周静脉血5 mL,采用全血基因组提取试剂盒提取血细胞基因组DNA,以微量分光光度计对所提取的DNA质量进行鉴定,A260/A280为1.6~1.8符合要求。采用3%琼脂糖凝胶电泳检测DNA片段的完整性,检测的基因位点有ApoA1-75G/A、ApoA1+83C/T、ApoA2-256C/T。PCR体系包括引物、4种dNTP、Taq DNA聚合酶、靶序列DNA和PCR反应缓冲液共20 μL。ApoA1-75G/A上、下游引物分别为5′-TTAAGTTCCACATTGCCAGGAC-3′、5′-CCTCCTTCTCGCAGTCTCTAAG-3′;ApoA1+83C/T上、下游引物分别为5′-CTCCCCAGCTCAAGGTTC-3′、5′-ACACCTACCCGTCAGGAAG-3′;ApoA2-256C/T上、下游引物分别为5′-ATCAGCATCCAGGTCATTC-3′、5′-AGGAGAGGACAAGCACAT-3′。反应条件95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸15 s,30个循环,最后72 ℃延伸5 min,150 V电泳15 min后取出凝胶,紫外线投射仪上观察结果。(2)采用全自动生化分析仪检测血清HDL-C水平。
2 结 果
2.1随访结果 385例老年冠心病患者随访5年,36例(9.35%)失访,349例(90.65%)有完整随访资料。获访患者中共有61例死亡,其中36例死于心血管疾病,包括脑卒中14例,缺血性心脏病16例,其他各种类型的心血管疾病6例。
2.2两组患者ApoA1/2基因多态性与HDL-C水平比较 基因分型检测结果显示,ApoA1-75G/A基因型:GG、GA、AA;ApoA1+83C/T基因型:CC、CT、TT;ApoA2-256C/T基因型:CC、CT、TT;PCR扩增目的片段后,经琼脂糖凝胶电泳鉴定,选择条带清晰的扩增产物15 μL进行基因测序验证。采用BioEdit version5.0.6软件查看测序结果,证实ApoA1-75G/A、ApoA1+83C/T、ApoA2-256C/T均存在多态性。两组患者基因型频率符合Hardy-Weinberg遗传平衡定律检验,具有人群代表性(P>0.05)。两组患者ApoA1-75G/A基因型与等位基因分布比较,差异有统计学意义(P<0.05);两组患者ApoA1+83C/T、ApoA2-256C/T基因型与等位基因分布比较,差异均无统计学意义(P>0.05);死亡组患者HDL-C水平低于存活组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者ApoA1/2基因多态性与HDL-C水平比较[n(%)或
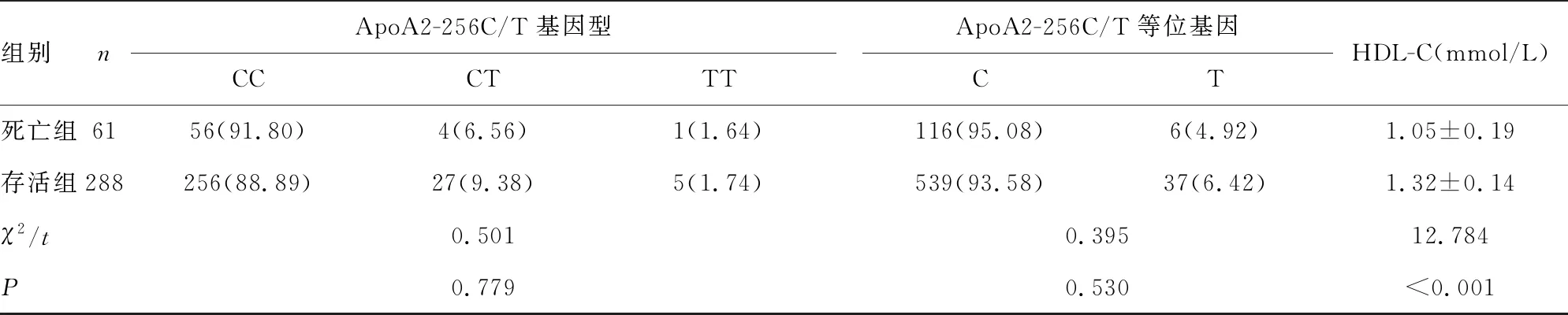
组别nApoA2-256C/T基因型CCCTTTApoA2-256C/T等位基因CTHDL-C(mmol/L)死亡组6156(91.80)4(6.56)1(1.64)116(95.08)6(4.92)1.05±0.19存活组288256(88.89)27(9.38)5(1.74)539(93.58)37(6.42)1.32±0.14χ2/t0.5010.39512.784P0.7790.530<0.001
2.3不同ApoA1-75G/A基因型患者HDL-C水平比较 ApoA1-75G/A基因型AA患者HDL-C水平为(1.58±0.10)mmol/L,高于基因型GA患者的(1.40±0.11)mmol/L和基因型GG患者的(1.24±0.13)mmol/L,差异均有统计学意义(F=75.915,P<0.001)。ApoA1-75G/A基因型AA患者、基因型GA患者和基因型GG患者HDL-C水平两两比较,差异均有统计学意义(P<0.05)。
2.4心血管死亡与全因死亡的多因素Logistic回归分析 将心血管死亡与全因死亡作为结局变量,纳入两组比较P<0.05的资料作为自变量,多因素Logistic回归分析结果显示,ApoA1-75G/A基因型GA、AA及HDL-C均是心血管死亡与全因死亡的影响因素(P<0.05)。见表3。
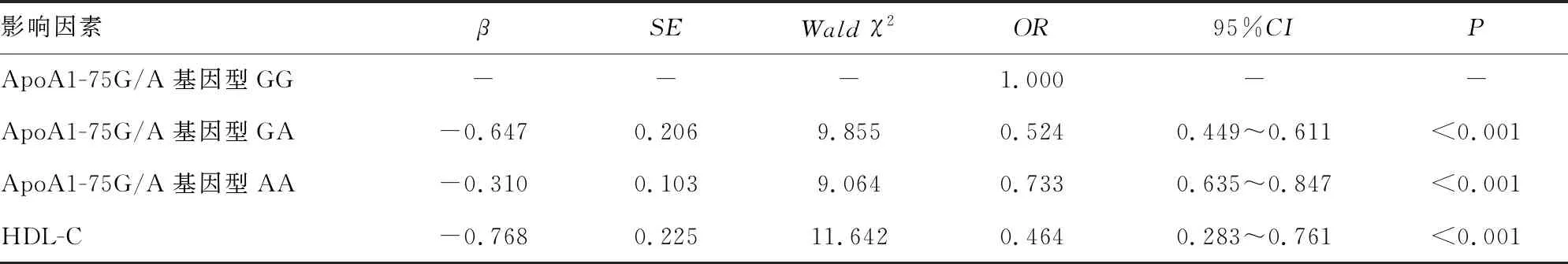
表3 心血管死亡与全因死亡的多因素Logistic回归分析
2.5ApoA1-75G/A基因多态性与HDL-C水平对心血管死亡与全因死亡的交互作用 单独HDL-C水平降低所致的OR为5.691,单独ApoA1-75G/A基因突变所致的OR为0.400,二者同时存在时,交互作用的OR为5.333,且γ为0.931,提示ApoA1-75G/A基因型GA、AA与HDL-C降低在心血管死亡与全因死亡中呈负向交互作用,即ApoA1-75G/A基因突变对心血管死亡与全因死亡的相关因素HDL-C水平降低的效应具有减弱作用;同时5.333>5.691×0.400,则ApoA1-75G/A基因突变与HDL-C水平降低交互作用符合超相乘模型。见表4。
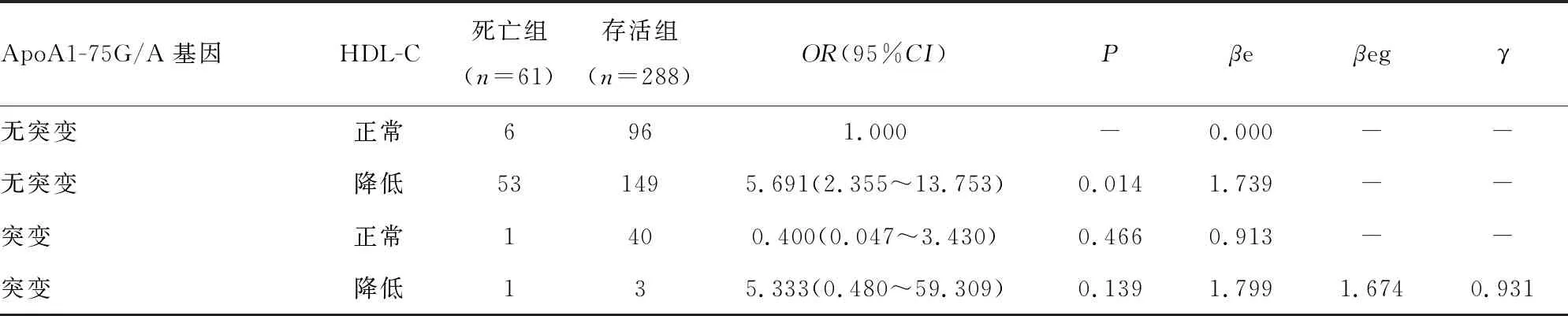
表4 ApoA1-75G/A基因多态性与HDL-C因素对心血管死亡与全因死亡的交互作用
3 讨 论
目前,关于血脂与老年冠心病发病、病情严重程度及预后的报道较多,已明确血脂代谢异常在心血管死亡与全因死亡中起消极作用,但血脂指标较多,既往报道常集中于甘油三脂和低密度脂蛋白,关于HDL-C的研究较少。本研究发现,死亡组患者HDL-C水平低于存活组,提示HDL-C水平与老年冠心病患者心血管死亡和全因死亡有关。李明卓等[11]研究显示,在血脂水平正常人群中,HDL-C水平纵向升高是冠心病的独立保护因素。HDL-C具有抗动脉粥样硬化作用,可将胆固醇从肝外转运至肝脏进行代谢,故HDL-C水平降低患者在长期生活中发生动脉粥样硬化的危险度增加,从而增加缺血性心脏病、脑卒中等的发病风险[12]。
ApoA1/2是与HDL-C密切相关的载脂蛋白类型,其中ApoA1可激活卵磷脂-胆固醇酰基转移酶,促进胆固醇释放,是胆固醇逆向转运过程的核心组分;ApoA2对胆固醇的影响目前尚存争议,部分观点认为,ApoA2可强化HDL-C保护低密度脂蛋白被氧化的功能,预防动脉粥样硬化发生[13]。部分资料显示,ApoA2不利于HDL-C的转运和抗氧化作用,促进动脉粥样硬化发展[14]。本研究发现,两组患者ApoA1+83C/T、ApoA2-256C/T基因型与等位基因分布比较,差异均无统计学意义(P>0.05),提示ApoA1+83C/T、ApoA2-256C/T基因多态性与心血管死亡和全因死亡无关。两组患者ApoA1-75G/A基因型与等位基因分布比较,差异有统计学意义(P<0.05),表明ApoA1-75G/A基因多态性与心血管死亡和全因死亡有关。且ApoA1-75G/A基因型AA患者HDL-C水平高于基因型GA患者和基因型GG患者,说明携带A等位基因的冠心病患者HDL-C水平较高。DE LUIS等[15]研究发现,ApoA1-75G/A基因多态性与饮食诱导的胰岛素抵抗有关,并获得了A等位基因携带者在低热量饮食后HDL-C水平升高的额外证据,本研究的观点与之存在相似之处。另一项研究显示,ApoA1-75G/A与代谢综合征有关,未携带A等位基因的男性表现出高比例向心性肥胖、低水平HDL-C和高血糖,而肥胖、低水平HDL-C和高血糖均可导致动脉粥样硬化,引发心血管死亡[16]。PANDITH等[17]研究显示,ApoA1-75G/A基因型在发生急性心肌梗死与未发生急性心肌梗死患者中比例相似,与急性心肌梗死无关,本研究结论与之不一致,一方面可能是因为种族、国度不同;另一方面是以急性心肌梗死为结局事件。本研究是以全因死亡与心血管死亡为结局事件,可能导致了研究结论不同,仍需后续纳入多种族、多国度人群进行进一步验证。
在以上研究基础上本研究还发现,ApoA1-75G/A基因型GA、AA与HDL-C水平降低在心血管死亡与全因死亡中呈负向交互作用,即ApoA1-75G/A基因突变可减低因HDL-C水平降低对心血管死亡与全因死亡的影响效应,ApoA1-75G/A基因突变与HDL-C水平降低的交互作用符合超相乘模型。分析其原因发现,ApoA1-75G/A基因位于ApoA1基因启动子区的第75个碱基,相对于野生GG基因型,突变杂合子与突变纯合子中的A等位基因可能影响了转录因子与启动子的识别,使ApoA1基因转录活性降低,抑制了动脉粥样硬化的进程,进而对老年冠心病心血管死亡与全因死亡起保护作用,但其确切的机制需要更为系统和深入的研究证实。本研究也有一定局限性,如样本量小,研究对象人群来源国度单一,可能造成统计数据偏倚,缩小了研究成果适用范围,仍需后续多中心、多国度随机对照研究进一步验证。
综上所述,ApoA1/2基因多态性、HDL-C水平均与老年冠心病患者心血管死亡与全因死亡有关,且ApoA1-75G/A基因突变可减低因HDL-C水平降低对心血管死亡与全因死亡的影响效应,呈现出预后保护作用。

