发酵型猕猴桃茶果酒工艺
廖傅平
(福建省邵武市进士碎铜茶业有限公司,福建 邵武 354000)
茶作为世界三大无醇饮料之一,含有多种营养成分及功能因子。其中茶多酚为茶叶的主要功能性成分,占干物质总量20%~30%,茶叶中还含有30 多种氨基酸,总含量为3%~5%[1]。茶多酚能明显抑制血清胆固醇[2],具有消炎抑菌、降低血脂、降血糖、降血压、抗衰老、抗辐射及防癌等作用[3]。研究表明,猕猴桃果实含有丰富的微量元素、矿物质、氨基酸等,具有降血压、降血脂、防癌治癌及治疗烧伤等作用[4]。
虽然茶酒[5-8]或猕猴桃果酒[9-21]研究已逐渐兴起,但将茶与水果结合发酵的茶果酒研究却少之又少。以武夷山特有的肉桂茶和市售的新鲜猕猴桃为主要原料,通过向经过微波浸提的茶汤中加入鲜榨猕猴桃汁,接种酵母菌发酵,制得具有茶香、口感香甜、富含茶多酚的发酵酒。猕猴桃茶果酒不仅符合现在人们对健康饮食的追求,而且口感独特,同时为充分开发中低档茶叶提供很好的加工方法。
1 试验材料与方法
1.1 材料与试剂
猕猴桃、小苏打、柠檬酸、蔗糖、肉桂茶叶等均为市售;安琪果酒专用酵母,安琪酵母股份有限公司。
1.2 仪器与设备
粉碎机FW100,天津市泰斯特仪器有限公司;WP-UP-UV-20 纯水机,四川沃特尔科技发展有限公司;OHAUS(STARTER 3C) pH 计,奥豪斯仪器(上海)有限公司;POCKET REFRACTOMETER PAL-1 糖度计日本制造;循环水多用真空泵SHB-Ⅲ,郑州长城科工贸有限公司;电子天平CP4102,上海精密科学仪器有限公司;蒸馏装置,上海精密科学仪器有限公司;恒温培养箱ZDP-AZ2050A,上海慧泰仪器有限公司;海尔冰箱BCD-206TCX N,海尔集团;酒度计,上海精密科学仪器有限公司;苏泊尔榨汁机,浙江苏泊尔股份有限公司;恒温水浴锅HH-4,常州国华电子有限公司;净化工作台SW-CJ-IFD,苏州净化设备有限公司等。
1.3 方法
1.3.1 工艺流程
1.3.2 操作要点
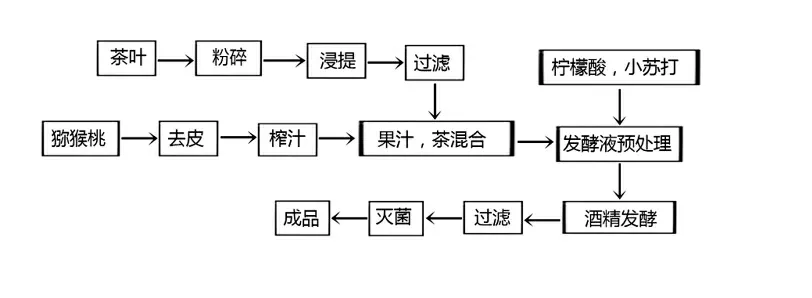
1)茶叶的萃取
采用微波辅助萃取法[22]提取茶叶中的茶多酚和其它元素,萃取前将茶叶粉碎,按比例加入纯水,微波加热5 min 使茶叶中的可溶物尽量溶出,待茶汤稍微冷却后抽滤出茶汤。
2)猕猴桃的选取与榨汁
选取成熟无腐烂猕猴桃,去皮后用榨汁机捣碎。
3)发酵液的预处理
猕猴桃汁和茶汤按一定比例混合,混合发酵液用柠檬酸和小苏打调节发酵初始pH 值,加入80 g 的蔗糖,蔗糖的加入可提高发酵液的糖度,最后加入果酒酵母。
4)发酵后的过滤
发酵完成后,用四层纱布过滤。
5)灭菌
巴斯德灭菌法,即将发酵过滤后的茶果酒装瓶,放在水浴中,中心温度63 ℃,保持20 min。
1.3.3 猕猴桃茶果酒品质评定方法
1)理化指标测定方法
酒精度测定参照GB/T 15038—1994 《葡萄酒、果酒通用试验方法》,总酸测定参照《酿酒分析与检测》[23],总糖的测定采用糖度计测量,金属含量测定采用火焰原子吸收光谱法。
2)感观品质的评价方法
对茶果酒进行感官评价,并分别对茶果酒外观、香气、口感,及整体风格进行评分[24],感官评价评分表如表1 所示。
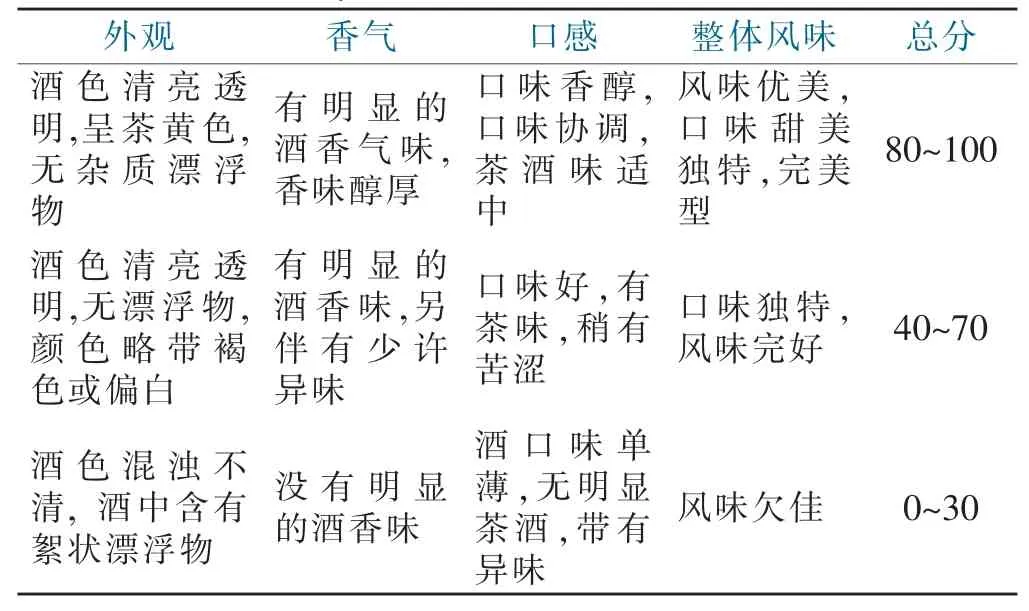
表1 猕猴桃茶果酒感官评价标准Tab.1 Sensory evaluation criteria of kiwi fruit wine
1.3.4 猕猴桃茶果酒工艺优化单因素实验
分别选取猕猴桃果肉与茶汤比1∶3、接种量3%、初始pH 值3.5、发酵温度26 ℃为试验基本条件,以发酵液糖度为测定指标,重复测定3 次取平均值。
1.3.5 猕猴桃茶果酒工艺优化正交实验设计
在单因素基础上试验基础上,采用L16(44)正交表,设计4 因素4 水平试验,优化发酵工艺条件,请十名参与者对猕猴桃茶果酒外观、香气、口感,及整体风格进行感官评价,重复3 次,感官得分以平均值计,感官评价标准如表1 所示。正交试验因素和水平如表2 所示。

表2 优化发酵条件正交试验因素与水平Tab.2 Factors and levels of orthogonal test for optimization of fermentation conditions
2 试验结果与分析
2.1 单因素试验结果分析
2.1.1 猕猴桃果肉与茶汤比对发酵的影响
固定温度、接种量、pH 值在猕猴桃果肉与茶汤比分别为1∶2、1∶3、1∶4、1∶5 的条件下发酵,发酵过程糖度的变化如图1 所示,从图中可以看出当猕猴桃果肉与茶汤比为1∶1 时虽然发酵速率适中,但启动发酵速率过慢且发酵并不彻底。而猕猴桃果肉与茶汤比为1∶3 和1∶4 时均为发酵速率过快,过快的发酵不利于发酵液中风味物质的形成[25],不利于茶果酒的品质。反观1∶2的猕猴桃果肉与茶汤比无论是启动发酵还是中后段发酵速率都适中,发酵的周期适中,对茶果酒的品质有益,是四个猕猴桃果肉与茶汤比最适合的一个。

图1 不同发酵液配比对发酵的影响Fig.1 Effects of fermentation broth ratio on sugar content of fermentation broth
2.1.2 发酵液pH 值对发酵的影响
固定温度、接种量、猕猴桃果肉茶汤比在发酵初始pH 值分别为3.0、3.5、4.0、4.5 的条件下进行酒精发酵,发酵过程糖度变化如图2 所示。可看出pH 值对发酵的影响并不如猕猴桃果肉茶汤的大,但依旧有差别,初始pH 值为4.0 和4.5 是发酵启动较慢,整体发酵速率都偏慢。而pH 值为3.0 和3.5 时发酵速率适中,但pH 值为3.5 时发酵比3.0 彻底。因此发酵pH值选3.5 最合适。
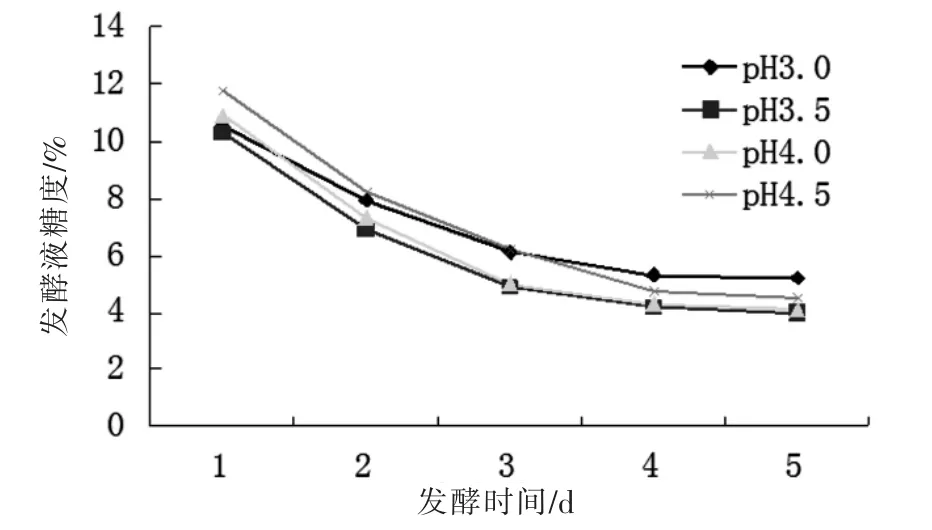
图2 不同初始pH 值对发酵的影响Fig.2 Effects of pH value on sugar content of fermentation broth
2.1.3 接种量对发酵的影响
固定发酵温度,猕猴桃果肉与茶汤比,初始pH 值在接种量分别为1%、3%、5%、9%的条件下进行发酵,发酵过程中糖度的变化如图3 所示。从图中可以看出接种量为9%和5%时发酵速度过快,发酵周期短,接种量为1%时发酵速率最慢,这个速率无论是从启动发酵还是中期发酵速率都却比较适合发酵。而3%的接种量虽然也可以作发酵接种量,但在发酵中后期速度偏快且考虑的成本的问题所以应舍弃,因此最适的接种量为1%。
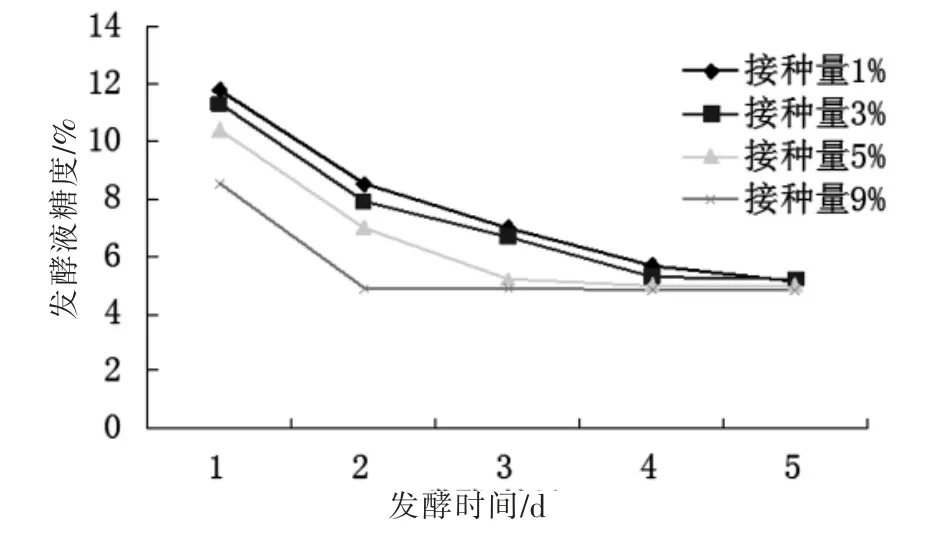
图3 不同酵母接种量对发酵的影响Fig.3 Effects of yeast agent on sugar content of fermentation broth
2.1.4 温度对发酵的影响
固定猕猴桃果肉与茶汤比,初始pH 值和接种量三个因素,进行发酵温度分别为20、23、26、30 ℃的单因素实验。温度单因素实验过程时,由于20 和22 ℃的发酵较缓慢,导致整批数据相比其他因素长了两天,过长的发酵时间增大发酵液中杂菌污染的风险[22],且无益于酒风味的形成,发酵过程中糖度变化如图4所示,综合启动发酵速率,发酵速率,发酵周期考虑,26 ℃为最适发酵温度。
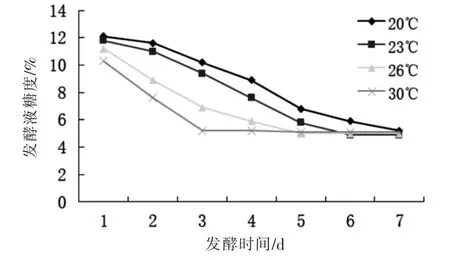
图4 不同温度对发酵的影响Fig.4 Effects of fermentation temperature on sugar content of fermentation broth
2.2 正交试验结果分析
采用L16(44)正交试验综合考察4 个因素对猕猴桃茶果酒品质的影响,试验结果如表3 所示。

表3 猕猴桃茶果酒正交试验结果Tab.3 Orthogonal test results of kiwi fruit tea wine
由极差分析可知,影响猕猴桃茶果酒品质的主次因素顺序为:猕猴桃果肉茶汤比>发酵温度>发酵液初始pH 值>接种量。猕猴桃茶果酒发酵制备的最佳工艺条件组合为:A3B2C2D2,对结果分析后得到最终工艺参数为接种量1%、发酵温度26 ℃、猕猴桃果肉与茶汤比1∶2、初始pH 值为3.5。
为验证所得结果的正确性,在最佳条件组合下进行3 次重复试验,得到酒液酒精度5.6%,可溶性固形物4.35%,pH 值为3.9,总酸度5.7 g/L,样品中重金属铅铜含量均低于相应的国家标准[26]。
3 结论
在单因素试验基础上,采用正交试验进行分析确定猕猴桃茶果酒较佳工艺组参数:猕猴桃果肉与茶汤比1∶2、接种量1%、初始pH 值3.5、发酵温度26℃。在此条件下,酒液酒精度5.6%,可溶性固形物4.35%,pH 值为3.9,总酸度5.7 g/L,感官评分93 分,茶果酒呈淡黄色,酒色透明清亮,酒香味明显,口感香醇,符合人们对健康饮品需求。

