垂体促甲状腺激素混合瘤合并甲状腺自身抗体阳性一例
黄怡静 温小明 梁欣欣 徐玲玲
患者,男,36岁,因“发现垂体占位1个月”于2021年8月21日入院。患者曾于3年前体检时发现甲状腺功能(简称甲功)异常,2年前无明显诱因出现心悸、多汗、怕热及脾气改变(易怒),当时未予重视及诊治。1个月前因骨质疏松至外院复查,发现甲功异常[血清游离三碘甲腺原氨酸(FT3)12.36 pmol/L(3.09~7.42 pmol/L,括号内为正常参考值范围,以下相同),血清游离甲状腺素(FT4)31.45 pmol/L(7.64~16.03 pmol/L), 总三碘甲状腺原氨酸(TT3)3.75 nmol/L(1.01~2.48 nmol/L),总甲状腺素(TT4)217.04 nmol/L(69.97~152.52 nmol/L),促甲状腺激素(TSH)1.411μIU/ml(0.38~5.33μIU/ml)],甲状腺自身抗体[抗甲状腺球蛋白抗体(TGAb)、甲状腺过氧化物酶抗体(TPOAb)、促甲状腺激素受体抗体(TRAb)]均为阳性,进一步行垂体磁共振(MRI)增强结果提示垂体右份大腺瘤。口服甲巯咪唑2天后停药,为进一步诊治遂于我院就诊。患者近期体重无明显下降。1年前因外伤骨折发现严重骨质疏松,服用补钙及补充活性维生素D类药物治疗,无其他特殊病史,患者父母甲功检查及甲状腺抗体检查均未见异常。入院体格检查无明显异常。实验室检查:血常规、尿便常规、肝肾功能、血脂均未见明显异常。24 h尿游离皮质醇1 089.18 nmol/24 h(53.20~876.30 nmol/24 h),血8AM皮质醇172.69 nmol/L(7Am~9Am117.75~686.85 nmol/L)、8AM促肾上腺皮质激素(ACTH)12.43 pg/ml(7Am~9Am 7.20~63.40 pg/ml);甲状腺功能:FT37.89 pg/ml(2.00~4.40 pg/ml)、FT43.02 ng/ml(0.93~1.70 ng/ml)、TT32.2 ng/ml(0.8~2.0 ng/ml)、TT414.81 μg/dl (5.10~14.10 μg/dl )、TSH 1.60mIU/L(0.27~4.20mIU/L)、TPOAb 170.20 IU/ml(<34.00 IU/ml)、TRAb 2.60 IU/L(<1.75 IU/L)、TGAb 437.10 IU/ml(<1150.00 IU/ml)、胰岛素样生长因子1(IGF-1)768.0 ng/ml(109.0~284.0 ng/ml),生长激素(GH)及性激素结合球蛋白(SHBG)水平在正常范围,性激素五项[卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、泌乳素(PRL)、睾酮(Testo)]均未见异常,总Ⅰ型胶原氨基端延长肽(P1NP)88.00 ng/ml(9.06~76.24 ng/ml),同时段血钙(Ca)、血磷(P)、甲状旁腺素(PTH)、降钙素(CT)均未见明显异常。胸部正侧位片未见明显异常。甲状腺超声结果:甲状腺实质回声不均匀;甲状腺右侧叶实性结节,甲状腺影像报告和数据系统的分级标准(TI-RADS)分级:Ⅲ类;甲状腺周围未见明显肿大淋巴结。甲状腺放射性核素平面显像(ECT)结果:甲状腺轻度增大,形态及位置正常,甲状腺双叶显像剂分布欠均匀;甲状腺内未见明显局限性显像剂分布浓聚、稀疏或缺损影,甲状腺右叶下极凉结节。垂体MRI增强结果:考虑垂体大腺瘤(图1)。眼科视野检查未见异常。为进一步明确诊断及治疗,患者遂至广东省人民医院就诊,住院期间奥曲肽抑制试验结果:24 h TSH较0 h的抑制率为73%,24 h TSH较2 h的抑制率为62%。甲状腺素受体β基因突变检测未见异常。初步诊断为垂体TSH瘤,于2021年9月22日在该院行经蝶入路内镜下垂体部分切除术,术前继续予奥曲肽每次0.1 mg、每12 h 1次治疗。术后垂体MRI增强结果:垂体术后改变;考虑蝶窦血性积液。术后病理组织切片结果提示垂体腺瘤;免疫组化结果:ACTH(-)、FSH(-)、TSH(部分+)、hGH(弥漫+)、LH(-)、Prolactin(弱+)、Ki67(<1%+)、CK(点状+)。明确诊断为垂体TSH混合瘤。患者术后1个月复查TSH 0.85 mIU/L、FT35.39 pg/ml、FT42.4 ng/ml,甲状腺抗体仍为阳性,IGF-1 350 ng/ml,P1NP 86.30 ng/ml;SHBG水平较前下降,性激素、皮质醇、ACTH水平均未见异常。术后2个月复查TSH 0.96 mIU/L、FT35.76 pg/ml、FT42.19 ng/ml。术后3个月复查垂体MRI增强结果:垂体瘤术后改变,未见明显肿块影(图2)。术后8个月复查TRAb、SHBG水平均明显升高,FT325.26 pg/ml,FT4>7.77 ng/ml,TSH 0.145 mIU/L;甲状腺ECT结果:甲状腺中度增大,摄锝增高(图3),提示甲功亢进,考虑合并Graves病;垂体MRI增强检查提示垂体瘤术后改变,未见明显肿块影。予抗甲状腺药物甲巯咪唑每次10 mg、每日2次口服治疗。治疗1个月后(2022年7月1日)复查甲功提示FT37.34 pg/ml、FT42.73 ng/ml,甲状腺自身抗体水平仍升高。术后11个月复查垂体MRI增强结果同前。
讨 论
垂体TSH瘤表现为FT3、FT4水平升高而TSH不被抑制,其在垂体瘤中占比在0.5%~2.0%,发病率约1/100万人,70%的垂体TSH瘤仅分泌TSH,其余30%为混合瘤,可同时分泌TSH及其他垂体前叶激素,GH和(或)PRL最常同时分泌[1]。垂体TSH瘤需与甲状腺激素抵抗(RTH)相鉴别,本例患者垂体影像学检查可见占位性病变,且无甲状腺疾病家族史(父母甲功及抗体水平均正常),未见甲状腺素受体β基因突变,因此不支持RTH。本例患者奥曲肽抑制试验结果显示TSH被抑制,提示TSH腺瘤可能,目前奥曲肽抑制试验方法及结果判定尚未统一标准[2]。据文献报道,24 h TSH较2 h的抑制率最佳诊断截点为44.46%[3]。本例患者在广东省人民医院行奥曲肽抑制试验24 h TSH较2 h的抑制率为62%,支持TSH瘤的诊断,且应用生长抑素类似物可改善TSH瘤分泌,可在术前应用[4]。
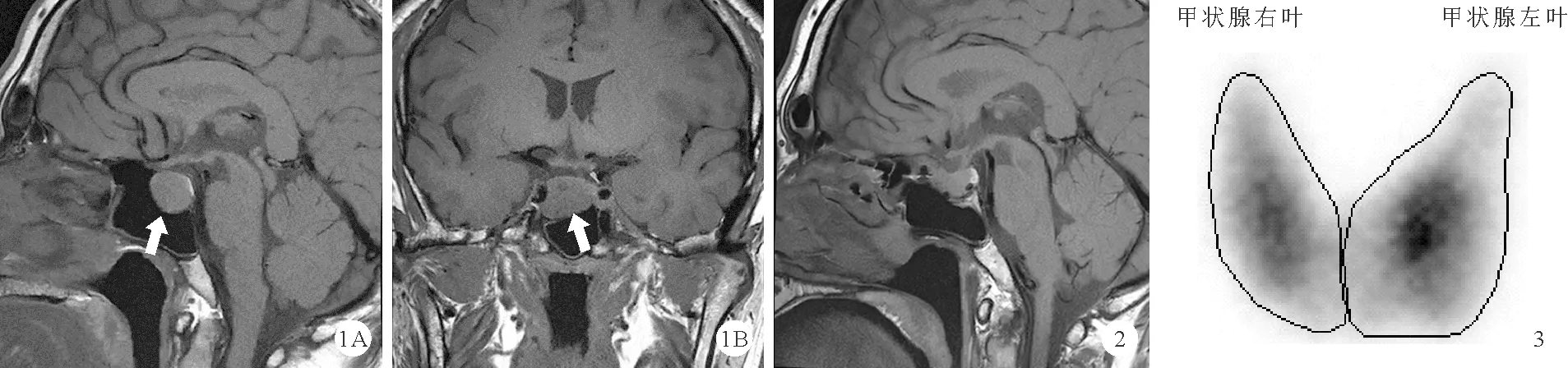
图1 2021年8月23日我院垂体MRI增强检查结果:垂体窝内病灶,如箭头所示;A:矢状位,B冠状位(T1加权像) 图2 2021年12月30日(术后3个月)我院复查垂体MRI增强结果 图3 2022年5月30日(术后8个月)我院复查甲状腺ECT结果
本例患者诊断垂体TSH瘤合并TRAb阳性,术后检查甲状腺抗体仍为阳性,考虑合并Graves病。垂体TSH瘤合并Graves病极为罕见,检索文献发现迄今仅有8例经病理诊断明确TSH瘤合并Graves病的病例报道[5-12]。Arai等[11]报道,TSH瘤合并Graves病患者采用外科手术切除垂体TSH瘤后,未应用抗甲状腺药物治疗,患者TSH、FT3、FT4水平逐渐正常,且TRAb水平逐渐下降,可能原因为异常过度分泌的TSH可产生导致Graves病的特异性抗体[12],手术使TSH分泌正常可改善其联合Graves病所致的甲状腺毒血症。然而,四川大学华西医院曾报道TSH瘤合并Graves病男性患者,因存在Graves病的临床表现及体征、甲状腺激素升高、TSH水平降低及TRAb阳性,予抗甲状腺药物治疗后,患者表现不同于一般Graves病患者,在FT3、FT4水平恢复正常时出现TSH水平显著升高,进而逐步诊断垂体TSH瘤。该患者在TSH瘤术后TSH、FT3、FT4水平逐步恢复至正常范围,而TRAb、TGAb、TPOAb仍为阳性,术后1年Graves病复发,复查垂体MRI未见肿瘤残留,再次予抗甲状腺药物治疗,但随后3年的随访均可见垂体MRI提示肿块占位,不排除TSH瘤复发[5]。本例患者术后1个月及2个月TSH、FT3、FT4水平均有所下降,但一直未降至正常范围,术后8个月复查甲功及自身抗体结果提示甲亢、Graves病复发,因此我们将持续随访以观察患者甲功及抗体的变化。
文献检索发现以青年男性骨质疏松此不典型症状起病的TSH瘤,骨质疏松可继发于甲亢,TSH作为独立因素控制骨形成及骨吸收,TSH抑制破骨细胞形成,并抑制成骨细胞分化和抑制Ⅰ型胶原的表达[13],与本例一致。本例患者应用生长抑素类似物作术前准备,未见手术禁忌征,首选经蝶窦入路垂体腺瘤切除手术,彻底根治肿瘤,术后患者恢复可,复查垂体MRI未见明显残留。患者术后Graves病应用抗甲状腺药物甲巯咪唑,可导致TSH升高,后续仍需定期复查垂体MRI以排查有无垂体瘤复发可能。若有上述情况,可采用药物治疗(如生长抑素类似物)及放射治疗。本例患者经术后病理组织切片检查证实为混合瘤,分泌的垂体前叶激素包括TSH、GH、PRL,术前患者实验室检查中PRL水平不高,GH基础值正常而IGF-1水平升高,仅表现为甲功亢进症状,无肢端肥大表现,后续应继续随访。甲状腺激素作用于周围靶腺组织相关指标(如肝脏的SHBG、P1NP),可在TSH瘤患者中检测到其水平升高,而本例患者SHBG水平不高,依据文献可能与其共同分泌GH相关,因GH可有效地抑制SHBG分泌[14]。本例患者的诊治过程提示,当FT4、FT3水平高于正常范围,且TSH水平不被抑制时,提示有TSH腺瘤可能,如同时出现甲状腺抗体阳性则需警惕合并甲状腺自身免疫疾病可能。

