小鼠肾小管上皮细胞来源外泌体改善脓毒症肾脏损伤炎症反应的研究
徐志育 朱永 田佳 李娜 宋海
微生物感染及免疫失衡与化脓性疾病的发生密切相关,其内在机制尚未明确[1-2]。相关研究表明,免疫细胞的持续组织浸润可触发细胞分泌囊泡的生物合成,从而导致细胞外囊泡包括外泌体(EXO)分泌增加[3]。EXO是一种直径约为50~100 nm的囊泡。近年来,随着EXO介导组织修复作用的深入研究,发现有些EXO可进入细胞并通过刺激中性粒细胞从而抑制细胞炎症[4-5]。然而,仍缺乏有关肾脏中EXO对脓毒症影响的研究证据。因此,本研究将探讨肾小管上皮细胞(mRTEC)来源外泌体(mRTEC-EXO)对脓毒症小鼠肾脏的炎症损伤和中性粒细胞浸润的影响。
材料与方法
1.材料:EXO分离试剂(美国Invitrogen 4478359)、杜氏改良培养基(DMEM)、脂多糖(LPS)均购于美国Sigma公司。胚胎肾(EK)细胞和mRTEC均购于美国模式培养物保藏所(ATCC)。兔抗-分化抗原簇(CD)9、CD63、钙联接蛋白(CANX)、髓过氧化物酶(MPO)的蛋白抗体均购于美国Abcam公司。
2.方法
(1)制备mRTEC-EXO:mRTEC用DMEM常规培养。收集传代第4代mRTEC的培养上清液,转移至高速离心管中,在4 ℃、2 000 g下离心30 min后取上清液1,转移至新的高速离心管中,加入EXO分离试剂(上清液1∶分离试剂=2∶1),于涡旋仪(美赛默飞世尔公司)上充分混合后,置于4 ℃冰箱中孵育过夜。次日在4 ℃、10 000 g下离心60 min,弃上清液,将其悬浮在4 ℃的100 μl磷酸盐缓冲液(PBS)中作为EXO悬浮液,并保存在-80 ℃冰箱中,即为mRTEC-EXO。
(2)mRTEC-EXO的表征:按照透射电镜平台工作协议和指示使用透射电子显微镜观察EXO的形态并拍照。采用动态光散射法(DLS)测量EXO的粒径和电势。
(3)EK细胞与mRTEC-EXO共培养:室温下将EK细胞培养于添加10%PBS和1%抗生素的DMEM培养基中,湿度为95%,CO2浓度为5%。将mRTEC-EXO用细胞膜红色荧光探针(DiL)染色30 min,用PBS洗涤,于10 000 g持续离心60 min后,将其与培养的1×104/ml的EK细胞共孵育1、2和4 h后用细胞核染色剂4’,6-二脒基-2-苯基吲哚(DAPI)染色10 min,用PBS清洗后并通过共聚焦显微镜观测EXO是否被EK细胞摄取。
(4)动物分组:84只SPF C57BL/6小鼠购于海南医学院实验动物动心[使用许可证号:SYXK(琼)2021-0013],自由饮食适应性饲养1周后,将其随机分为对照组[腹腔注射生理盐水(NS)180 mg/kg]、LPS组(腹腔注射LPS 15 mg/kg)、LPS+mRTEC-EXO组(腹腔注射LPS 15 mg/kg同时尾静脉注射mRTEC-EXO 8 mg/kg),每组28只。NS注射后或LPS干预12 h后,随机处死各组小鼠均12只并收集新鲜肾脏组织,保存于-80 ℃冰箱内。每组剩余的16只小鼠进行正常饮食、饮水饲养,继续观察至150 h,记录每组小鼠存活情况。所有动物实验均获得我院动物伦理委员会审核批准。
(5)小鼠肾脏炎症情况和中性粒细胞浸润情况:使用10%的福尔马林固定小鼠肾脏组织,经石蜡包埋,并行常规切片,厚度为5 μm,对切片使用HE及免疫组化染色,观察肾小管、肾小球形态变化和肾小管间质炎性细胞浸润程度。用MPO表达水平评估中性粒细胞的浸润程度。
(6)蛋白质免疫印迹法(Western blot)检测蛋白表达水平:采用Western blot检测mRTEC-EXO中EXO阳性标志物(CD9和CD63)、EXO阴性标志物(Calnexin)及3组小鼠肾脏组织中MPO、丙二醛(MDA)、肿瘤坏死因子(TNF)-α和IL-1β的表达水平。

结 果
1.EXO的表征:透射电子显微镜下mRTEC-EXO呈现圆形膜结构,mRTEC-EXO是直径为91.8~115.4 nm的微囊泡(图1A、B),粒径分布的峰尺寸为104.8 nm。EXO的Zeta电势为(-23.09±2.90)mV。Western blot结果显示,与对照组比较,mRTEC-EXO表面标记物CD9和CD63呈高表达,而阴性标志物Calnexin呈低表达(图2)。
2.EK细胞对mRTEC-EXO的摄取情况:mRTEC-EXO DiL染色后呈绿色(图3A),EK细胞经DAPI染色后其细胞核呈蓝色(图3B)。EK细胞和mRTEC-EXO共培养后,采用共聚焦显微镜观察结果显示,EK细胞可主动摄取mRTEC-EXO(图3C)。
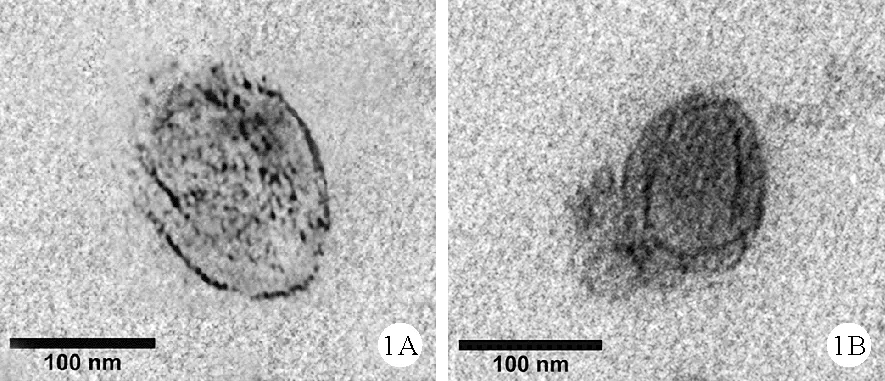
图1 透射电子显微镜下的mRTEC-EXO(×10 000)

图2 Western blot检测小鼠肾脏组织中CD9、CD63及Calnexin的表达水平

图3 EK细胞对mRTEC-EXO的摄取情况(A:mRTEC-EXO,DiL染色;B:EK细胞核,DAPI染色;C:mRTEC-EXO被EK细胞摄取,合并DiL与DAPI染色;×400)
3.3组小鼠生存率比较:对照组小鼠的生存率为100%,LPS组小鼠给药后150 h内生存率为25.0%,基本集中在72 h内死亡。LPS+mRTEC-EXO组小鼠给药后60 h内无死亡,生存率为62.5%。对照组小鼠生存率均高于LPS组和LPS+mRTEC-EXO组,LPS+mRTEC-EXO组生存率高于LPS组(P<0.05)。
4.3组小鼠肾脏组织中TNF-α、IL-1β、MDA表达水平比较:3组小鼠肾脏组织中TNF-α、IL-1β、MDA表达水平比较差异均有统计学意义(P<0.05)。与对照组比较,LPS组和LPS+mRTEC-EXO组小鼠肾脏组织中TNF-α、IL-1β和MDA表达水平均明显升高;与LPS组比较,LPS+mRTEC-EXO组TNF-α、L-1β和MDA表达水平均明显降低(P<0.05)。见表1。

表1 3组小鼠肾脏组织中TNF-α、IL-1β、MDA表达水平比较
5.3组小鼠炎症情况比较:与对照组比较,LPS组及LPS+mRTEC-EXO组小鼠肾脏组织炎性细胞浸润特征明显增加;与LPS组比较,LPS+mRTEC-EXO组小鼠肾脏组织炎性细胞浸润特征明显降低。见图4。
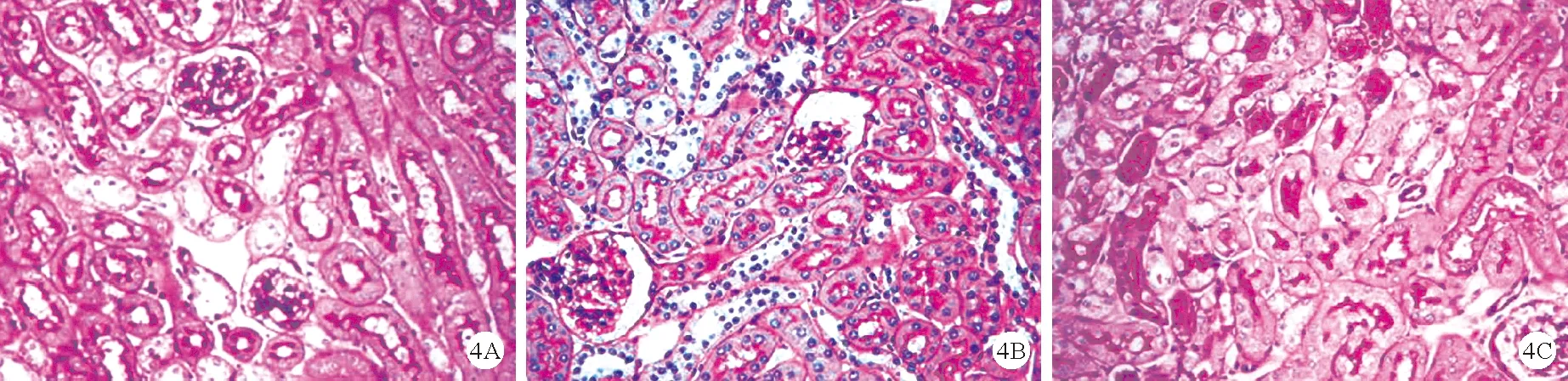
图4 3组小鼠肾脏组织病理检查结果(A:对照组;B:LPS组;C:LPS+mRTEC-EXO组;HE染色,×200)

图5 Western blot检测3组小鼠肾脏组织中MPO的表达水平
6.3组小鼠肾脏组织中MPO表达水平比较:3组小鼠肾脏组织中MPO表达水平比较差异均有统计学意义(P<0.05)。与对照组比较,LPS组小鼠肾脏组织中MPO表达水平均明显升高,与LPS组比较,LPS+mRTEC-EXO组小鼠肾脏组织中MPO表达水平均明显降低(P<0.05)。见表2、图5、图6。
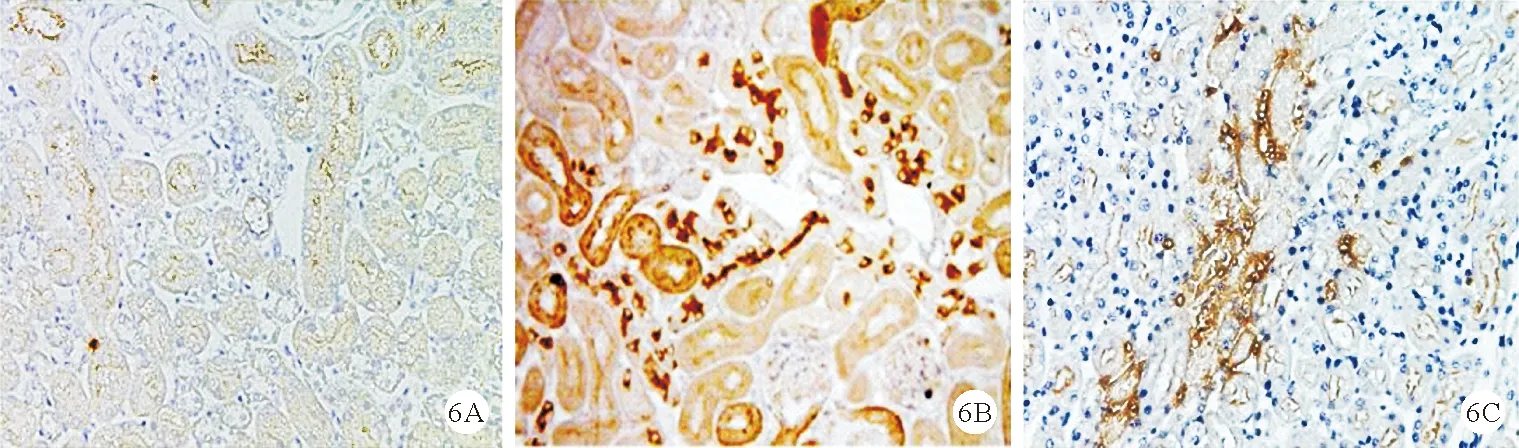
图6 3组小鼠肾脏组织MPO表达(A:对照组;B LPS组;C:LPS+mRTEC-EXO组;免疫组化染色,×200)

表2 3组小鼠肾脏组织中MPO表达水平比较
讨 论
既往研究表明,LPS腹腔注射1周内小鼠生存率由100%降低至0%~25%,其中死亡多集中在72 h以内[6-7]。本研究发现LPS组小鼠的150 h生存率降至25.0%。而在LPS基础上静脉注射mRTEC-EXO后可明显改善小鼠生存率,且LPS+mRTEC-EXO组和LPS组小鼠的生存率与对照组之间的差异有统计学意义,说明mRTEC-EXO具有提高LPS诱导的脓毒症小鼠生存率的作用。
既往研究已证实功能损伤的器官数量与脓毒症的病死率之间密切相关[8]。本研究病理染色结果也显示小鼠肾脏出现严重损伤和炎性细胞浸润;而在LPS基础上使用mRTEC-EXO改善了小鼠脓毒症对肾脏组织的伤害作用,说明mRTEC-EXO可能在改善脓毒症损伤中发挥积极作用。
为了探究mRTEC-EXO缓解肾脏组织伤害和炎症浸润的原因,我们验证肾细胞对EXO的吸收效果,结果发现mRTEC分泌的EXO可被EK细胞良好摄取,表明肾脏组织可受肾小管细胞EXO影响从而减轻组织伤害。相关研究表明EXO水平升高与TNF-α和IL-6水平升高呈正相关,这表明EXO在脓毒症的炎症反应中扮演重要角色[9]。TNF-α和IL-1β的释放是早期脓毒症的特征之一,其中TNF-α是炎症反应中的关键细胞因子,可由多种细胞(单核细胞、巨噬细胞等)释放,对于引发内毒素性休克具有重要意义;IL-1β作为炎症早期的另一重要细胞因子,可促进有毒代谢产物的产生,从而损伤组织、器官。已有研究显示降低这些炎症细胞因子的释放对于缓解脓毒症的进展、降低脓毒症患者及脓毒症动物模型的病死率具有重要意义[10]。本研究中mRTEC-EXO抑制了LPS诱导后的TNF-α和IL-1β水平升高。研究证实,LPS增加了脓毒症小鼠血清的EXO,但当使用EXO治疗后,LPS诱导的TNF-α、IL-1β、IL-6释放明显减少,表明EXO治疗不仅减少了脓毒症引起小鼠体内的炎症反应,还延长了生存率[9]。MDA是细胞膜脂质过氧化的终产物之一,可反映细胞膜脂质过氧化的程度及细胞的损伤程度[11],本研究结果同样显示LPS联合mRTEC-EXO显著增加了小鼠的生存期,并降低了MDA的水平。上述结果表明,mRTEC-EXO可能通过减弱细胞膜的脂质过氧化进而减缓细胞损伤。
在脓毒症发展过程中,多种重要脏器过度招募浸润中性粒细胞是导致脓毒症致死的重要原因之一[12]。MPO是一种由中性粒细胞在炎症过程中因吞噬作用而分泌的酶,既往研究中MPO常被用于反映中性粒细胞脏器浸润程度的指标[13]。本研究中LPS促进了肾脏中MPO表达水平,而当mRTEC-EXO联合LPS时,MPO的表达水平明显降低,表明mRTEC-EXO可抑制中性粒细胞大量浸润从而抑制脓毒症的进展。
在脓毒症的状态下,细菌可释放出大量的LPS,进入血液后会迅速引起急性肾损伤。因此,本研究使用LPS诱发脓毒症,为确保脓毒症引起的远端器官(如肾脏)损伤的临床研究价值,在LPS诱导条件下一旦使用mRTEC-EXO处理小鼠,其病情恶化明显好转。因此推测mRTEC-EXO中携带的大量功能性蛋白或核酸是减缓小鼠肾脏炎症损伤加快的关键原因,因为已有大量研究证实EXO携带有功能性和抗病性遗传信息[14-15]。因此,根据既往研究和本研究结果,我们认为对脓毒症小鼠持续促进肾小管上皮细胞EXO分泌的措施,可能是减轻脓毒症晚期的免疫失调和远端肾脏损伤的有效策略。然而,仍需进一步设计体内外实验探究mRTEC-EXO抑制脓毒症促进炎症反应和中性粒细胞浸润的机制。
综上所述,脓毒症小鼠体内注射mRTEC-EXO可抑制肾脏炎症损伤和中性粒细胞浸润。因此,脓毒症进展过程中注射mRTEC-EXO可能是一种有效的治疗策略。

