隐匿性慢性心肌炎一例
戴梅艳 宋玉娥 陈光志
患者,男,41岁,因“体检发现肌钙蛋白升高20天”于2019年9月26日入院。患者无发热,无胸闷、胸痛、心悸,无黑朦、晕厥,无咳嗽、咳痰,无肌肉酸痛,无乏力不适,否认近期感冒、腹泻病史,否认药物、毒物接触史。为求诊治来我院就诊,门诊以“心肌炎”收住我科。体格检查:T 36.3 ℃,P 87次/分,Bp 134/82 mmHg,双肺呼吸音清,未闻及干、湿啰音。心律齐,各瓣膜听诊区未闻及杂音,双下肢无水肿。既往史:乙肝“小三阳”,乙肝病毒DNA测定阴性,未服用抗乙肝病毒药物;陈旧性肺结核;脂肪肝;幽门螺杆菌感染;否认饮酒史及家族疾病史。入院后心肌肌钙蛋白I(cTnI)1 496.6 pg/ml(<34.2 pg/ml,括号内为正常参考值范围,以下相同),超敏C反应蛋白(hs-CRP)2.9 mg/L(<1.0 mg/L);氨基末端脑钠肽前体(NT-proBNP)正常,其余生化指标未见异常。梅毒、HIV、丙肝病毒抗体均为阴性,乙肝病毒表面抗原阳性、乙肝病毒DNA阴性。心电图和超声心动图检查均未见明显异常。进一步排查细菌、病毒感染及风湿性疾病、自身免疫性疾病、肿瘤等所致心肌损伤,结果均无异常。冠状动脉造影示冠状动脉未见明显狭窄。心脏磁共振-灌注成像+多方位延迟增强结果未见明显异常。因患者无胸闷、胸痛等不适症状,辅助检查无明显异常发现,考虑无症状性心肌炎可能性大,给予血管紧张素转化酶抑制剂(ACEI)和β受体阻滞剂治疗,同时给予改善心肌代谢药物治疗。患者1年后复诊,cTnI为2 076.9 pg/ml,否认胸闷、胸痛、气促等不适。为进一步明确诊断,于2020年12月10日再次入院行经皮心内膜心肌活检(EMB),心肌苏木素-伊红(HE)染色结果:镜下见部分心肌细胞核增大,部分心肌退行性变(空泡变性、萎缩、纤维化),间质少许慢性炎症细胞浸润(图1)。复查心脏磁共振-灌注成像+多方位延迟增强结果:心脏形态及功能未见明显异常;DOUBLE及TRIPLE可见基底段至中间段左室下壁、下侧壁及心尖段心肌T2信号增高,基底段室间隔T1信号增高;心肌灌注:首过灌注未见明显充盈缺损,延迟扫描可见基底段下侧壁近心外膜下条状强化影(图2)。为排除系统性自身免疫性疾病和全身性疾病,行全身正电子发射断层显像(PET)/CT检查(扫描范围自颅顶至股部上段),结果示:(1)左心室壁代谢无明显增高。(2)右肺中叶、双肺下叶微小结节,代谢无增高;纵隔区淋巴结增多,部分伴钙化,代谢无增高。左肺上叶纤维增殖钙化灶。双肺下叶肺大泡。(3)脂肪肝。(4)双侧扁桃体炎可能。双侧颈部炎性或非特异性淋巴结。根据1996年日本循环协会(JCS)慢性心肌炎诊断标准,结合cTnI、hs-CRP、心脏磁共振及EMB结果,患者隐匿性慢性心肌炎诊断成立,同时心肌炎路易斯湖磁共振诊断标准(LLC)也支持该诊断。结合患者症状和辅助检查结果,考虑为低风险慢性心肌炎可能,长期预后尚可,嘱患者继续口服ACEI、β受体阻滞剂及改善心肌代谢药物。在随后2年的随访期间,患者cTnI仍维持在较高水平,无胸闷、胸痛、心悸,无呼吸困难等特殊不适,体力无明显下降,嘱患者继续门诊随访。
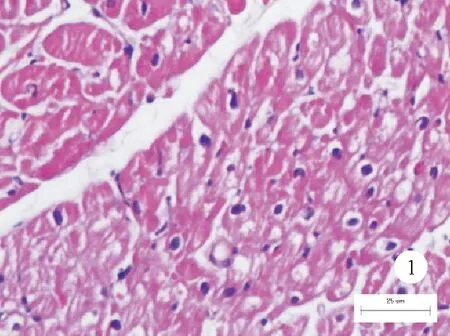
图1 患者2020年12月10日EMB病理检查结果(HE染色,×40)

图2 患者2020年12月17日复查心脏磁共振结果:钆对比剂后延迟扫描可见基底段下侧壁近心外膜下条状强化影(如箭头所示)
讨 论
心肌炎是一种由感染(如病毒、细菌、真菌)和非感染(如免疫介导的器官特异性或全身性疾病、药物、毒素等)因素引起的心肌炎症性病变[1],其临床表现和预后具有较大的异质性[2]。其中感染是最主要的致病原因,病原体以病毒最为常见。临床上分为急性期、亚急性期和慢性期。急性期一般持续3~5天,主要以病毒侵袭、复制对心肌造成损害为主;亚急性期以免疫反应为主要病理生理改变;少数患者进入慢性期,表现为慢性持续性及突发加重的炎症活动,心肌收缩力减弱、心肌纤维化和心脏扩大。急性心肌炎患者可能出现与心功能恶化相关的扩张型心肌病(DCM),伴或不伴一过性缓解期。部分DCM患者心肌活检可观察到炎症细胞浸润,预后较差[3]。慢性心肌炎是一种长期的心肌炎症状态,临床表现可从突发或迅速发展的急性心脏病的症状或体征,到缓慢和无意中进展的心功能障碍,如呼吸困难、心悸和胸痛等。研究表明基于事件风险的慢性心肌炎临床分类方法可指导治疗和改善预后[4]。
1996年JCS根据EMB的组织学发现和尸检结果提出两种类型的慢性心肌炎:(1)长期慢性心肌炎:为急性心肌炎发作后长期持续的炎症;(2)隐匿性慢性心肌炎:是一种起病隐匿的慢性心肌炎症过程。在以上两种类型中,持续激活的免疫反应导致慢性炎症、组织破坏和修复同时发生。慢性心肌炎诊断指南[5]指出,炎症持续时间>3个月及细胞浸润的组织学表现(每高倍视野5个以上单核细胞)和(或)细胞积累(超过20个单个核细胞)可诊断为慢性心肌炎。2013年,欧洲心脏病学会(ESC)提出一种基于免疫染色确定炎症细胞类型的替代标准,异常炎症细胞浸润定义如下:≥14个白细胞/mm2,包括≥4个单核细胞/mm2和≥7个CD3+T淋巴细胞/mm2[6]。因此,JCS指南定义了慢性心肌炎,而ESC专家共识则定义了炎性心肌病。虽然这两种定义存在差异,但均采用免疫炎症细胞浸润的客观指标进行定义[3]。在临床实践中,即使是由经验丰富的操作人员进行,EMB的主要并发症(发生率约为1%)较轻微但不可忽略,且取样错误易导致组织学检查发现心肌炎的敏感度降低。炎症细胞在心肌间质中往往呈片状分布,用4~5个活检标本解释心肌炎的敏感度约为50%。因此,EMB在通过免疫组织化学和生物分子聚合酶链反应分析检测心肌炎的特定组织类型、评估心肌的免疫学和病毒学状态方面具有重要价值,可提高组织学诊断的敏感性。2009年JACC杂志发表的LLC中指出,基于急性心肌水肿、毛细血管通透性增强和心肌坏死/纤维化等心肌损伤的病理学特征,分别推荐通过磁共振T2加权成像、注射钆对比剂后早期T1加权成像和延迟增强扫描进行在体检测,符合上述3条中2条者即支持心肌炎诊断[7]。以病理检查结果证实心肌炎为金标准,路易斯湖诊断标准的准确率约为78%,敏感度和特异度分别为67%和91%。2018年心血管磁共振在非缺血性心肌炎症疾病中的应用专家共识更新了LLC,保留了原版中关于延迟强化诊断要素的描述,但对于其他2项基于传统T1和T2加权成像的参数,则补充了磁共振定量分析技术即T1mapping和T2mapping成像方法,提高了诊断效能[8]。心脏磁共振检查具有诊断准确率高、重复性好、可用于心肌损伤的鉴定和检测、对心脏功能和形态学进行客观的评估并使组织病理变化可视化的优点。然而,心脏磁共振的诊断准确性可能因患者的临床表现和细胞坏死程度而有所不同,故仍无法代替EMB用于诊断心肌炎。本例患者首次心脏磁共振检查未见异常,1年后复查心脏磁共振T1、T2成像及钆延迟增强扫描支持心肌炎诊断,同时EMB HE染色证实该诊断。心脏磁共振检查结合心肌活检能显著提高心肌炎的诊断率。
心肌炎目前缺乏特异性血清炎症标志物,但红细胞沉降率和C反应蛋白水平可能升高。cTnI在心内膜炎和心肌炎中,而非在心包炎中,是非常有价值的提示预后的生物学标志物[9]。然而cTnI水平与心包-心肌炎综合征的预后无关,因此它本身不应成为延长随访或额外检查的原因[4]。心肌炎常伴随有心电图异常,最常见的是ST-T异常改变。超声心动图是所有疑似心肌炎患者的初始诊断和随访中一种常见的影像学检查方法。由于证据不足,2013年ESC专家共识推荐不支持核显像在心肌炎诊断中的应用。18氟-脱氧葡萄糖(18F-FDG)-PET对心肌活检诊断准确性低的慢性心肌炎尤其有用。18F-FDG-PET成像已在结节病的心脏及心脏外定位检测和治疗监测中确立了作用[2]。本病例cTnI升高,提示存在心肌损伤,而超声心动图和心肌核素显像结果未见明显异常,表明无创检查中超声心动图及心肌核素显像诊断心肌炎的敏感度不及心脏磁共振。
综上所述,慢性心肌炎的诊断不仅是一项艰巨而富有挑战性的任务,而且是一个迫切需要解决的问题。研究表明对慢性心肌炎患者,常规治疗之外的免疫调节治疗有效,超过50%的DCM患者诊断为慢性心肌炎,预后不良[3]。另有研究指出,根据最新的预后证据、临床发现及有创和无创检查,将心肌炎的不同表现模式分为低、中、高危综合征,疑似或确诊心肌炎患者的诊断和临床管理应根据临床表现的严重程度和对药物治疗的反应而量身定制[4]。本例患者无明显主诉症状和异常体征,心肌活检和心脏磁共振支持慢性心肌炎诊断,cTnI升高不能很好的预测预后,常规给予延缓心肌重构、降低心肌耗氧、改善心肌代谢的标准治疗,随访2年患者无心力衰竭症状,复查心电图无异常,超声心动图无明显结构和功能改变,预后良好。

