GS-441524体外对猪繁殖与呼吸综合征病毒的抑制效果
梁杏玲,马 俊,王志远,王秋梅,郭彦辰,张桂红,王 衡,
(1.华南农业大学 兽医学院 广东省临床重大疾病综合防控重点实验室,广东 广州 510642;2.华南农业大学 国家生猪种业工程技术研究中心,广东 广州 510642.)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的一种猪急性传染病,俗称蓝耳病,主要造成母猪严重的繁殖障碍以及仔猪和成年猪的呼吸系统疾病,给世界养猪行业造成了巨大的经济损失。当前预防该病的策略主要集中在疫苗免疫,但PRRSV毒株的多样性以及复杂性给免疫预防带来巨大挑战。同时,普遍使用的减毒活苗存在毒力返强的可能,加上毒株发生变异和无有效的疫苗保护猪群免于变异毒株感染,增加了猪场蓝耳病防控的难度[1]。因此,迫切需要一种有效预防与治疗PRRS的方法。
20世纪50年代,科学家们发现RNA依赖性RNA聚合酶能催化以RNA为模板的RNA转录,它在大多数RNA病毒的基因组复制和转录过程中起着关键的作用。因为RNA依赖性RNA聚合酶在不同RNA病毒中存在着高度保守的催化结构域,因此其成为开发广泛抗病毒药物的主要靶点。又因RNA聚合酶在细胞内起作用,因此临床上使用的所有聚合酶抑制剂都为小分子化合物。PRRSV属于动脉炎病毒属,是一种不分节段的单股正链RNA病毒,感染宿主后,可利用自身的RNA依赖性RNA聚合酶进行自身基因组的合成。聚合酶抑制剂有望成为对抗PRRSV的新策略。
瑞德西韦(GS-5734)是GS-441524的前药,两者均为核苷类似物。GS-441524首先应用于猫传染性腹膜炎的治疗,且治疗效果良好。2019年,SARS-CoV-2的新型冠状病毒在我国首次发现并迅速造成了全球大范围传播。瑞德西韦因其具有显著的抗SARS-CoV-2复制作用而受到人们的关注,GS-441524本质上是GS-5734在细胞内的活性成分,GS-5734被细胞摄入后,经过一系列的加工后形成GS-441524的三磷酸形式。GS-441524进入宿主体内后,在细胞和组织中代谢转化为具有药理活性的三磷酸形式,该形式可抑制病毒的RNA聚合酶活性,但不影响宿主细胞的RNA或DNA聚合酶[2]。作为病毒RNA依赖的RNA聚合酶的抑制剂,它的药理活性三磷酸化形式可以在病毒RNA合成中充当天然三磷酸核苷的竞争者,从而影响病毒RNA的合成[3-4]。已有研究表明,该药物在体内和体外对冠状病毒都有抗病毒作用[5]。MURPHY等[6]和PEDERSEN等[7]报道,GS-441524可通过充当病毒RNA依赖的RNA聚合酶的替代底物和RNA链终止子,能有效抑制猫冠状病毒复制,从而治疗猫传染性腹膜炎。LI等[8]报道,GS-441524在小鼠模型中也能有效抑制新冠病毒SARS-CoV-2的复制。
核苷类似化合物已成为抗病毒药物的新选择,它们对于某些人类病毒疾病有显著的抗病毒作用,但对动物病毒性疾病的作用仍需探究。PRRS是一种严重危害养猪业的传染病,找到有效抗PRRSV的药物十分迫切。本试验评估了GS-441524体外抗PRRSV活性,证实GS-441524在体外可抑制PRRSV复制,为抗PRRSV药物的选择和开发提供了新思路。
1 材料与方法
1.1 毒株、细胞及抗体PRRSV GD-XH毒株(GenBank:EU624117.1)、Marc-145细胞均为华南农业大学传染病教研室保存;PRRSV N蛋白单克隆抗体购自北京金诺公司。
1.2 药品GS-441524为美国吉利德科学公司产品。
1.3 主要试剂胎牛血清、高糖DMEM培养基、PBS缓冲液均购自以色列Biological Industries(BI)公司;总RNA极速抽提试剂盒购自上海飞捷生物技术有限公司;反转录试剂盒HiScriptⅡ Q RT SuperMix for qPCR(+gDNA wiper)、荧光定量试剂盒ChamQ Universal SYBR qPCR Master Mix均购自南京诺唯赞生物科技有限公司;CCK8试剂盒购自全式金公司;Western细胞裂解液与QuickBlock Western封闭液均购自碧云天公司。
1.4 PRRSV TCID50的测定将生长状态良好的Marc-145细胞转至96孔板培养24 h,待单层细胞长满后,弃去培养液,用PBS清洗2次,再用2%细胞维持液将病毒进行10倍倍比稀释,每孔加入100 μL 病毒稀释液,每个稀释浓度设置8个重复孔,将96孔板放入37℃、5%CO2培养箱中培养5 d,每隔24 h在显微镜下观察细胞病变,根据Reed-Muench公式计算病毒的半数组织感染剂量(TCID50)。
1.5 间接免疫荧光试验将生长状态良好的Marc-145细胞转至24孔板,待单层细胞长满后,弃去培养液,用PRRSV(MOI=0.1)在37℃下感染细胞1 h,再用PBS清洗细胞,并用含不同浓度的GS-441524的2%细胞维持液处理细胞,同时设置不加药物的阴性对照组。GS-441524处理后,弃去培养液,用PBST清洗3次,然后4℃、4%多聚甲醛固定20 min,固定后用PBST清洗3次,每次5 min。将固定后的细胞用0.2%Triton X-100室温通透10 min,通透后用PBST清洗3次,每次5 min,再加入5%脱脂奶粉,37℃封闭1 h,封闭结束后弃掉封闭液,用PBST清洗3次,每次5 min。加入PRRSV N蛋白抗体,4℃过夜孵育,用PBST清洗3次,每次5 min,然后加入荧光二抗,37℃避光孵育2 h。弃掉二抗,用PBST清洗3次,每次5 min,再加入DAPI,室温染色6 min,弃掉DAPI,用PBST清洗2次,每次5 min。观察结果,选择合适的视野拍照。
1.6 蛋白免疫印迹分析细胞样本用遇冷的PBS清洗2次,用含1%的蛋白酶抑制剂细胞裂解液处理,细胞裂解物在4℃、12 000 r/min条件下离心10 min,收集上清,用BCA法测定蛋白质浓度,剩余细胞裂解物加入蛋白上样缓冲液,沸水中加热8 min。样品中的蛋白用SDS-PAGE蛋白胶电泳分离,然后将蛋白转移至聚偏二氟乙烯膜(PVDF膜),TBST洗膜3次,每次5 min,用快速封闭液封闭15 min,封闭结束后弃掉封闭液,TBST清洗3次,每次5 min,然后与一抗(PRRSV N蛋白单克隆抗体)4℃过夜孵育,TBST洗膜3次,加入荧光二抗,37℃ 孵育2 h,利用LI-COR Odyssey Sa红外双色激光成像系统分析蛋白表达情况。
1.7 实时荧光定量PCR检测用病毒和药物处理细胞后,抽提病毒总RNA;然后将病毒总RNA反转录为cDNA;以反转录后的cDNA为模板,进行荧光定量PCR,每个样品中单个基因转录本的丰度测量3次,同时将GAPDH mRNA作为内源性对照。所得数据用2-△△Ct法计算每个靶基因的相对mRNA表达。参考GD-XH毒株病毒序列,通过Primer-Primer 8.0软件设计PRRSV N蛋白基因以及GAPDH mRNA检测引物,并由广州天一辉远公司合成。引物信息如表1。

表1 荧光定量PCR引物
1.8 GS-441524安全浓度的测定采用 CCK8法进行测定。为检测GS-441524对正常细胞生长的影响,用CCK8试剂盒检测不同浓度GS-441524(50,100,200,400,800,1 600,3 200 μmol/L)对Marc-145细胞的毒性,并设阴性对照组和空白对照组,每个浓度设置3个重复。计算在不同浓度GS-441524条件下的细胞存活率,以测定GS-441524的最大安全浓度。应用以下公式计算不同条件处理下细胞的存活率:细胞活性率=(D药物-D空白)/(D阴性-D空白),并通过GraphPad Prism软件计算使50%细胞产生细胞病变的药物浓度(CC50)。
1.9 GS-441524抗PRRSV活性的评价为检验GS-441524是否具有抗病毒活性,Marc-145细胞接种24孔细胞板,培养至单层细胞长满后,用PRRSV(MOI=0.1)在37℃下感染细胞1 h,弃去病毒液,用PBS清洗2遍,加入含不同浓度GS-441524的2%细胞维持液,使GS-441524的终浓度为1,2,3,4 μmol/L,并设立不加药物的阴性对照,继续培养至48 h。48 h后细胞板在-80℃与4℃冻融3次,收集病毒液进行病毒滴度测定或终止培养时进行间接免疫荧光试验。病毒滴度测定、间接免疫荧光方法参照1.4和1.5。
1.10 GS-441524对PRRSV复制周期的影响为进一步研究GS-441524抗PRRSV的作用机制,分别在PRRSV感染细胞的吸附、内化和复制阶段开展研究,以探究GS-441524在PRRSV感染细胞的哪个阶段发挥抗病毒作用。
1.10.1病毒吸附抑制试验 为检验GS-441524是否对病毒吸附Marc-145细胞有影响,将Marc-145细胞转至24孔板中,待单层细胞长满后,先将细胞板放入4℃预冷1 h,弃去培养液,在冰上加入PRRSV病毒液(MOI=0.1),同时加入含不同浓度GS-441524的2%细胞维持液,使GS-441524的终浓度为1,2,3,4 μmol/L,并设立不加药物的阴性对照。将细胞板放入4℃培养1 h,弃去病毒液,用预冷的PBS清洗3次,加入2%细胞维持液,细胞板在-80℃与4℃冻融3次,收集病毒液进行荧光定量PCR检测。荧光定量PCR方法参照1.7。
1.10.2病毒复制抑制试验 为检验GS-441524是否对PRRSV在Marc-145细胞的复制阶段有抑制作用。细胞孵育病毒的方法参照1.9,病毒感染细胞后弃去病毒液,用PBS清洗3遍,更换空白维持液以及含有1,2,3,4 μmol/L GS-441524的2%细胞维持液,继续培养至48 h。48 h后细胞板在-80℃与4℃冻融3次,收集病毒液进行荧光定量PCR检测。荧光定量PCR方法参照1.7。
1.10.3不同时间点加药对病毒的抑制作用 为分析GS-441524在PRRSV复制阶段的前期或后期具有抑制作用,采用分时间点加药的方式进行研究。细胞孵育病毒的方法参照1.9,病毒感染细胞后弃去病毒液,用PBS清洗3遍,更换空白维持液,此时记为0 h,分别在0,3,6,9,12,18 h加入含有2 μmol/L GS-441524的2%细胞维持液,同时设立不加药物的阴性对照组,继续培养至24 h。24 h后细胞板在-80℃与4℃冻融3次,收集病毒液进行荧光定量PCR检测或终止培养时进行蛋白免疫印迹分析。荧光定量PCR、蛋白免疫印迹方法参照1.6和1.7。

2 结果
2.1 GS-441524对Marc-145细胞的安全浓度分别以50,100,200,400,800,1 600,3 200 μmol/L浓度的GS-441524处理Marc-145细胞,以不加药物作为阴性对照组,用CCK8方法进行细胞安全浓度测定,根据D490 nm计算Marc-145细胞的存活率。细胞存活率如图1所示,随着药物浓度增加,细胞存活率逐渐下降,当GS-441524浓度在100 μmol/L时,细胞存活率接近100%,而当药物浓度增加至200 μmol/L 时,细胞存活率仍可维持在80%。用GraphPad Prism计算该药物的CC50值为2 706.41 μmol/L。上述结果表明,该药物对Marc-145细胞上有较好的安全性。

图1 GS-441524在Marc-145细胞的安全浓度
2.2 GS-441524抗PRRSV活性评价为确认GS-441524在Marc-145细胞中对PRRSV的抑制作用,本研究设置了1,2,3,4 μmol/L等4个药物干预浓度测试其抗PRRSV活性,同时设置不加药物阴性对照组。如图2所示,随着药物浓度增加,病毒滴度明显下调,且呈浓度依赖性。运用GraphPad Prism计算得到GS-441524的50%有效浓度(EC50)为2.65 μmol/L。PRRSV N蛋白的合成能力试验结果如图 3 所示,对照组中PRRSV N蛋白的荧光信号相对明亮,试验组中PRRSV N蛋白荧光信号均比对照组弱,在3,4 μmol/L的药物处理组,PRRSV N蛋白荧光强度明显下降。结果表明,GS-441524能抑制PRRSV蛋白的合成,具有抗PRRSV活性。

图2 GS-441524对PRRSV感染能力的影响
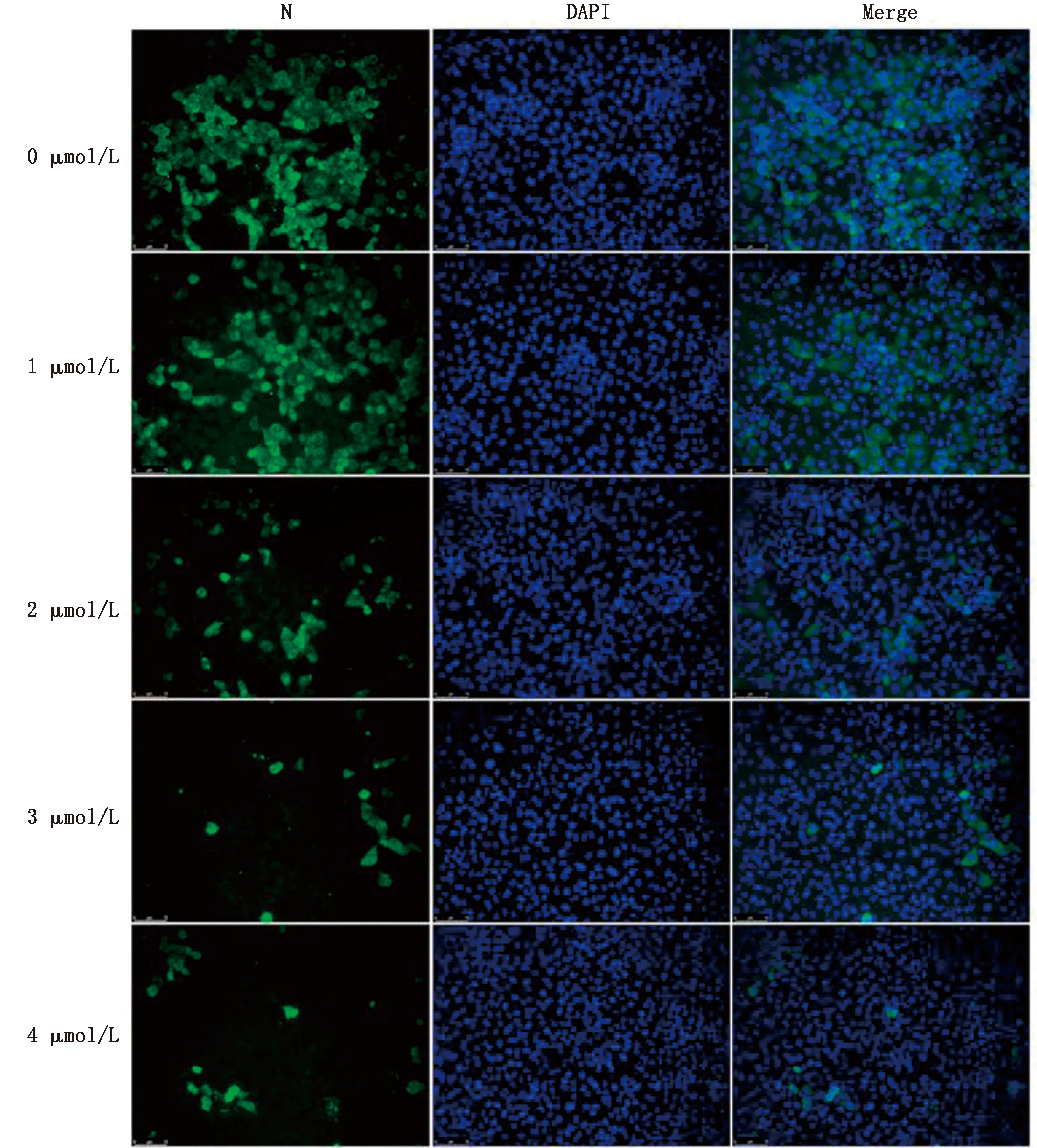
图3 间接免疫荧光检测PRRSV N蛋白的表达
2.3 GS-441524对PRRSV复制周期的影响
2.3.1GS-441524对PRRSV吸附细胞的影响 吸附是病毒感染细胞的第1步,为研究GS-441524能否阻断PRRSV吸附细胞,本研究用GS-441524与PRRSV(MOI=0.1)稀释液混合后加入到预冷过的细胞中,使GS-441524的终浓度分别为1,2,3,4 μmol/L,1 h后洗去未吸附细胞的病毒粒子,再通过荧光定量PCR检测PRRSV mRNA的相对表达水平。结果如图 4 所示,各试验组PRRSV mRNA的相对表达量与对照组差异不显著。因此,GS-441524对PRRSV吸附Marc-145细胞无明显影响。

图4 GS-441524对PRRSV吸附能力的影响
2.3.2GS-441524对PRRSV进入细胞的影响 PRRSV完成吸附过程后,第2阶段是由网格蛋白介导的病毒入胞过程。为研究GS-441524能否阻断PRRSV进入细胞,本试验分别用1,2,3,4 μmol/L 的GS-441524干预PRRSV入胞过程。细胞预冷后与PRRSV在4℃中共同孵育1 h,病毒在该条件下吸附细胞。1 h后用遇冷的PBS洗去未吸附上的病毒粒子,再加入含不同浓度GS-441524的2%细胞维持液,37℃孵育1 h,此时病毒在药物的干预下进入细胞。1 h后弃去细胞维持液,用PBS清洗3次,加入新鲜的培养液,排除药物对后续阶段的影响,继续培养48 h,再通过荧光定量PCR检测PRRSV mRNA的相对表达水平。如图 5 所示,各试验组PRRSV mRNA的相对表达量与对照组差异不显著。因此,GS-441524对PRRSV进入Marc-145细胞无明显影响。

图5 GS-441524对PRRSV进入细胞能力的影响
2.3.3GS-441524对PRRSV复制阶段的影响 由于GS-441524对PRRSV的吸附和内化无明显影响,我们进一步研究该药物对PRRSV生命周期复制阶段的影响。细胞在37℃孵育病毒1 h后,加入不同浓度的药物处理,检测PRRSV mRNA的相对表达水平。如图 6 所示,随药物浓度增加,PRRSV mRNA水平显著下调,且呈浓度依赖性。结果表明GS-441524对PRRSV在Marc-145细胞上的抑制作用是在病毒复制阶段产生的。

图6 GS-441524对PRRSV复制的影响
2.3.4GS-441524对PRRSV早期复制的影响 GS-441524能抑制PRRSV在Marc-145细胞上的复制,本试验进一步探究GS-441524对PRRSV作用最显著的阶段。首先,分别在病毒感染细胞后0,3,6,9,12,18 h加入含终浓度为2 μmol/L GS-441524的2%细胞维持液,继续培养至第24 h,然后收集样品进行荧光定量PCR和蛋白免疫印迹分析。结果如图 7 所示,病毒感染后12 h内,PRRSVmRNA的相对表达量明显下调,前3 h的下调效果更为显著,随着药物干预时间的减短,PRRSV mRNA的相对表达量逐渐增加;而在感染后第18 h加入药物,PRRSV mRNA的相对表达量与对照组差异不显著。蛋白免疫印迹结果则表明,病毒感染后18 h内,PRRSV N蛋白的表达量均有下降,前3 h内N 蛋白的表达量明显下调。结果提示,GS-441524对PRRSV作用最显著的阶段是复制阶段早期。

图7 分时间点加药对PRRSV复制的影响
3 讨论
PRRS在我国猪场广泛存在,是一种严重影响经济效益的传染病。在找到新型有效的药物前,疫苗免疫仍是防控PRRS的最重要手段。但由于PRRSV毒株多样、容易发生重组与变异,目前针对PRRSV的弱毒活疫苗在安全性和交叉保护性方面存在一定缺陷;而灭活疫苗因其引发的机体免疫反应不足以控制病毒的传播,使其保护效率偏低。因此,探索抑制病毒复制的药物对于有效地防控PRRS至关重要。
GS-441524是一种小分子氰基取代腺嘌呤核苷类似物,作为病毒RNA依赖性RNA聚合酶的抑制剂,它在宿主体内的三磷酸化活体形式能抑制病毒RNA的合成。研究显示,它对包括人畜共患的严重急性呼吸道综合征(SARS)冠状病毒在内的多种RNA病毒具有显著的抗病毒活性[3]。GS-441524的一种氨基酸酯前体药物(GS-5734),能够抑制多种不同类型的RNA病毒的复制,如中东呼吸综合征冠状病毒、埃博拉病毒、拉沙热病毒和呼吸道合胞病毒等[9-15]。有研究指出,与GS-5734相比,GS-441524结构更为简单,容易合成且成本较低,能有效抑制小鼠模型中SARS-CoV-2的感染,并且GS-441524是循环中主要持续的代谢物[8]。
GS-441524化合物展现着良好的安全作用,在多种细胞系中均表现出低细胞毒性的特点[9-15]。Marc-145细胞是体外培养PRRSV最常用的细胞,本试验结果显示GS-441524在Marc-145细胞上的CC50为2 706.41 μmol/L,在浓度不超过200 μmol/L时不会影响细胞生长。GS-441524被证实在体外可抑制多种冠状病毒,最新研究证实,该化合物在体外能有效抑制猪流行性腹泻病毒(PEDV)的复制。冠状病毒科与动脉炎病毒科均属正链RNA病毒,两者的基因组结构、转录模式及蛋白质合成方式相近。本试验结果表明,GS-441524具有抗PRRSV活性,其EC50为2.65 μmol/L。用浓度为1~4 μmol/L的GS-441524处理感染病毒的细胞后,TCID50结果表明PRRSV的感染能力显著下调,间接免疫荧光结果也表明病毒的蛋白合成能力显著下调,且呈浓度依赖性。病毒的生命周期大致可分为吸附、内化、复制、出芽,以上各个环节均有可能成为抗病毒药物的作用靶点。本试验分别检验了该化合物对PRRSV在细胞吸附、内化、复制阶段的影响,发现在吸附和内化阶段,GS-441524对PRRSV mRNA合成无影响;在复制阶段,PRRSV mRNA的相对表达量显著下调,且呈浓度依赖性,表明GS-441524的抗PRRSV活性作用于病毒复制阶段。对于大多数RNA病毒,它们的基因组会借助病毒RNA依赖性RNA聚合酶完成复制,据此推测,GS-441524通过干扰RNA聚合酶介导的RNA转录过程,从而抑制PRRSV复制。本试验结果表明,在病毒感染细胞的前12 h,GS-441524能抑制病毒mRNA和蛋白的合成,推测该化合物对PRRSV作用最显著的阶段是复制阶段早期。
综上所述,本试验发现核苷类似化合物GS-441524体外可以有效抑制PRRSV的复制。该化合物靶向病毒RNA依赖性RNA聚合酶,其有望成为防控PRRS的新型药物并消除因PRRSV高变异性等原因而导致的疫苗研发障碍;同时,对于同科的病毒,该酶的功能结构域可能存在保守区域,GS-441524或许对其他动脉炎病毒也同样具有抗病毒活性。

