退行性腰椎侧凸与多裂肌退变的关联性研究
喻学科,陈 灿,李 凯,陈春华,胡晨波,戴 威,陈品珍,赵 骏,罗 飞
400038 重庆,陆军军医大学(第三军医大学)第一附属医院:骨科1,放射科2
退行性腰椎侧凸(degenerative lumbar scoliosis,DLS)是指患者既往无脊柱侧凸病史,骨骼成熟后伴随脊柱退变而出现腰椎侧凸畸形,冠状位Cobb角>10°[1],主要表现为疼痛、残疾和功能障碍等。随着人们预期寿命的延长,DLS困扰着相当一部分老年人且患病率正在增加,对其生活质量造成严重影响[2]。既往的研究认为脊柱畸形与椎体、椎间盘和小关节不对称退变有关[3],但其发病机制尚未充分阐明。
椎旁肌在腰椎水平由三部分组成,从内到外依次为多裂肌、最长肌和髂肋腰肌[4],它们对维持脊柱的动态平衡和躯干运动起着至关重要的作用[5]。与其他椎旁肌相比,多裂肌距离脊柱中轴最近、附着面积大且肌纤维短[6],这种形态特征使多裂肌在相对狭窄的空间内能够施加很大的力量,控制脊柱后部的稳定性[7];椎体发生相对运动时,承载躯干2/3以上的受力[8],因此在退行性腰椎侧凸畸形等研究领域备受关注。SHAFAQ等[9]研究认为退行性腰椎侧凸患者凹侧的多裂肌退变更明显;KIM等[10]研究表明退行性脊柱侧凸患者顶椎节段多裂肌的不对称退变主要表现为凸侧多裂肌肥大。其研究结果表明DLS患者凸凹侧多裂肌发生不对称退变,但对于DLS患者不同腰椎节段凸凹侧多裂肌不对称退变特点并未阐述。本研究拟通过MRI对退行性腰椎侧凸患者腰部多裂肌进行评估,分析其不同腰椎节段凸凹侧退变特点及其与脊柱畸形程度的相关性,为DLS患者评估和治疗提供新的思路。
1 资料与方法
1.1 一般资料
选取2019年3月至2021年6月于陆军军医大学第一附属医院公开招募的45例DLS受试者(DLS组),以及42例脊柱形态正常的同龄健康受试者(对照组)作为研究对象。纳入标准:①年龄≥45岁;②自愿参加本研究的受试者。排除标准:①先天性脊柱畸形;②早发型或青少年脊柱畸形;③强直性脊柱炎;④脊柱肿瘤;⑤脊柱结核;⑥脊柱感染;⑦脊柱手术史;⑧1年内发生过脊柱骨折;⑨严重骨盆、髋关节、膝盖或下肢病变;⑩体内任何地方有金属植入物而无法接受核磁共振检查的患者;其他严重的全身疾病影响活动者。经站立位脊柱全长正位X片评估,诊断为退行性腰椎侧凸(腰椎Cobb角>10°)者分入DLS组,脊柱形态正常者分入对照组,不确定者剔除。本研究采用横断面研究设计方案,由陆军军医大学第一附属医院伦理委员会批准(KY201853),并通过中国临床试验注册中心注册(注册号: ChiCTR1800019459)。对所有受试者进行了规范的知情告知,研究活动遵守“赫尔辛基宣言”原则。
1.2 影像学检查
所有患者使用相同的设备进行X线和MRI检查。MRI系统是3.0T成像系统(西门子医疗集团)。采集腰椎矢状面的T1和T2加权图像。使用相同的序列获得从L1~L2到L5~S1的椎间盘水平的横向图像。层厚为3 mm,视野为240 mm×240 mm,每层为512×384矩阵。T1WI的重复时间和回波时间分别为644、9.5 ms,T2WI的重复时间和回波时间分别为4 290、93 ms。
1.3 影像学评估
X线评估:DLS组中的每个患者,在标准脊柱全长正位X线片中测量和记录腰椎侧凸Cobb角。Cobb角测量由两位脊柱外科主治医师在影像归档和通信系统(picture archiving and communication system, PACS)中测量,选取患者脊柱全长正位X片线上,以腰椎侧弯上、下端椎的终板分别划平行线,若终板无法看清可选择对应两侧椎弓根中点连线作平行线,其夹角为Cobb角度数。MRI评估:利用磁共振T2序列轴位片,取L1~S1椎间盘平扫(3层)中间层作为研究对象。通过手动追踪肌肉边界[11],并使用Image J软件(v2.1.4.7;美国国立卫生研究院)测量多裂肌横截面积(cross-sectional area, CSA)。采用Image J阈值技术测量多裂肌脂肪浸润率(fat infiltration ratio, FIR)[12],具体操作流程如下:image/type/8bit/adjust/threshold/auto/analyze/measure。在这种技术中,磁共振图像中的脂肪组织的明亮像素被编程的伪彩色工具染成红色,由软件自动计算出的所追踪肌肉边界内红色区域的百分比为FIR(图1)。多裂肌功能横截面积(无脂肪浸润的纯肌肉组织面积,functional cross-sectional area,FCSA)计算公式如下:FCSA=CSA×(1-FIR)。为了比较凹侧和凸侧的FCSA差异程度,FCSA差异指数(FCSA difference index,FDI)作为评价指标:FDI=[1-(FCSA凹侧/FCSA凸侧)]×100%。每张图像由两位医师分别测量,并取平均值进行统计分析。
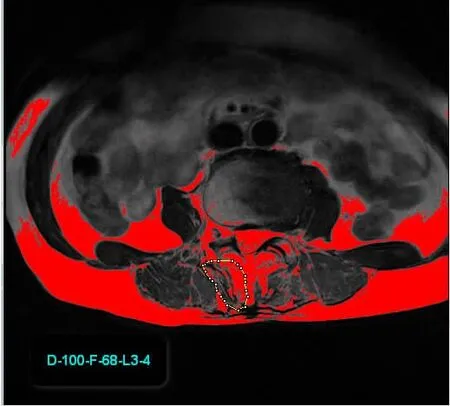
黄色划线区域内为受试者右侧多裂肌,灰色部分为肌肉区,红色部分为脂肪浸润区
1.4 统计学分析
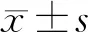
2 结果
2.1 人群特征
纳入DLS组45例,男性6例,女性39例;年龄(64.7±7.7)岁;对照组42例,男性8例,女性34例,年龄(61.8±5.8)岁。两组人群年龄、男女比、身高、体质量、BMI见表1。DLS患者顶椎位于L1椎体2例(4.4%),L1~L2椎间盘1例(2.2%),L2椎体13例(28.9%),L2~L3椎间盘5例(11.1%),L3椎体18例(40.0%),L3~L4椎间盘3例(6.7%),L4椎体2例(4.4%),L4~L5椎间盘1例(2.2%);主弯为右侧17例(27.8%),主弯为左侧28例(62.2%)。
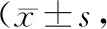
表1 两组患者一般资料比较例)
2.2 两组人群多裂肌影像参数比较
DLS组和对照组L1~S1节段多裂肌FCSA呈逐渐增大趋势。DLS组L4~L5、L5~S1节段凸侧多裂肌FCSA小于对照组对应节段左右侧多裂肌FCSA均值,差异有统计学意义(P<0.05)。DLS组L3~L4、L4~L5、L5~S1节段凹侧多裂肌FCSA小于对照组对应节段左右侧多裂肌FCSA均值,差异有统计学意义(P<0.05)。见图2。DLS组L1~S1节段凸、凹侧多裂肌FIR均大于对照组对应节段左右两侧多裂肌平均FIR,差异有统计学意义(P<0.05)。见图2。
2.3 DLS组凸凹侧多裂肌影像参数比较
DLS组凸凹侧及对照组左右侧多裂肌FCSA和FIR见表2。DLS组L1~L2、L2~L3节段凸凹侧多裂肌FCSA差异无统计学意义,L3~L4、L4~L5、L5~S1节段凹侧多裂肌FCSA小于凸侧,差异有统计学意义(P<0.05)。DLS组各腰椎水平多裂肌FDI分别为:L1~L2(-13.57±27.10)%、L2~L3(-7.22±22.07)%、L3~L4(6.34±21.41)%、L4~L5(5.91±17.90)%、L5~S1(9.72±13.53)%,对照组各腰椎节段左右侧多裂肌FCSA差异无统计学意义。
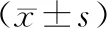
表2 两组被试者多裂肌FCSA/FIR比较
DLS组L1~L2、L2~L3、L3~L4节段凸侧多裂肌FIR小于凹侧,差异有统计学意义(P<0.05);L4~L5、L5~S1节段凸凹侧多裂肌FIR差异无统计学意义,对照组各腰椎节段左右侧多裂肌FIR差异无统计学意义。见图2、3。

a: P<0.05; b: P<0.01
图3 L1~L2至L5~S1节段对照组左右侧多裂肌FSCA(A)与FIR(B)比较
2.4 DLS组多裂肌不对称退变与Cobb角相关性分析
DLS组Cobb角与L4~L5、L5~S1节段凸凹侧多裂肌FDI呈正相关(r=0.310、0.559,P<0.05),Cobb角与L1~L2、L2~L3、L3~L4节段凸凹侧多裂肌FDI及L1~S1节段凸凹侧FIR差值无明显相关性。见图4。

图4 L4~L5(A)、L5~S1(B)节段DLS组多裂肌FDI与Cobb角相关性分析
3 讨论
AEBI等[3]研究指出椎间盘和/或关节突关节的不对称退变导致脊柱的不对称负荷会造成脊柱畸形的进展,两者之间形成恶性循环。但此分型未考虑椎旁神经肌肉系统的作用,而脊柱的稳定是由骨骼、肌肉和神经3个系统共同维持[13],椎旁肌在腰椎的稳定性和功能性运动中起着至关重要的作用[14]。多裂肌位于腰椎椎旁肌最内侧,维持脊柱生物力学稳定[4],对病理变化非常敏感[15]。对椎旁肌功能障碍的腰痛患者康复治疗中,多裂肌通常被认为是需要研究的核心肌肉[16]。因此我们选择多裂肌作为研究对象。
肌肉横截面积减小和/或脂肪浸润程度增加是肌肉退变的两个关键影像学表现[15,17]。MRI可以清楚地显示肌肉质量和肌内脂肪,并能清晰识别脂肪和肌肉之间的信号强度差异,已在椎旁肌研究中被广泛使用[11-12, 18]。最近的研究表明,使用单节段肌肉截面积测量来评估椎旁肌不足以代表腰椎区域椎旁肌的整体情况[19]。由于肌肉成分发生变化时横截面积不一定改变,因而FCSA是反映肌肉退变程度和功能更好的指标[17]。因此本研究应用Image J软件测量计算从L1~L2到L5~S1 5个腰椎节段MRI T2WI上两侧多裂肌FCSA和FIR来评估肌肉退变情况,并对比分析各节段之间退变程度的差异。研究结果显示,DLS组L4~L5、L5~S1节段凸凹侧多裂肌FCSA与对照组相比显著减小、FIR显著升高,表明DLS患者下腰段较上腰段的多裂肌发生更显著退变。HYUN等[20]的研究也得出类似结论:即退行性腰椎后凸患者的L4和L5腰椎水平的多裂肌截面积小于的健康志愿者,而L1、L2和L3水平两组多裂肌截面积差异无统计学意义。CRAWFORD等[21]研究也发现椎旁肌的退变可能起始于尾端,并从头端向尾端逐渐加重。多裂肌在下腰椎节段横截面积变得更大[22],起自于L3及更尾端的多裂肌肌纤维止于髂嵴、骶髂关节和骶骨,是腰骶过渡区域背侧仅有的肌肉[4, 23],这些因素导致在脊柱的活动中下腰段多裂肌承担到更大的负荷,并因此更易发生退变。
本研究结果显示DLS患者L3~L4、L4~L5、L5~S1节段凹侧多裂肌FCSA小于凸侧,表明凸凹侧多裂肌发生不对称退变,凹侧退变程度大于凸侧。这与本团队既往发表的DLS患者顶椎水平椎旁肌不对称退变的研究结果一致[24]。脊柱在冠状面的弯曲导致凸侧和凹侧弧长的不对称,受“弓弦效应”的影响,凸侧的肌肉被拉伸、变长、变细,而凹侧的则变短而结实,因此凹侧的多裂肌截面积应该大于凸侧。但本研究的结果却截然相反,凸侧下腰段多裂肌的FCSA明显大于凹侧,很可能是由于肌肉需要承受躯干重心向脊柱凹侧的偏移导致的高负荷,继而使之发生代偿性增生;而脊柱凹侧则由于负荷减少,相应表现出现废用性的萎缩。脊柱的稳定性是依靠脊柱本身和与之相关联的肌肉系统来维持的[13],当某一系统出现功能障碍时,另一系统则会出现代偿进行弥补。凸侧多裂肌FCSA的增加可能是为了补偿和维持冠状平衡而导致的肥大,凹侧多裂肌则因失用而萎缩,不同的生物力学环境导致凸凹侧FCSA差异。该结论可用于解释DLS的局部软组织代偿机制,印证了DLS病因的始动因素是椎间盘和椎间关节,而腰背肌是重要的平衡和代偿因素。
本研究结果显示DLS组Cobb角与L4~L5、L5~S1节段凸凹侧多裂肌FDI呈正相关,表明凸凹侧多裂肌不对称退变程度随畸形程度增加而增加。椎旁肌作为人体躯干姿势反射的效应器官,与脊柱侧凸的发生、发展可能存在密切关系。CHEUNG等[25-26]报告特发性脊柱侧凸患者顶椎区域及下终椎区域凹凸侧椎旁肌的肌电图存在差异,侧凸进展越快,差异越明显。CHAN等[27]研究表明特发性脊柱侧凸患者凹侧多裂肌异常高信号与侧弯程度有关。YAGI等[28]研究发现DLS患者双侧腰大肌CSA、多裂肌CSA不对称程度与脊柱骨盆参数及侧凸Cobb角存在相关性。对于接受保守治疗的DLS患者,合理的康复训练能够增加椎旁肌CSA,以拮抗侧凸进展和缓解症状[29-30]。因此,研究多裂肌的不对称性退变及评估方法对退变性腰椎侧凸的病理机制、全面评估和治疗决策具有重要的临床应用前景。
综上所述,本研究结果表明退行性腰椎侧凸患者下腰椎(L4~L5及L5~S1)节段对应的多裂肌退变程度与侧凸畸形的程度呈正相关,且凹侧重于凸侧,提示多裂肌参与退行性腰椎侧凸畸形的代偿机制。研究结果为进一步探索退行性腰椎侧凸的病理机制、评估技术、治疗决策及预后分析等临床应用奠定基础。
本研究存在一定的局限性:首先本研究的人群仅包括来自单一中心的受试者,样本量相对较小,需要进一步扩大样本含量。其次本研究主要通过影像学评估DLS患者多裂肌退变情况,缺乏病理学等直接证据证实多裂肌退变程度,同时对于竖脊肌、腰大肌等其他椎旁肌是否存在相似的退变情况,尚待进一步研究。再次退行性脊柱畸形是一种复杂的三维畸形,包括冠状位、矢状位和轴位畸形,本研究只分析冠状面Cobb角与凸凹侧多裂肌不对称退变相关性,未来的研究需要进一步探索矢状位和轴位畸形与不对称退变的相关程度。

