小白菊内酯对脓毒症大鼠肠屏障功能的保护作用
郭宁珂,佘 汉,谭 磊,周远群,彭小勇,李 涛,刘良明
453000 河南 新乡,新乡医学院第三附属医院外科1; 400042 重庆,陆军特色医学中心战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室2
脓毒症(sepsis)是人体对感染反应失调导致的器官功能障碍,是ICU中常见的危重病症,其发生率和病死率均很高。据统计,我国每年有300万脓毒症患者,约100万人死于脓毒症,迄今为止,脓毒症仍然是人类生命安全的巨大威胁。肠屏障功能在脓毒症发生发展的过程中发挥了重要作用。正常情况下,肠道屏障能够有效阻断病原体进入内环境,脓毒症时,肠道屏障被破坏,可导致肠道内菌群及内毒素移位,加重脓毒症的进程,并引起多器官功能障碍甚至死亡。目前关于肠屏障功能保护在脓毒症的治疗中越来越受到关注,保护肠道屏障,降低肠通透性对于脓毒症的防治具有重要的临床意义。目前针对脓毒症的常规治疗措施主要包括液体复苏、抗感染、抗凝等,但对肠屏障功能的保护效果并不显著,因此亟待寻找能够有效保护脓毒症肠屏障功能的新方法。
近年来中药对脓毒症器官功能的保护作用引起广泛的关注,小白菊内酯(parthenolide
,PTL)是从中药野甘菊中提纯的倍半萜内酯化合物,属于萜类化合物,其来源丰富,价格低廉,同时具有广泛的药理和生物活性。近年来研究发现,PTL具有良好的抗炎效果,对心脏缺血再灌注损伤、类风湿性关节炎等疾病具有重要的保护作用。同时,有研究报道,PTL可显著改善脓毒症大鼠的低血压。然而,PTL对脓毒症大鼠肠屏障功能是否具有保护作用,尚不清楚。为此本研究采用盲肠结扎穿孔术(cecal ligation and puncture,CLP)复制脓毒症大鼠模型,观察小白菊内酯对脓毒症大鼠肠道屏障功能的影响,为脓毒症的防治寻找新的措施。1 材料与方法
1.1 实验动物及主要试剂
成年SPF级SD大鼠,雌雄不拘,体质量(200±20)g,由陆军特色医学中心实验动物中心提供,动物饲养与动物实验过程均遵循动物伦理委员会的规定。PTL(美国Santa Cruz公司),伊文思蓝(Evans blue,EB)购自美国Sigma公司,白介素-1β(interleukin-1β, IL-1β)、D-乳酸、白介素-6(IL-6) 的酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA) 试剂盒购自武汉伊莱瑞特(Elabscience)生物科技股份有限公司。
1.2 脓毒症大鼠模型制备
大鼠用戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,消毒杀菌剪开腹腔,取出盲肠,将粪便擀至末端,结扎,用锥形器刺穿使粪便漏出,将盲肠还纳回腹腔,缝合伤口,腹腔注射5 mL生理盐水,放回笼中饲养。
1.3 实验方案
将96只大鼠随机分成6组:正常对照(Normal)组、脓毒症(Sep)组、常规治疗(LR)组和小白菊内酯1、5、10 mg/kg组(PTL组)。脓毒症组:采用盲肠结扎穿孔术制作脓毒症模型;常规治疗组:在脓毒症模型制作12 h后,经股静脉输注乳酸林格氏35 mL/kg+多巴胺5~10 μg/(kg·min),输注3 h,同时肌注头孢呋辛钠100 mg/kg,维持平均动脉压(mean arterial blood pressure, MAP)>70 mmHg;小白菊内酯组:在CLP建立前30 min尾静脉给予小白菊内酯(1、5、10 mg/kg),脓毒症模型制作12 h后,在常规治疗的基础上给予1、5、10 mg/kg小白菊内酯。每组16只用于观察大鼠存活时间和存活率变化,其中8只用于观察大鼠的血压。
根据大鼠存活率、存活时间和动脉血压确立PTL最佳浓度。后续实验将32只大鼠随机分成4组:正常对照(Normal)组、脓毒症(Sep)组、常规治疗(LR)组和小白菊内酯(PTL 5 mg/kg)组,每组8只,检测肠组织伊文思蓝(Evans blue, EB)含量、血D-乳酸水平、血炎症细胞因子水平、肝肾功能的变化。
1.4 检测指标及方法
1.4.1 大鼠存活情况观察 待液体复苏结束后,拔出大鼠股静脉插管并结扎,然后缝合伤口。将大鼠回笼饲养,正常饮食饮水,每小时观察1次,观察至复苏后48 h,记录大鼠的存活时间和状态。
1.4.2 肠组织EB含量测定 正常大鼠用30 mg/kg,其余各组用15 mg/kg戊巴比妥钠腹腔注射麻醉,打开腹腔,截取一段小肠,制备成肠囊,往肠囊中注射EB,冲洗肠腔至冲洗液澄清,烤干加入甲酰胺溶液在酶标仪上650 nm处测定光密度值[D
(650)],计算出每克肠干质量所含EB含量,反映肠道通透性。1.4.3 血D-乳酸浓度检测 CLP12 h 后,取大鼠腹主动脉血2 mL,室温下静置20 min,1 000×g
离心20 min,取上层血清,在酶标板条的各孔中加入标准品或样品,加入酶工作液,再加入显色剂37 ℃孵育10 min,加入终止液,酶标仪上振5 s,于波长530 nm处用比色法测定光密度值[D
(530)],制作标准曲线后计算D-乳酸浓度,反映肠道通透性。1.4.4 血炎症细胞因子水平的测定 CLP 12 h 后,抽取大鼠腹主动脉血2 mL,室温下静置20 min,1 000×g
离心20 min,取上层血清,在酶标板条的各孔中加入标准品或样品,37 ℃孵育90 min,倒去孔内液体,加入生物素化抗体工作液,37 ℃孵育60 min,洗涤3次,加入酶结合工作液,37 ℃孵育30 min,洗涤5次,加入底物溶液,37 ℃孵育15 min,加入终止液,在适宜波长处测定光密度值,分别制作标准曲线后计算各组大鼠血液所含IL-6、IL-1β浓度。1.4.5 大鼠小肠HE染色 大鼠腹腔麻醉固定,腹部开口,截取距胃端6~7 cm肠段,在冰的PBS溶液中冲洗表面血迹,4%多聚甲醛溶液固定48~72 h。固定时间结束取出肠组织,切成2~3 mm厚的小块,放置脱水盒中慢速水流冲洗过夜,再进行透明、浸蜡及包埋、切片、染色操作,封片晾干后在光学显微镜下观察。
1.4.6 肝肾功能的检测 CLP 12 h 后,取大鼠腹主动脉血2 mL,室温下静置20 min,1 000×g
离心20 min应用生化自动分析仪检测谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、尿素氮(urea nitrogen,Urea)、肌酐(creatinine,Crea)等指标。1.5 统计学分析
采用SPSS 17.0统计软件进行分析,数据以表示,多组间比较采用单因素方差分析,P
<0.05为差异有统计学意义。2 结果
2.1 PTL对脓毒症大鼠存活率和存活时间的影响
脓毒症组大鼠48 h存活率为0,常规治疗组大鼠48 h存活1只,存活率为6.2%,平均存活16 h;PTL 1 mg/kg组大鼠48 h存活2只,存活率为12.5%,平均存活时间为20 h;PTL 5 mg/kg组大鼠48 h存活8只,存活率为50%,平均存活时间为34 h;PTL 10 mg/kg组大鼠48 h存活4只,存活率为25%,平均存活时间24 h;PTL 10 mg/kg组大鼠48 h存活率不升反降,可能是由于药物浓度增高时毒性增强所致(图1),提示PTL的最佳治疗浓度为5 mg/kg。
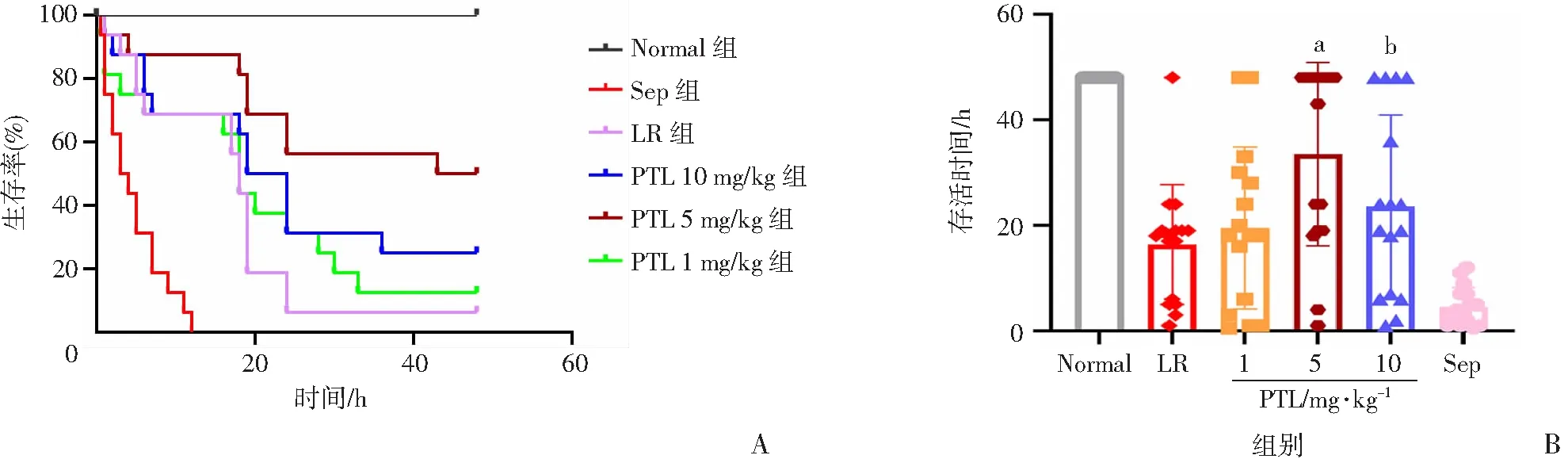
a:P<0.05,与LR组比较;b:P<0.05,PTL 5 mg/kg组比较
2.2 PTL对脓毒症大鼠MAP的影响
脓毒症组大鼠MAP降低,常规治疗组大鼠MAP较脓毒症组有所升高。与常规治疗组相比,PTL 1 mg/kg组大鼠MAP升高幅度不明显,PTL 5 mg/kg和10 mg/kg组能够显著升高脓毒症大鼠MAP,且PTL 5 mg/kg组MAP高于10 mg/kg组(图2)。提示PTL可显著提高脓毒症大鼠平均动脉血压,最适浓度为5 mg/kg,因此后续实验采用PTL 5 mg/kg。
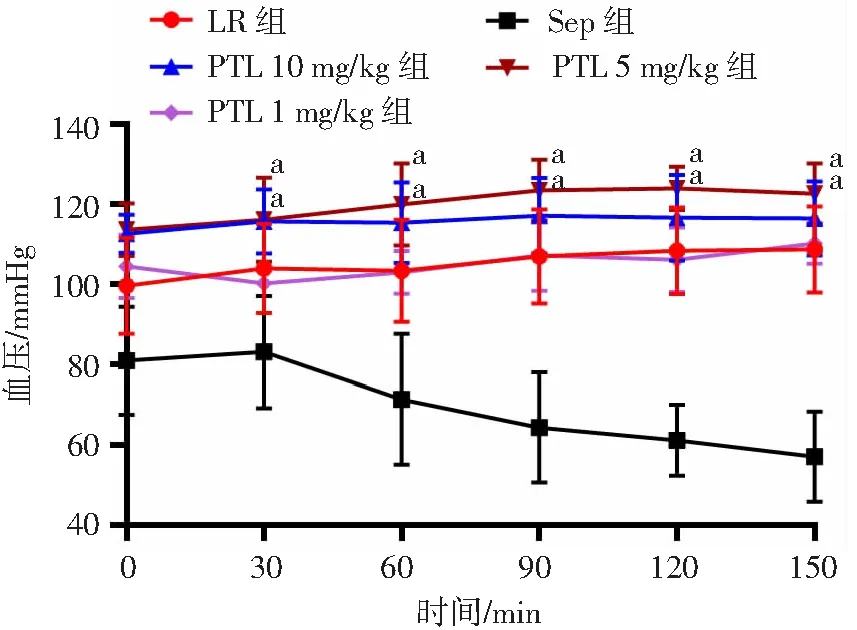
a: P<0.05,与LR组比较
2.3 PTL对脓毒症大鼠肠屏障功能的保护作用
以EB检测肠屏障功能,结果显示脓毒症组大鼠小肠表面颜色最深,提示EB渗漏最多。正常对照组大鼠小肠EB渗漏少,表面颜色浅,提示肠屏障功能好。PTL治疗后,大鼠肠屏障功能有所改善,EB渗漏减少。PTL 5 mg/kg组EB含量较常规治疗组降低了55.1%,差异有统计学意义(P
<0.05,图3B)。D-乳酸是肠道内细菌代谢及酵解的产物,是反映肠屏障功能的重要指标。结果显示,与正常对照组相比,脓毒症组血D-乳酸浓度平均增加比例为93.6%;与脓毒症组相比,常规治疗组血D-乳酸浓度降低了74.5%,差异有统计学意义(P
<0.05);与常规治疗组相比,PTL5 mg/kg组血D-乳酸浓度降低了69.5%,差异有统计学意义(P
<0.05,图3C)。脓毒症组大鼠肠上皮细胞脱落、大量炎性细胞聚集,腺体结构破坏,肠道绒毛结构严重破坏脱落;正常对照组小肠黏膜组织形态正常,PTL5 mg/kg组肠上皮结构完整性、绒毛结构、上皮细胞坏死等较脓毒症组有明显改善(图3D)。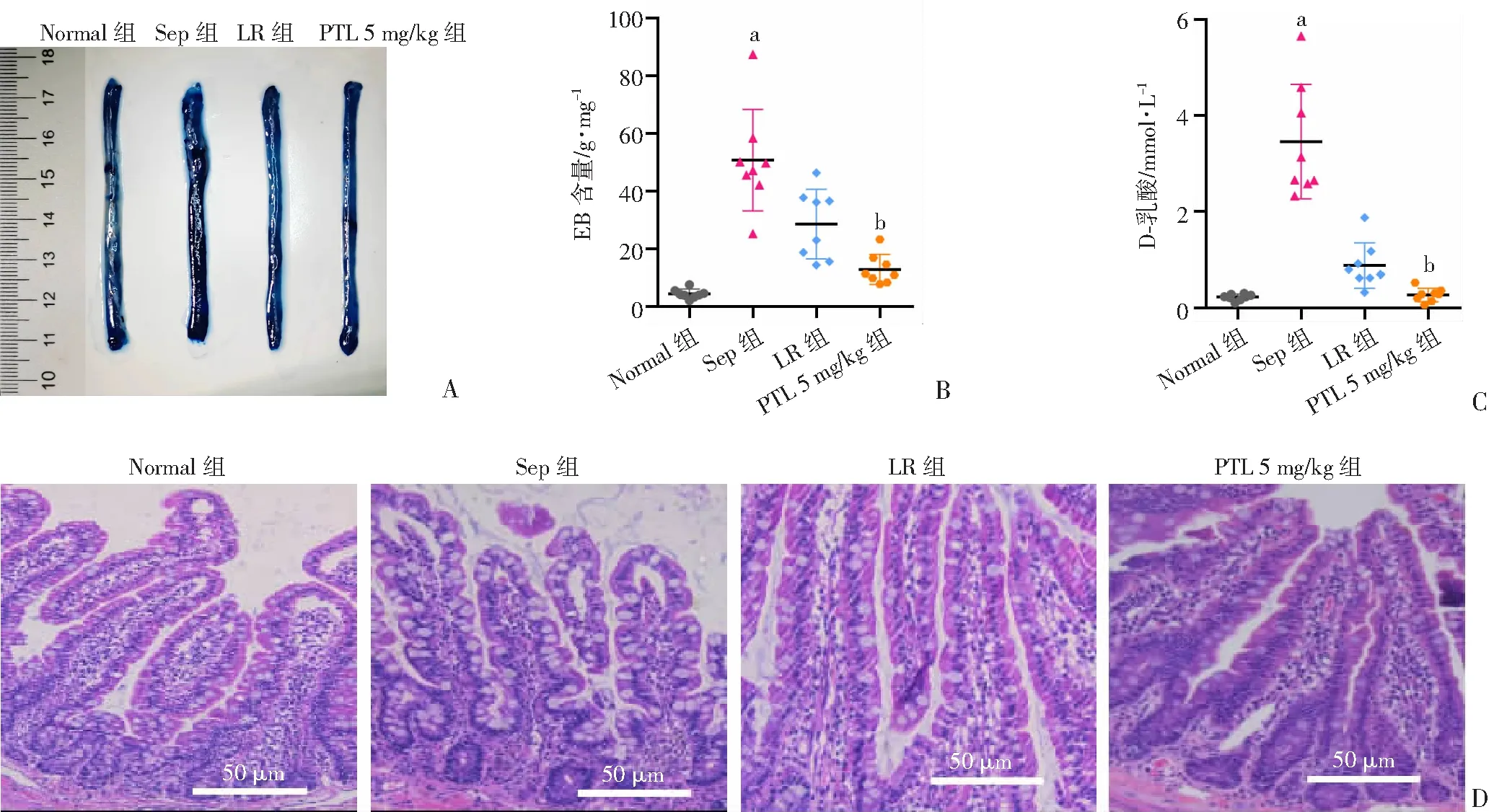
a:P<0.05,与Normal组比较;b:P<0.05,与LR组比较
2.4 PTL对脓毒症大鼠血炎症细胞因子IL-6、IL-1β水平的影响
脓毒症组大鼠血中IL-6、IL-1β水平较正常对照组显著升高(P
<0.05,图4);常规治疗组大鼠血IL-6浓度较脓毒症组降低了76.0%;PTL 5 mg/kg组IL-6浓度进一步降低,较常规治疗组降低了93.4%,差异有统计学意义(P
<0.05,图4A)。脓毒症大鼠血IL-1β浓度在常规治疗后下降7.8%;给予PTL治疗后,IL-1β浓度显著降低,较常规治疗组下降了62.4%,差异有统计学意义(P
<0.05,图4B)。表明PTL可以显著抑制炎症细胞因子释放,抑制炎症反应。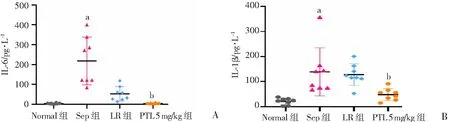
a:P<0.05,与Normal组比较;b:P<0.05,与LR组比较 A: IL-6;B: IL-1β
2.5 PTL对脓毒症大鼠肝肾功能的影响
脓毒症组大鼠AST、ALT水平较正常对照组显著增加,常规治疗组AST和ALT较脓毒症组显著降低, 分别降低了30.4%和38.6%(P
<0.05); PTL 5 mg/kg组AST和ALT进一步下降,较常规治疗组分别降低了24.6%和28.5%,差异有统计学意义(P
<0.05,图5A、B)。脓毒症组大鼠尿素氮和肌酐水平较正常对照组显著增加,常规治疗组大鼠尿素氮和肌酐水平较脓毒症组有所下降,分别下降了27.1%和 20.6%,PTL 5 mg/kg组大鼠尿素氮和肌酐水平进一步降低,较常规治疗组分别降低了25.6%和27.6%,差异有统计学意义(P
<0.05,图5C、D)。结果提示PTL可以减轻脓毒症时肝、肾功能的损伤。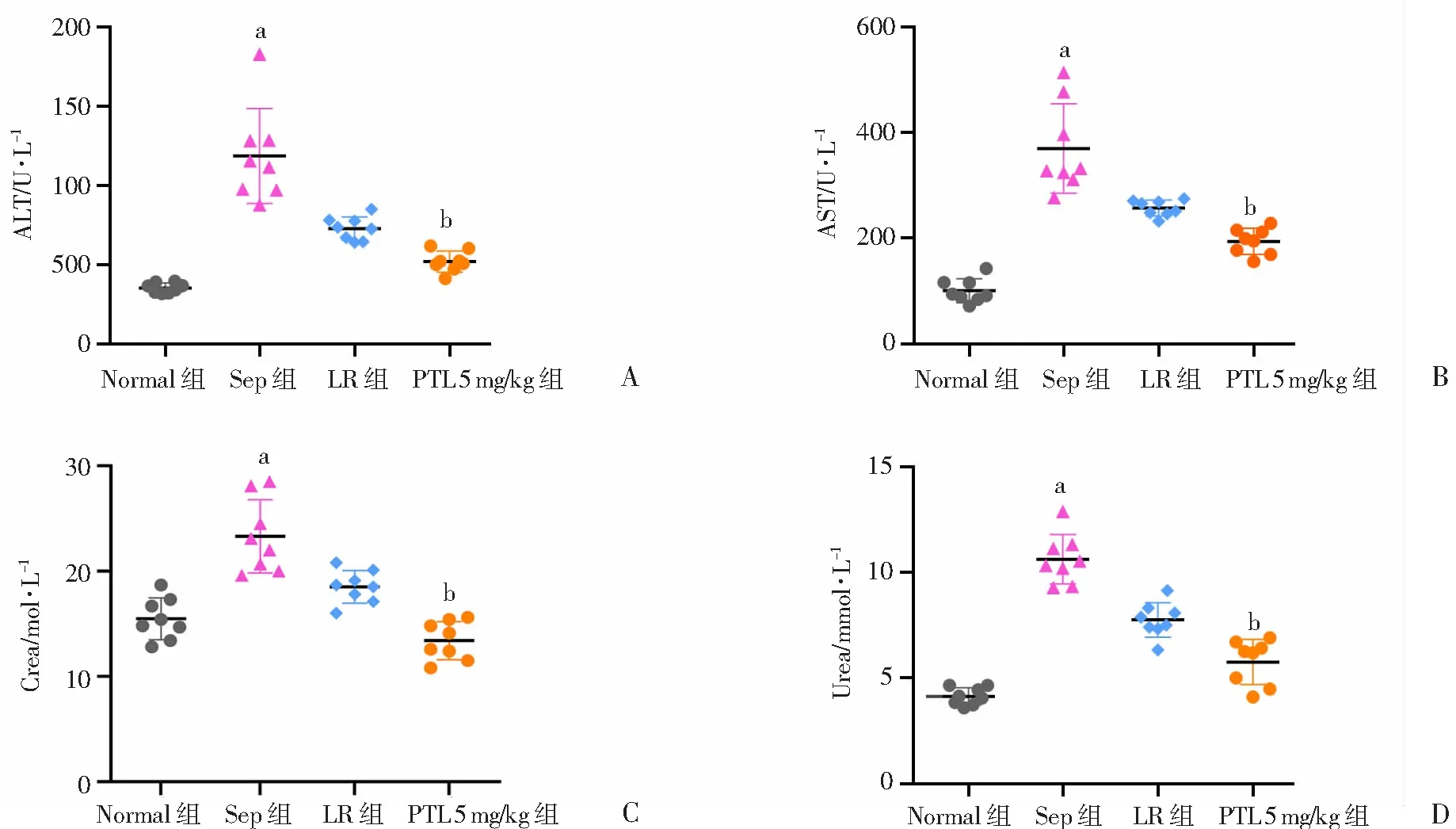
a:P<0.05,与Normal组比较;b:P<0.05,与LR组比较 A: ALT;B: AST;C: Crea;D: Urea
3 讨论
脓毒症时由于肠屏障功能受损,导致肠道菌群易位,可加重脓毒症和失控炎症反应,并最终导致多器官功能衰竭。为了寻找有效的保护脓毒症肠屏障功能方法,本实验利用CLP脓毒症大鼠模型研究了小白菊内酯PTL对肠屏障功能的保护作用。 结果发现,PTL对脓毒症大鼠肠道屏障功能具有明显的保护作用,可明显降低脓毒症大鼠的肠道通透性,降低脓毒症大鼠血液炎症细胞因子水平,保护其重要器官功能,提高脓毒症大鼠存活率。PTL对脓毒症大鼠肠屏障功能的保护作用可能与其抗炎作用有关。
肠道被认为是多器官功能衰竭的“中心器官”,脓毒症、创伤后肠道屏障功能受损,肠通透性增加,引起肠道细菌和内毒素易位,严重损害各器官功能,最终导致多器官功能衰竭(MODS)。此外,肠道免疫系统的完整性和调节功能是宿主防御对抗外来物的基础,在脓毒症过程中,肠道免疫功能失常,中性粒细胞被激活、大量炎性因子产生、氮氧反应物质释放增加炎症反应。PTL是一种倍半萜类化合物,具有显著的抗炎作用,对缺血再灌注和自身免疫性脑脊髓炎有良好拮抗作用。本研究发现,PTL对脓毒症大鼠肠屏障功能有良好保护作用,同时发现其对脓毒症大鼠肝肾功能也有很好的保护作用,具有很好的抑制炎症反应作用,可显著抑制脓毒症大鼠细胞因子释放。
研究表明PTL可阻断NF-κB信号通路。PTL独特的化学结构能抑制转录因子NF-κB、STATS、JNK,NF-κB的过度激活是脓毒症患者预后不良的标志,可通过NF-κB信号通路抑制过度炎症,抑制多器官功能障碍的发生发展。在以往的研究中发现,IκB激酶可磷酸化降解,导致NF-κB激活。PTL可阻断IκB蛋白的磷酸化和降解,下调磷酸化NF-κB p65的表达。因此,我们推测PTL可能通过调节NF-κB信号通路,减少炎性因子释放,改善脓毒症的肠通透性。当然,PTL保护脓毒症大鼠肠道屏障功能的具体机制需要进一步研究阐明。
本研究结果证实,PTL可以降低脓毒症大鼠肠道通透性、保护肠屏障功能,其机制可能与其抑制炎症因子释放有关。但PTL对脓毒症大鼠肠屏障功能保护的具体机制尚需进一步研究阐明;而PTL在大动物和人脓毒症是否有同样效果亦需要进一步研究证实。

