瑞咯啶对脓毒症大鼠心肌损伤的保护作用
谭 磊,佘 汉,郭宁珂,周远群,彭小勇,刘良明,李 涛,毛庆祥,胡 弋
400042 重庆,陆军特色医学中心:麻醉科1,野战外科研究部战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室2
脓毒症是一种危及生命的器官功能障碍,是由于宿主对感染的反应失调引起。而心脏是人体最重要的器官,当脓毒症伴随心肌功能的严重损害时其死亡率可高达40%。针对脓毒症心肌损伤,目前临床主要治疗措施包括补充有效血容量、抗感染等对症处理,尚没有确切有效的治疗措施。
瑞咯啶(复方电解质注射液Ⅱ)是一种新型的晶体液,其理论渗透浓度309 mOsmol/L,实测渗透压290 mOsmol/kg HO,与血浆保持一致。并且瑞咯啶电解质含量与血浆成分相近;更重要的是瑞咯啶配方中含有L-苹果酸(330 mg/500 mL),L-苹果酸作为碳酸根前体,可有效减低液体中氯离子含量,降低高氯性酸中毒风险,改善预后。一项荟萃分析发现,高氯晶体液与急性肾损伤(acute kidney injury,AKI)/肾衰风险显著增加相关。苹果酸可在肌肉中被代谢,因此与醋酸盐类似,比乳酸盐更有优势。而对比醋酸盐半衰期15 min,苹果酸盐半衰期为30~60 min,其维持时间更长,更有利于改善体内水电解质酸碱平衡紊乱。研究显示瑞咯啶治疗失血性休克效果较乳酸林格液和醋酸林格液更佳,且在器官功能保护方面有明显的优势。瑞咯啶因含有特殊成分苹果酸能改善心肌缺血再灌注损伤,增强心肌收缩力,减少心肌损伤后炎性因子表达。瑞咯啶用于危重的埃博拉病毒感染的患者,可维持循环稳定,治疗效果明显。但瑞咯啶对脓毒症心肌损伤是否具有保护作用,目前尚不清楚。为此,本研究利用盲肠结扎穿孔术(cecal ligation and puncture,CLP)制备大鼠脓毒症模型,观察瑞咯啶是否对脓毒症大鼠心肌功能有保护作用,为脓毒症心肌损伤提供有效的治疗选择。
1 材料与方法
1.1 实验动物与试剂
SPF级SD大鼠280只,雌雄各半,12~14周龄,体质量200~220 g(由陆军特色医学中心实验动物中心提供)。瑞咯啶(Sterofundin)购自德国B.布劳恩·梅尔桑根股份有限公司(B.Braun Melsungen AG);乳酸林格液购自中国四川科伦药业股份有限公司;多巴胺注射液购自中国亚邦医药股份有限公司。
1.2 脓毒症大鼠模型制备
SD大鼠术前禁食8 h,自由饮水,根据文献[11]方法制备大鼠CLP脓毒症模型。制作模型12 h后,监测平均动脉血压( mean arterial blood pressure,MAP),当MAP下降30%或以上,模型建立成功。本实验脓毒症模型成功率>90%。
1.3 实验分组及设计
将SD大鼠按随机数字抽样法平均分成4组,①假手术(Sham) 组:不做任何处理仅开关腹;②脓毒症(sepsis, Sep) 组:盲肠结扎穿孔术(CLP)制作脓毒症模型;③常规治疗(conventional treatment,Ct)组:脓毒症模型12 h后,经股静脉输注乳酸林格氏液35 mL/kg+多巴胺5~10 μg/(kg·min)3 h,同时肌注头孢呋辛钠100 mg/kg,维持MAP>70 mmHg;④瑞咯啶治疗(malate ringer’s solution,Mr)组:在CLP建立12 h后,经股静脉输注瑞咯啶35 mL/kg+多巴胺5~10 μg/(kg·min)3 h,同时肌注头孢呋辛钠100 mg/kg,维持MAP>70 mmHg。
实验分为5批进行,第1批(n
=8)在治疗完成2 h后用于检测大鼠心输出量(cardiac output,CO)和肝肾功,第2批(n
=32)在建立CLP模型前、CLP 12 h、复苏后1 h和复苏后2 h这4个时间点检测心肌损伤标志物和肝肾血流量变化情况,每个时间点用8只大鼠不重复使用,第3批(n
=8)在复苏结束2 h后测MAP及动静脉血气分析,第4批(n
=6)在复苏结束后2 h取心脏组织做病理切片,第5批(n
=16)用于观察大鼠的存活时间和存活率。1.4 检测指标及方法
1.4.1 大鼠心输出量(CO)、心脏指数、每搏指数及肝肾功测定 大鼠麻醉固定行颈静脉插管,将导管开口端送至右心开口处,颈动脉插入热稀释导管至主动脉近心端后能观察到导管明显搏动,连接心输出量测定仪(CardiomaxⅢ,美国),将温度探头放入0 ℃冰盐水中,待温度探头温度稳定后,经颈静脉快速推注0.3 mL冰盐水,同时按下检测按钮记录各组大鼠CO和心率(heart rate,HR),根据文献[12]的方法计算心脏指数(cardiac index,CI)、每搏指数(stroke index,SI)和CO等。检测完成后经颈静脉插管抽静脉血用全自动生化仪进行检测谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、尿素氮(urea nitrogen,Urea),肌酐(creatinine,Crea)。
1.4.2 大鼠心损标志物、肝肾血流量测定 大鼠麻醉后固定于鼠板并开腹充分暴露肝、肾器官,置于激光散斑血流量测定仪探头正下方,器官位于激光中央;检测肝、肾血流量,每次的测量需在器官的相同位置;软件读取器官血液灌注量数据并保存,采集图片并保存;随后采集静脉血1 mL用全自动生化仪进行检测心肌肌钙蛋白T(cardiac troponin T,cTnT)和乳酸脱氢酶(lactate dehydrogenase, LDH)。
1.4.3 大鼠MAP及动静脉血气测定 大鼠麻醉固定后进行股动、静脉插管,插管完成后连接血压计测MAP,完成后分别抽取动、静脉血各1 mL用血气分析仪测定动、静脉血气,记录血气氧分压(pO)、血红蛋白(Hb)、动脉血氧饱和度(SaO)以及静脉血氧饱和度(SvO),根据文献[13-14]的方法计算组织氧供(DO=CI
×13.4×Hb×SaO)和氧耗[VO=CI
×13.4×Hb×(SaO-SvO)]。1.4.4 大鼠心脏组织HE染色 大鼠麻醉后固定,剪开胸腔取出心脏,立即在PBS溶液中冲洗净心腔内血液,4%多聚甲醛溶液固定48~72 h。固定后取心尖相同部位组织切成2~3 mm厚的小块,放置脱水盒中慢速水流冲洗过夜,随后进行透明、浸蜡、包埋、切片及染色处理,封片晾干后在光学显微镜下观察。
1.4.5 大鼠存活情况观察 大鼠治疗结束后结扎血管,逐层缝合伤口,放回笼内正常饮食饮水,每30分钟观察1次,观察至治疗后24 h,记录大鼠的生存状态和存活时间。
1.5 统计学分析
采用SPSS 20.0统计软件进行分析。数据以表示。多组比较进行单因素方差分析。P
<0.05认为差异具有统计学意义。2 结果
2.1 瑞咯啶对脓毒症大鼠心脏功能的影响
与Sham组比较,Sep组大鼠CO、CI、SI明显降低;与Sep组比较,Ct组大鼠CO、CI和SI有所改善(P
<0.05);Mr组大鼠CO、CI和SI明显改善,较Sep组分别增加了48.9%、52.9%和21.7%,且明显高于Ct组(P
<0.05)。同时Sep组大鼠血压明显降低,降低至70 mmHg左右;Ct组血压稍有回升到90 mmHg左右;而Mr组血压改善更明显,与Sep组比较血压增加了43.2%(P
<0.05)。进一步检测了心肌损伤标志物肌钙蛋白T(cTnT)和乳酸脱氢酶(LDH)水平,结果发现Sep组cTnT和LDH随时间延长呈现上升趋势,说明心肌损伤逐渐加重;Ct组cTnT稍微有所回降,但LDH仍然处于较高水平,心肌损伤无明显缓解;与Sep组和Ct组比较,Mr组cTnT和LDH均明显下降,说明心肌损伤得到明显改善。通过心脏病理切片HE染色放大20倍,结果发现Sham组大鼠心肌纤维结构排列整齐;Sep组大鼠心肌细胞明显肿胀伴空泡形成,心肌纤维排列紊乱,间隙增宽;Ct组较Sep组变化稍有改善;Mr组大鼠心肌细胞间质水肿明显减轻,心肌纤维排列紊乱明显恢复,见图1。提示瑞咯啶可显著改善脓毒症大鼠心脏功能。通过分析Ct组和Mr组多巴胺输注量发现, 两组输注量分别是(6.25±0.71)μg·kg·min和(6.00±0.53)μg·kg·min,差异无统计学意义(P
>0.05)。说明两组的效果差异主要来自Mr复苏液。
a:P<0.05,与Sham组比较;b:P<0.05,与Sep组比较;c:P<0.05,与Ct组比较
2.2 瑞咯啶对脓毒症大鼠重要器官肝肾功能的影响
通过激光血流测定仪发现Sep组大鼠肝肾血流量明显降低;Ct组输注LR后即刻大鼠肝肾血流量明显改善,但是随着时间的延长,肝肾血流量明显降低,不能很好地维持在较高水平;Mr组输注MR后肝肾血流量明显改善,且能维持在较高水平,输注后即刻,1、2、3 h肝肾血流量较Sep组分别增加28.4%、14.3%、49.7%、70.6%,肾血流量分别增加115.2%、109%、103.1%、108%。通过检测ALT、AST、Crea、Urea水平发现,Mr输注后显著减轻大鼠肝肾功能损伤。检测大鼠氧供氧耗发现Sep组大鼠的氧供和氧耗均显著降低,较Sham组分别降低53.3% 和46.7%;Ct组氧供和氧耗有所改善,与Sep组比较分别增加25%和24.6%;Mr组大鼠氧供和氧耗提升明显,与Sep组比较分别增加49.1%(P
<0.05)和53.6%(P
<0.05)。与此同时,大鼠血气分析结果显示Sep组乳酸明显增高,Ct组经常规治疗2 h后大鼠体内乳酸水平稍减少32.1%;而经瑞咯啶治疗2 h后大鼠血气乳酸水平较Sep组效果更明显,减少40.6%(P
<0.05),见图2。表明MR可通过提高肝肾等重要器官灌注改善器官功能。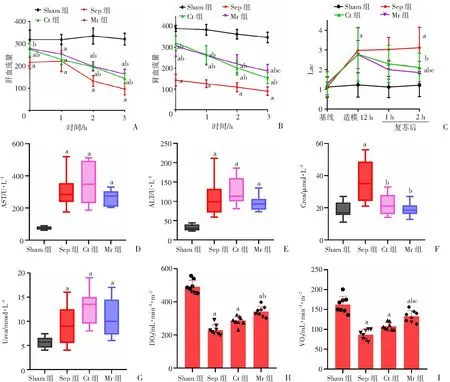
a:P<0.05,与Sham组比较;b:P<0.05,与Sep组比较;c:P<0.05,与LR组比较
2.3 瑞咯啶对脓毒症大鼠存活率和存活时间的影响
Sep组无大鼠存活至24 h;Ct组较Sep组存活时间稍有延长,24 h存活率为6.25%;而Mr组大鼠生存明显延长[(17.6±6.8)h]且与Sep组比较差异明显(P
<0.05),24 h存活率为31.3%,见图3。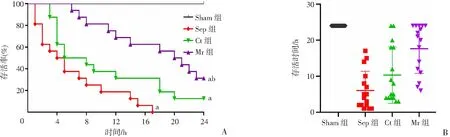
a:P<0.05,与Sham组比较;b:P<0.05,与Sep组比较
3 讨论
本研究通过CLP脓毒症大鼠模型发现瑞咯啶对脓毒症所致心肌损伤有明显的保护作用。输注瑞咯啶后可明显提高脓毒症大鼠的CO、CI、SI及MAP,改善心脏功能,减轻心肌细胞间质水肿与心肌组织损伤;改善了脓毒症大鼠氧供、氧耗状态,进一步提高肝、肾等重要脏器血液灌注,改善器官功能,最终提高脓毒症大鼠的存活率和生存时间。
脓毒症是包括生理、生物和生化及内环境紊乱的过度炎症反应综合征,由机体对感染的反应失调引起。脓毒症和后续炎症反应可导致多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)和死亡。据全球疾病负担研究显示,2017年估计有4 890万例新发脓毒症,死亡病例约为1 100万,占全球总死亡数的19.7%。脓毒症所致的心肌损伤是引发多器官功能障碍的关键环节,是脓毒症发生、发展的重要病理基础,当脓毒症伴随心肌功能的严重损害时其死亡率可高达40%。因此寻找能够有效保护脓毒症心功能的措施具有极其重要的临床意义。
根据脓毒症的最新救治指南,针对脓毒症首先应进行晶体扩容,而目前临床常用的晶体液乳酸林格液虽然能快速补充有效血容量,发挥其复苏作用,但由于其成分单一,治疗效果有限,且含有28 mmol/L的乳酸根,会加重脓毒症后机体乳酸堆积,导致高乳酸血症;其中Na131 mmol/L,明显低于血浆Na浓度,大量输注后易导致低钠血症;且渗透压明显低于血浆,脓毒症时大量补充乳酸林格液结果导致组织水肿加重,因此复苏效果有限。
瑞咯啶作为一种新型复苏晶体液,近年来在围术期的应用中备受关注。本研究发现瑞咯啶输注后可明显提高脓毒症大鼠CO,较脓毒症大鼠CO增加高达48.9%(P
<0.01),同时心肌细胞间质水肿明显减轻,心肌纤维排列紊乱明显恢复,因此瑞咯啶对脓毒症大鼠心功能有明显改善有作用;更重要的是瑞咯啶含有细胞能量代谢不可或缺的中间代谢物——L-苹果酸(330 mg/500 mL)。既往研究显示在脓毒症状态下机体心肌损伤使心肌细胞线粒体功能障碍, ATP合成严重不足,心肌细胞能量代谢障碍,心功能障碍进一步加重。而苹果酸可通过苹果酸天冬氨酸穿梭,将外源性苹果酸通过苹果酸-α-酮戊二酸转运蛋白(oxoglutarate malate carrier, OMC)通道进入细胞线粒体内,在苹果酸脱氢酶的作用下生成NADH,心肌细胞中的NADH在脱氢酶的作用下,使草酰乙酸还原成苹果酸,后者通过线粒体内膜上的OMC进入基质,在基质脱氢酶的作用下重新生成草酰乙酸和NADH;NADH 进入电子呼吸链生成ATP,而基质内生成的草酰乙酸经谷草转氨酶的作用生成天冬氨酸,后者经谷氨酸天冬氨酸转运蛋白(aspartate glutamate carrier, AGC)转运出基质再转变成草酰乙酸,继续进行穿梭。因此,输注瑞咯啶可能持续外源性补充苹果酸从而增加了心肌能量合成的原材料,苹果酸通过苹果酸天冬氨酸穿梭持续产生ATP,为脓毒症所致的损伤心肌持续供能,从而改善心肌细胞线粒体功能,改善心脏功能。与此同时苹果酸是三羧酸循环代谢中间物,直接参与心脏线粒体能量代谢,合成ATP,调节线粒体功能,从而发挥对脓毒症心肌损伤的保护作用。本研究发现瑞咯啶对脓毒症大鼠心肌损伤有重要保护作用,其机制可能与其改善心肌细胞能量供应密切相关;但其是否能改善心肌细胞线粒体功能还有待研究;而瑞咯啶在人脓毒症中是否有效亦需进一步研究证实。

