右美托咪定对脓毒症大鼠肠道屏障功能的保护作用
周世洁,王 莉,刘良明,李 涛,闫 红
400042 重庆,陆军特色医学中心:麻醉科1,战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室2
脓毒症是宿主对感染反应失调而导致的危及生命的器官功能障碍。长时间以来,肠道被认为在脓毒症的发生发展过程中起着至关重要的作用,是引起多器官功能障碍综合征的助推器。脓毒症时产生的前炎症细胞因子,包括TNF-α、IL-1β等会引起肠绒毛损伤萎缩、肠上皮细胞凋亡,导致肠道屏障功能破坏、通透性增加,肠道细菌及其释放的内毒素进入血液循环,引起肠源性感染,对脓毒症患者造成致命打击。因此研究脓毒症肠道屏障功能保护措施对提高脓毒症患者救治率有重要意义。
右美托咪定是一种高效、高选择性的α2肾上腺素能受体激动剂,具有镇静良好、易唤醒、不引起明显呼吸抑制、显著减少患者术后谵妄等作用,目前广泛应用于重症和围术期患者。近年来研究报道右美托咪定对脓毒症引起的器官功能损伤具有保护作用,但右美托咪定对脓毒症肠道屏障功能是否具有保护作用,目前尚不清楚。对此,本研究采用大鼠盲肠结扎穿孔术(cecal ligation and puncture,CLP)构建脓毒症模型和LPS处理的细胞(RAW264.7)模型,观察右美托咪定对脓毒症大鼠肠道通透性、前炎症细胞因子、肠道病理结构、巨噬细胞极化等的影响,探究其对脓毒症大鼠肠道屏障功能的保护作用及机制,为脓毒症治疗提供新的方法。
1 材料与方法
1.1 实验动物与试剂
成年雄性SPF级SD大鼠,体质量(200±20)g,由陆军特色医学中心实验动物中心提供。盐酸右美托咪定注射液购自中国扬子江药业集团有限公司;伊文思蓝(Evans blue, EB)、iNOS抗体购自美国Sigma公司;二胺氧化酶(diamine oxidase,DAO)、肿瘤坏死因子-ɑ(tumour necrosis factor ɑ,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒购自Elabsicence公司;2,6-二异丙基苯胺(2,6-diisopropylaniline,DAPI)购自美国Aabcam公司。
1.2 大鼠脓毒症模型制备
大鼠术前12 h禁食,自由饮水。根据本实验室前期报道的方法,用3%戊巴比妥钠(30 mg/kg)腹腔麻醉,制作脓毒症模型。脓毒症模型术后12 h,观察大鼠平均动脉压(mean arterial blood pressure, MAP),MAP下降30%及以上,认为模型制备成功。
1.3 实验方案
1.3.1 实验设计与分组 128只SD大鼠按照随机数字表法分为4组,每组32只大鼠。假手术(Sham)组:仅开腹关腹,不做盲肠结扎穿孔术;脓毒症组(sepsis, Sep组):采用盲肠结扎穿孔术建立脓毒症模型;常规治疗组(conventional treatment, Ct组):在脓毒症组建模术后12 h,经股静脉插管输注林格氏液(35 mL/kg)+血管活性药物多巴胺(1.75 mg/kg),输注速度为2.5 mL/h,同时肌注抗生素头孢呋辛纳(100 mg/kg);右美托咪定组(Dex组):在盲肠结扎穿孔术前30 min,经尾静脉注射右美托咪定(10 μg/kg),术后12 h,在常规治疗基础上经股静脉输注右美托咪定(10 μg/kg)。实验分为3批:第1批(每组16只)用于观察SD大鼠24 h存活时间和存活率;第2批(每组8只)在复苏完成后用于检测SD大鼠肠道通透性和小肠病理变化;第3批(每组8只)在复苏结束后用于检测血浆中前炎症细胞因子水平和肠道巨噬细胞极化情况。
1.3.2 RAW264.7细胞模型构建 将RAW264.7巨噬细胞分为3组,正常对照(Control)组:PBS清洗培养皿后,更换为无血清培养基培养12 h;脂多糖(lipopolysaccharide,LPS)组:PBS清洗培养皿后,更换为无血清培养基,并加入500 ng/mL LPS处理12 h;Dex组:PBS清洗培养皿后,替换为无血清培养基,然后给予1 μmol/L右美托咪定,待30 min后,再加入500 ng/mL LPS处理12 h。实验前1 d将RAW264.7细胞接种于培养皿内,每个培养皿细胞数为1×10/mL。取细胞上清液用于测定细胞上清液中前炎症细胞因子(TNF-α)水平。
1.4 检测指标
1.4.1 存活时间和存活率 脓毒症大鼠复苏完成后,拔出股静脉插管同时结扎血管,并逐层缝合伤口。然后将大鼠放回笼中正常饲养,自由进食饮水,每30 min观察1次,直至复苏后24 h,记录大鼠的存活时间和存活率。
1.4.2 肠道通透性 为观察右美托咪定对脓毒症大鼠肠屏障功能的保护作用,分别采用EB灌注肠腔测定肠组织的通透性和取静脉血检测DAO含量,观察肠道通透性。脓毒症大鼠复苏完成后,取静脉血1 mL,室温下静置30 min,3 500 r/min 离心10 min,取上层血清,ELISA试剂盒检测血中DAO含量。另取一段长约7 cm的小肠,用PBS冲洗干净肠腔并制备成肠囊,注入0.2 mL 1.5% 的EB溶液,37 ℃水浴30 min,打开肠囊,PBS冲洗至冲洗液澄清后50 ℃干燥24 h,记录肠干质量,加入甲酰胺溶液于50 ℃孵育24 h,用酶标仪检测上清,读取波长650 nm处的光密度值,根据D
(650)值计算肠组织中EB含量。1.4.3 肠组织病理结构 脓毒症大鼠复苏完成后,将其麻醉固定,开腹,取一段肠组织用PBS冲洗干净后,置于4%多聚甲醛中固定,常规脱水、包埋、切片、HE染色,用光学显微镜观察肠组织病理结构情况。
1.4.4 血清前炎症细胞因子 复苏完成后,经静脉取血2 mL,室温下静置30 min,3 500 r/min 离心10 min,取上层血清,采用ELISA法检测大鼠血清中TNF-α、IL-1β含量。
1.4.5 免疫荧光观察肠道巨噬细胞iNOS表达 复苏完成后,将大鼠麻醉固定开腹,取一段肠组织,用冰PBS冲洗肠腔,放入4%多聚甲醛中固定24 h,20%蔗糖脱水24 h后,换用30%蔗糖脱水24 h,待样本沉底后,用OCT包埋,做冰冻切片(切片厚度为20 μm)。PBS洗涤3次,每次5 min,3%过氧化氢处理10 min,PBS洗涤3次,每次5 min,滴加羊血清室温下封闭30 min,吸去多余液体,滴加稀释的一抗(iNOS,1∶200),4 ℃过夜,PBS洗涤3次,每次5 min,滴加与一抗相对于的荧光二抗,室温下避光孵育1 h,PBS洗涤3次,每次5 min,DAPI(1∶50)37 ℃避光反应10 min,PBS洗涤3次,每次5 min。在Leica激光共聚焦显微镜下观察iNOS的表达。
1.4.6 免疫荧光观察离体巨噬细胞iNOS表达 将RAW264.7细胞接种至共聚焦培养皿,待细胞生长良好后,弃培养基,用4%多聚甲醛固定30 min,PBS洗涤3次,每次5 min,滴加羊血清室温下封闭30 min,吸去多余液体,滴加稀释的一抗(iNOS,1∶200),4 ℃过夜,PBS洗涤3次,每次5 min,滴加与一抗相对于的荧光二抗,室温下避光孵育1 h,PBS洗涤3次,每次5 min,DAPI(1∶50)37 ℃避光反应10 min,PBS洗涤3次,每次5 min。在Leica激光共聚焦显微镜下观察iNOS的表达。
1.4.7 细胞上清前炎症细胞因子水平检测 收集各组细胞上清液,依据ELISA试剂盒方法检测细胞上清液中TNF-α含量。
1.5 统计学分析
采用SPSS 23.0统计软件进行分析,数据以表示,多组间比较采用单因素方差分析,存活时间和存活率用Kaplan-Meier法分析。P
<0.05为差异具有统计学意义。2 结果
2.1 右美托咪定对脓毒症大鼠存活时间和存活率的影响
脓毒症组大鼠24 h存活1只,存活率为6.25%,存活时间为(5.70±6.36)h;常规液体治疗组大鼠24 h存活2只,存活率为12.50%,存活时间为(10.10±7.80)h,与脓毒症组相比,存活时间有所增加;右美托咪定治疗组大鼠24 h存活6只,存活率为37.50%,存活时间为(18.30±5.80)h,存活率较常规治疗组显著提高,存活时间明显延长,差异有统计学意义(P
<0.05,图1)。
a:P<0.01,与Sham组比较;b:P<0.05,与Ct组比较; c:P<0.01,与Sep组比较
2.2 右美托咪定对脓毒症大鼠肠道通透性的影响
EB灌注肠腔结果发现:脓毒症后大鼠肠组织渗漏明显,与假手术组相比差异有统计学意义(P
<0.01);常规液体治疗后,肠道屏障功能有部分改善;经右美托咪定治疗后,脓毒症大鼠肠屏障功能明显改善,与常规治疗组相比,差异有统计学意义(P
<0.01,图2A)。假手术组大鼠血中DAO含量为(0.34±0.04)ng/mL,与假手术组比较,脓毒症组大鼠血中DAO含量明显增加,为(6.32±0.83)ng/mL,差异有统计学意义(P
<0.01);常规治疗组大鼠血中DAO含量为(5.89±1.01)ng/mL,与脓毒症组相比差异无统计学意义(P
>0.05);右美托咪定可明显降低血中DAO含量,其值为(4.47±0.81)ng/mL,与常规治疗组比较差异有统计学意义(P
<0.05)(图2B)。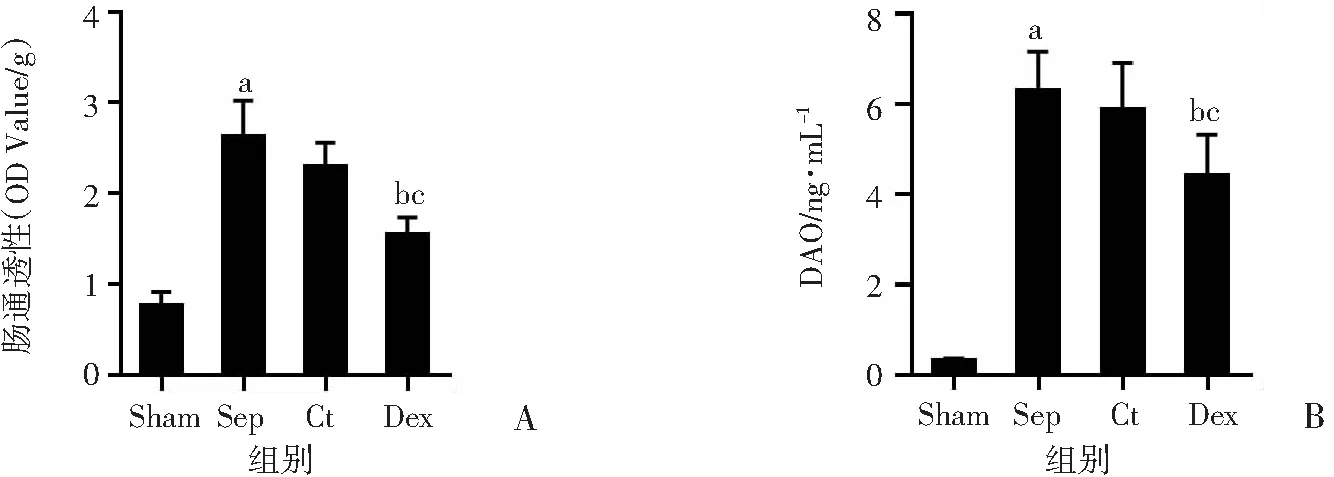
a:P<0.01,与Sham组比较;b:P<0.05,与Ct组比较; c:P<0.01,与Sep组比较
2.3 右美托咪定对脓毒症大鼠肠组织结构的影响
肠组织HE染色结果显示:假手术组大鼠肠绒毛结构完整清晰,柱状上皮细胞排列整齐,未见红细胞及炎性细胞浸润;脓毒症组肠绒毛萎缩、断裂,红细胞和炎性细胞浸润明显;常规治疗组未见明显改善;右美托咪定治疗后,肠绒毛萎缩情况明显好转,肠绒毛排列整齐,红细胞及炎性细胞浸润减少,肠组织结构显著恢复,提示右美托咪定改善了脓毒症大鼠肠病理损伤(图3)。

A: Sham组;B:Sep组;C:Ct组;D:Dex组
2.4 右美托咪定对脓毒症大鼠血前炎症细胞因子水平的影响
与假手术组相比,脓毒症组大鼠血清前炎症细胞因子TNF-α、IL-1β明显增加,差异有统计学意义(P
<0.01);常规治疗组大鼠血清前炎症细胞因子TNF-α、IL-1β有一定程度下降,与脓毒症组相比,降低比例为10.56%,无显著性差异(P
>0.05);右美托咪定治疗后,大鼠血清前炎症细胞因子TNF-α、IL-1β下降明显,与脓毒症组比较,降低比例为33.93%,与常规治疗组相比,降低比例为26.13%(P
<0.01),见图4。
a: P<0.01,与Sham组比较;b: P<0.01,与Ct组比较; c: P<0.01,与Sep组比较
2.5 右美托咪定对M1型巨噬细胞的影响
肠道巨噬细胞极化类型的免疫荧光染色结果提示:Dex能抑制巨噬细胞向M1型极化(图5)。脓毒症组大鼠肠道巨噬细胞iNOS表达增加,提示脓毒症后肠道巨噬细胞M1型的数量增多;与脓毒症组相比,常规治疗组大鼠肠道巨噬细胞iNOS表达未见明显减少;右美托咪定组大鼠肠道巨噬细胞iNOS表达则明显减少,提示M1型巨噬细胞数量减少。RAW264.7细胞实验结果显示:LPS刺激后,RAW264.7细胞iNOS明显增多、TNF-α分泌显著增加(P
<0.01),经右美托咪定处理后,RAW264.7细胞iNOS表达和TNF-α水平均明显降低(P
<0.05),见图6、7。说明右美托咪定可抑制巨噬细胞M1表型, 抑制前炎症细胞因子释放。
图5 免疫荧光观察肠道巨噬细胞iNOS的表达
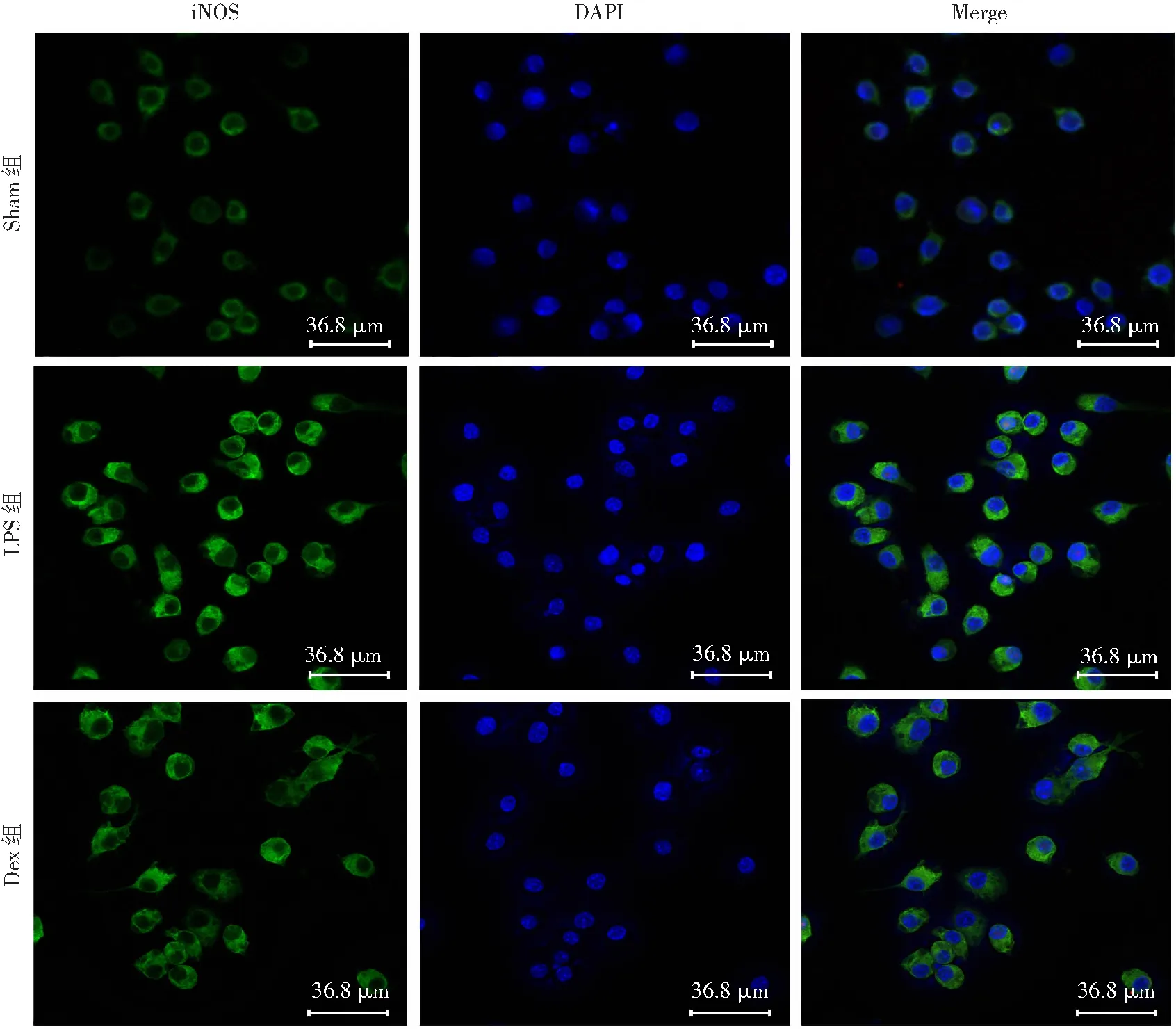
图6 免疫荧光观察离体巨噬细胞iNOS的表达

a:P<0.01,与Control组比较;b:P<0.05,与LPS组比较
3 讨论
脓毒症表现为机体对感染的免疫反应失调,具有很高的发病率和死亡率,是重症监护病房住院患者死亡常见原因之一,肠道屏障功能受损在脓毒症病程发展中具有重要作用。脓毒症后肠道通透性明显增加,肠道内有毒物质进入血液循环,进一步加重脓毒症病情的发展。
右美托咪定是临床常用的麻醉镇静药物,近年来越来越多的研究表明右美托咪定对器官功能具有保护作用。SHE等发现右美托咪定对脓毒症大鼠血管内皮屏障具有保护作用,其机制与保护线粒体功能有关。ZHANG等发现右美托咪定能增加肠上皮细胞间紧密连接蛋白的表达并减少细胞凋亡,改善肠道损伤。右美托咪定对脓毒症器官功能的保护作用与它能抑制炎症有关,MEI等证实Dex可显著抑制脓毒症大鼠炎症反应而改善脑功能。本研究发现:脓毒症大鼠血清前炎症细胞因子TNF-α、IL-1β明显增加,而右美托咪定可显著降低上述炎症细胞因子水平,改善肠道屏障功能,提高脓毒症大鼠的存活率和存活时间。但右美托咪定是如何降低脓毒症后肠道炎症反应的呢?
巨噬细胞是一种异质性极强的免疫细胞,不同病理刺激条件下巨噬细胞会极化为不同的类型,在机体炎症反应中发挥重要作用。巨噬细胞极化类型主要包括经典激活的巨噬细胞(M1)和交替激活的巨噬细胞(M2)。M1型巨噬细胞主要由脂多糖(LPS)活化,分泌促炎细胞因子(TNF-α、IL-1β),在脓毒症过度炎症期激发机体免疫应答,引起免疫功能紊乱;M2型巨噬细胞则主要由IL-4、干扰素γ(interferon-γ, IFN-γ)激活,释放抗炎因子IL-10等限制炎症,促进组织修复以及受伤区域的愈合。本研究选取肠道巨噬细胞作为研究对象,探究Dex对M1型巨噬细胞极化的影响。整体实验结果发现Dex能显著降低促炎因子TNF-α、IL-β释放,抑制肠道巨噬细胞的M1极化,M1型标志物iNOS,TNF-α表达减少。细胞实验发现Dex能抑制RAW264.7细胞向M1型极化、降低炎症细胞因子的水平。研究结果提示,Dex在脓毒症中发挥的抑炎效应,可能与其抑制巨噬细胞向M1极化相关。
综上所述,本研究发现右美托咪定对脓毒症引起的肠道屏障功能损伤具有保护作用,其机制可能与右美托咪定抑制肠道巨噬细胞向M1型极化,降低炎症反应有关。这在一定程度上阐释了Dex通过抑炎效应发挥对器官功能保护作用的机制,为脓毒症的器官功能保护提供防治措施。但Dex是否会促进肠道巨噬细胞向M2型极化,以及Dex如何调控巨噬细胞极性的机制,还有待进一步研究。

