碳量子点及新型半胱氨酸分子印迹传感器的制备*
张育珍,张 博,余 双,白春花,秦 蓓
(西安医学院 药学院,陕西 西安 710000)
半胱氨酸(L-cysteine,L-Cys)是一种含巯基的氨基酸,其主要功能是参与代谢、蛋白质合成和排毒[1,2]。研究表明,L-Cys水平升高会引发神经毒性疾病,而L-Cys缺乏会导致脱发、肌肉和脂肪减少、嗜睡、浮肿、虚弱和肝损伤等疾病[3-7]。因此,建立高选择性、高灵敏度检测L-Cys在生物化学和生物医学方面具有重要意义。目前,L-Cys检测方法包括高效液相色谱法、毛细管电泳及光学检测[8]。然而,这些方法需要复杂的样品前处理过程,而且谷胱甘肽和高半胱氨酸与L-Cys具有相似的结构,从而难以检测内源性L-Cys[2]。因此,为了解决上述问题必须开发方便、廉价且具有高灵敏度、高选择性的方法来检测L-Cys。
荧光碳量子点(carbon dots,CDs)是碳族中的一种新型零维纳米材料[9]。由于其独特的光学性能、良好的水溶性及生物相容性,被广泛认为是一种优于其他荧光基团的材料[10]。然而,CDs通常对大多数分析物没有选择性,因此,有必要探索合适方法来提高CDs的特异性[11]。目前,基于CDs与分子印迹聚合物(molecularly imprinted polymers,MIPs)相结合的传感器因其低毒、高选择性和高灵敏度受到科研工作者广泛关注[12]。Ghani等[13]基于CDs和MIPs开发了一种选择性测定啶虫脒的荧光法,其检测限可达到0.11nmol·L-1。据报道,以量子点为荧光材料,利用MIPs高选择性检测L-Cys仅有2篇。Chao[14]等人通过烯丙基硫醇封端的CdTe量子点与MIPs嫁接,用于检测血清中L-Cys,检测限可达到0.85μM。Cai等人[15]提出了一种基于化学剂量法的荧光检测方法,结合分子印迹技术与荧光剂量法测定L-Cys。然而,目前报道L-Cys荧光检测方法制备工艺复杂、毒性较大,不利于其进一步发展。
本研究拟采用水热法制备CDs,通过反相微乳法以CDs为荧光传感单元、L-Cys为模板分子、3-氨丙基三乙氧基硅烷(APTES)为功能单体、硅酸四乙酯(TEOS)为交联剂、NH3·H2O为引发剂,制备新型半胱氨酸分子印迹(L-Cys@CDs@MIPs)。随后对CDs和L-Cys@CDs@MIPs进行透射电镜(TEM)、傅里叶变换红外光谱(FT-IR)等表征,并利用目标化合物对L-Cys@CDs@MIPs的猝灭效果进行考察,以期建立检测痕量L-Cys的方法。本研究将有助于复杂基质中痕量L-Cys检测,将为与L-Cys相关疾病的预防提供理论基础。
1 实验部分
1.1 仪器与试剂
F-4600型荧光分光光度计(株式会社日立制作所);Carry60型紫外可见分光光度计(安捷伦科技有限公司),IR-Affinity-1型傅里叶变换红外光谱仪(FT-IR,日本岛津),LAB-1C-50型真空冷冻干燥机(上海甄明科学仪器有限公司)。
L-半胱氨酸(25g,≥98%)、柠檬酸(500g,99.0~102.0%)、正己醇(100mL,98%)、硅酸四乙酯(TEOS,500mL,98%)、3-氨丙基三乙氧基硅烷(APTES,25mL,98%),购买于上海阿拉丁生化科技股份有限公司;曲拉通X-100(CP国药集团化学试剂有限公司);环己烷(AR利安隆博华(天津)医药化学有限公司);无水乙二胺、丙酮、无水甲醇、冰乙酸、NH3·H2O、缩二脲、硫脲、尿素,均为分析纯,天津市河东区红岩试剂厂。
1.2 CDs的制备
将4.0g柠檬酸溶于40mL去离子水中,随后加入2.0mL无水乙二胺,充分混匀后,转移至聚四氟乙烯反应釜中,并在200℃反应5h。反应结束后,用0.45μm微孔滤膜除去大颗粒物,即得CDs水溶液。随后,利用透析袋除去未反应化合物并除杂,最终得到亮黄色透明溶液,即得纯净CDs水溶液,经冷冻干燥得到CDs粉末。
1.3 新型半胱氨酸分子印迹传感器的制备
在50mL试剂瓶中依次加入环己烷8mL、正己醇1.5mL与曲拉通X-1002mL,磁力搅拌30min。随后,加入5mg·mL-1CDs溶液1mL、1.2mmol TEOS和NH3·H2O 100μL的并搅拌2h。然后,向上述溶液中,加入室温下预聚合2h的0.2mmol L-Cys、0.6mmol APTES溶液,磁力搅拌12h。反应结束后,加入10mL丙酮终止反应,并离心收集聚合物,接着用甲醇∶乙酸(9∶1,v/v)溶液除去模板分子L-Cys,随后用甲醇洗至无乙酸味,于烘箱中45℃干燥。L-Cys@CDs@MIPs纳米材料合成步骤见图1。


图1 新型L-Cys@CDs@MIPs制备过程Fig.1 Schematic representation of L-Cys@CDs@MIPs synthesis process
在不添加模板分子L-Cys的情况下,重复以上实验步骤制备非印迹聚合物CDs@NIPs作为对照。
1.4 新型半胱氨酸分子印迹传感器荧光测定
制备的复合材料荧光光谱均在F-4600荧光光谱仪上进行,并在340nm的激发波长下记录荧光强度,在390~600nm的波长范围内测定发射波长。将L-Cys@CDs@MIPs分散在去离子水中,然后将不同浓度的L-Cys溶液加入荧光比色管中,用荧光光谱仪测定荧光强度。
2 结果与讨论
2.1 CDs的制备
2.1.1 前驱体种类的考察 以柠檬酸、尿素,柠檬酸、硫脲,柠檬酸、缩二脲,柠檬酸、天冬氨酸,柠檬酸、无水乙二胺为前驱体制备CDs。随后,在相同条件下检测其荧光强度。
从表1可知,在相同实验条件下,柠檬酸与无水乙二胺为前驱体,荧光强度最大,因此,选择柠檬酸和无水乙二胺为前驱体制备CDs。

表1 前驱体种类考察Tab.1 Investigation on the types of precursors
2.1.2 前驱体浓度考察 利用不同浓度前驱体柠檬酸和无水乙二胺制备CDs。
由表2可知,随着柠檬酸与无水乙二胺浓度减小,荧光强度也随之减少,当柠檬酸与无水乙二胺分别为2.0g和1.0mL时,荧光强度为3221,故选择上述浓度进行后续实验。
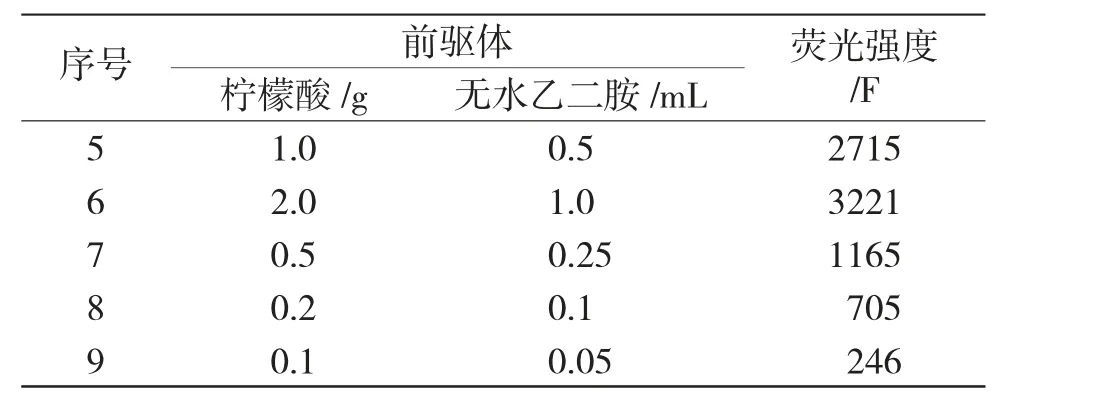
表2 前驱体浓度考察Tab.2 Investigation on the concentration of precursors
2.1.3 CDs电镜表征 采用超分辨透射电镜图(TEM)对制备CDs的形貌和粒径分布进行了表征。图2为CDs的TEM图。

图2 CDs透射电镜图Fig.2 TEM of CDs
从图2中可知,CDs呈球形、尺寸均匀、大小均一。
2.1.4 CDs红外表征 采用傅里叶变换红外(FI-IR)光谱及KBr压片法对CDs进行红外表征。
从图3可知,在3404cm-1处为C-OH伸缩振动峰,在2923cm-1处的吸收峰为C-H伸缩振动峰,在1699cm-1处的吸收峰是由C=O伸缩振动引起的,1564cm-1处 为N-H的 弯 曲 振 动 峰,1400cm-1处为-OH伸缩振动峰,1166cm-1处为C-NH-C的伸缩振动。因此,表明CDs已经制备成功且CDs表面含有羟基、羰基以及氨基基团[16]。
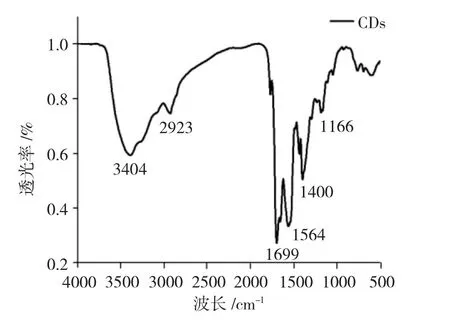
图3 CDs红外表征图Fig.3 FT-IR spectra of CDs
2.1.5 CDs荧光性能 在不同激发波长下对CDs的荧光强度进行考察,结果见图4。
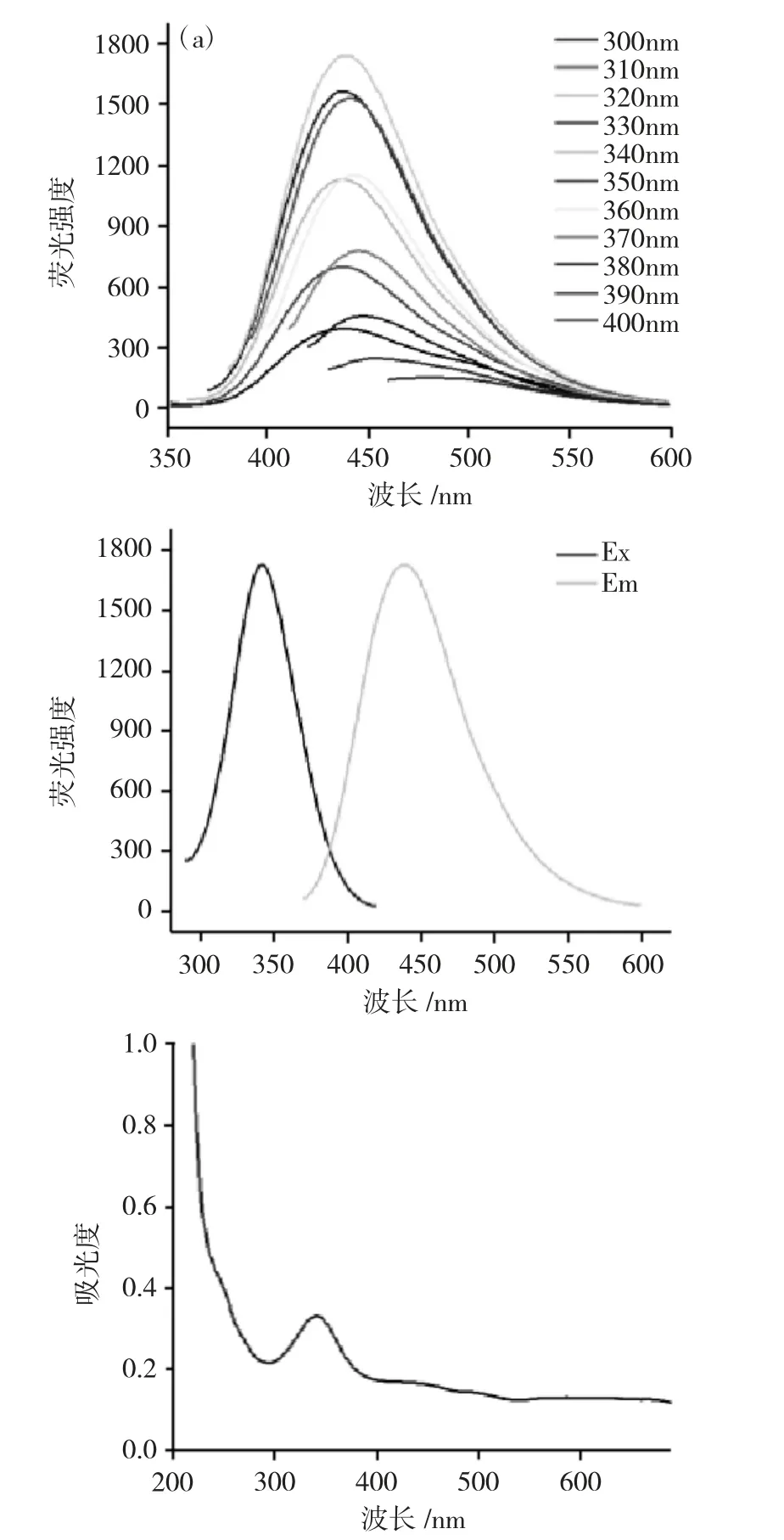
图4 (a)CDs在300~400nm荧光发射光谱(b)CDs最佳激发和发射光谱(c)CDs的紫外吸收光谱Fig.4(a)Fluorescence emission spectra of CDs from 300nm to 400nm(b)Fluorescence excitation and emission spectra of CDs(c)Ultraviolet absorption spectrum of CDs
由图4(a)可见,CDs荧光强度随着激发波长从300nm到400nm的增加,荧光强度先增加后减弱,在激发波长为340nm时,CDs的荧光强度最强。随后对CDs进行紫外-可见吸收光谱考察,图4(c)可知,由于双键的π-π*跃迁,CDs在340nm左右出现了明显的特征吸收峰,与CDs的激发波长一致,得到最佳激发波长。随后在最佳激发波长下,判断最佳发射波长。由图4(b)可见,所制备CDs的最佳激发波长为340nm,所对应的最佳发射波长为444nm,显现出蓝色荧光。
2.2 新型半胱氨酸分子印迹传感器的制备
2.2.1 模板分子与功能单体比例考察MIPs具有预定的识别能力、选择性高,而分子识别取决于模板和功能单体之间的分子间相互作用,因此,功能单体是影响聚合物吸附能力的关键因素[17]。本文将功能单体与交联剂比例固定为1∶2,随后选取6组摩尔比(1∶1.5,1∶2,1∶2.5,1∶3,1∶4,1∶5,)进行评估考察,结果见图5。

图5 模板分子与功能单体比例考察Fig.5 Fluorescence intensity of different molar ratios of template-functional monomer
由图5可知,当L-Cys与APTES比例为1∶3时,F0-F差值最大,因此,选择模板分子与功能单体比例为1∶3进行下一步考察。
2.2.2 功能单体和交联剂不同比例的考察 交联剂是分子印迹材料合成过程中重要因素,交联剂使用量的多少会决定制备纳米粒子空间网络疏松紧密程度。本文选择模板分子与功能单体比例为1∶3,随后考察功能单体与交联剂的比例,选取3组摩尔比(3∶3,3∶6,3∶9)进行评估考察,结果见图6。

图6 功能单体与交联剂比例考察Fig.6 Fluorescence intensity of different molar ratios of functional monomer-cross-linker
由图6可知,当APTES与TEOS比例为3∶6时,F0-F差值最大,因此,选择功能单体:交联剂比例为3∶6进行考察。
2.2.3 新型半胱氨酸分子印迹传感器红外表征 采用傅里叶变换红外(FI-IR)光谱及KBr压片法对LCys@CDs@MIPs进行红外表征,结果见图7。

图7 L-Cys@CDs@MIPs红外表征图Fig.7 FT-IR spectra of L-Cys@CDs@MIPs
由图7可知,3406cm-1处为C-OH伸缩振动峰,3126cm-1处为C-H伸缩振动峰,1642cm-1处为C=O伸缩振动峰,1400cm-1处为-OH伸缩振动峰,1070cm-1处为Si-O-Si不对称伸缩振动峰,表明分子印迹层已经形成。
2.2.4 新型半胱氨酸分子印迹传感器电镜表征 采用超分辨透射电镜图(TEM)对L-Cys@CDs@MIPs的形貌进行表征。图8为不同尺寸L-Cys@CDs@MIPs的TEM图。

图8 L-Cys@CDs@MIPs透射电镜图Fig.8 TEM of L-Cys@CDs@MIPs
从图8可知,L-Cys@CDs@MIPs具有粗糙的表面,且发生聚合,尺寸比CDs大很多,进一步表明聚合物已经制备成功。
2.3 新型半胱氨酸分子印迹传感器荧光性能
2.3.1 新型半胱氨酸分子印迹传感器光学性质考察 通过扫描L-Cys@CDs@MIPs不同激发(300~400nm)波长下的发射光谱,研究L-Cys@CDs@MIPs的荧光特性,结果见图9。
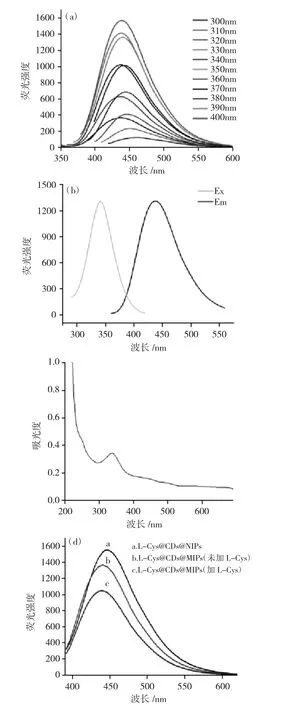
图9 (a)L-Cys@CDs@MIPs在300-400nm荧光光谱;(b)L-Cys@CDs@MIPs最佳激发和发射光谱;(c)L-Cys@CDs@MIPs紫外吸收光谱;(d)荧光光谱Fig.9(a)Fluorescence emission spectra of L-Cys@CDs@MIPs from 300nm to 400nm;(b)Fluorescence excitation and emission spectra of L-Cys@CDs@MIPs;(c)Ultraviolet absorption spectrum of L-Cys@CDs@MIPs;(d)Fluorescence emission spectra
由图9(a)和(b)表明,最大激发波长为340nm,而相应的最大发射波长约为440nm。因此,在340nm的激发波长和440nm的发射波长下对L-Cys@CDs@MIPs进行了下一步的荧光测量。由图9(c)可知,L-Cys@CDs@MIPs在340nm左右出现了明显的特征吸收峰,与其激发波长一致,进一步证明该复合材料最佳激发波长为340nm。随后,对L-Cys@CDs@MIPs和L-Cys@CDs@NIPs复合材料进行荧光测定,由图9(d)可知,L-Cys@CDs@NIPs比L-Cys@CDs@MIPs(加L-Cys)显示出更强的荧光信号,并且LCys@CDs@MIPs(未加L-Cys)的荧光强度为L-Cys@CDs@NIPs的86%。这些结果表明,制备的复合材料具有良好的荧光性能,并且成功地从聚合物中去除了L-Cys。
2.3.2 新型半胱氨酸分子印迹传感器荧光测定 图10(a)为不同浓度L-Cys猝灭L-Cys@CDs@MIPs的荧光光谱图。从图10a中可看出,L-Cys可以明显的猝灭LCys@CDs@MIPs荧光强度,且当L-Cys浓度为100μM时,猝灭效果最明显。图(b)是荧光猝灭效果F0-F与不同浓度L-Cys的线性关系图,从图10b中可知,其线性关系为F0-F=2.292C+153.544,R2为0.992。
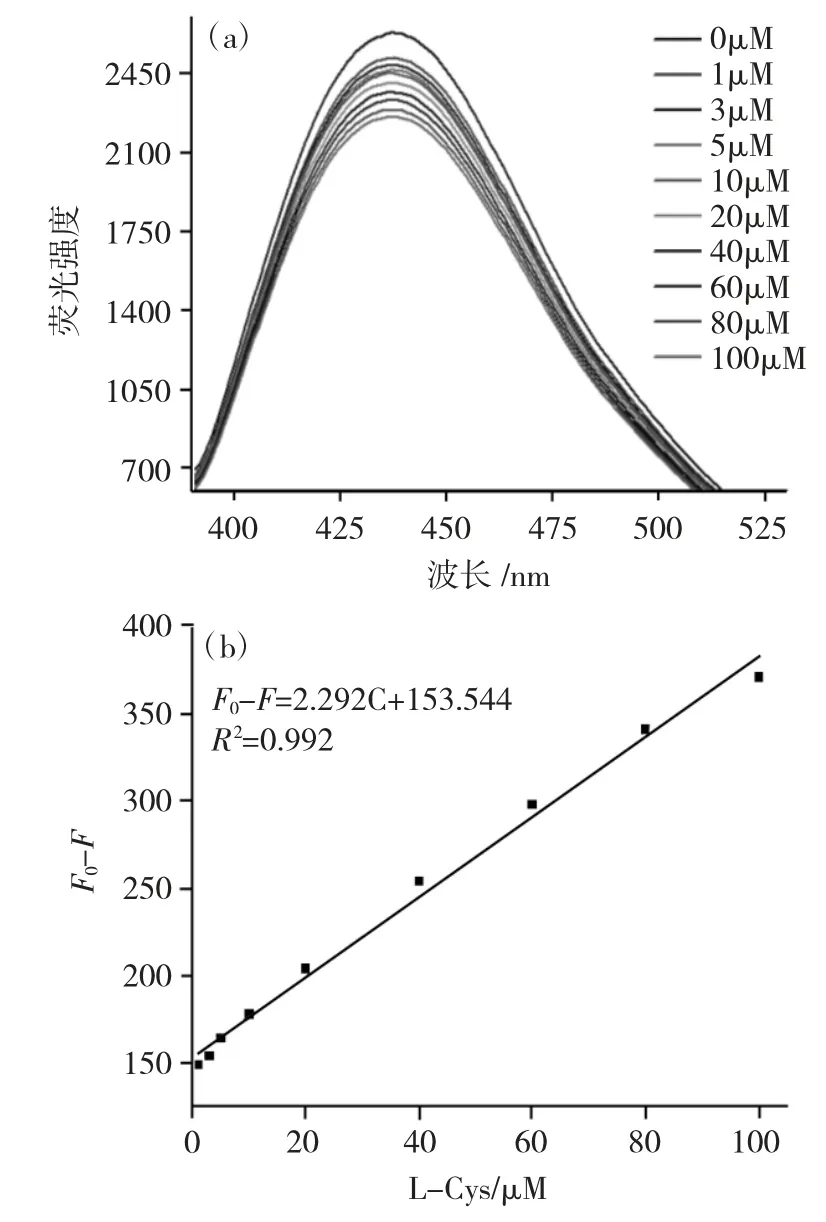
图10 (a)L-Cys猝灭L-Cys@CDs@MIPs荧光光谱图(b)F0-F与L-Cys线性关系Fig.10(a)Fluorescence emission spectra L-Cys@CDs@MIPs in the presence of different concentrations of L-Cys(from 1 to 100μM)(b)The relationship between F0-F and the concentrations of L-Cys
3 结论
本研究以柠檬酸和无水乙二胺为前驱体,通过简单的水热法一步合成了具有优异荧光特性的CDs,随后对CDs进行TEM表征。结果表明,制备的CDs大小均一、尺寸均匀。对其FT-IR表征,进一步证明CDs已成功制备,而且其表面富含羰基、羧基和氨基等官能团,使得CDs表现出良好的水溶性。利用反相微乳法,以低成本、操作简单方便理念,制备新型L-Cys@CDs@MIPs,并利用目标化合物对新型L-Cys@CDs@MIPs猝灭效果进行考察,结果表明,当模板分子、功能单体与交联剂比例为1∶3∶6时,L-Cys对新型L-Cys@CDs@MIPs的猝灭效果最好。本研究以期建立检测复杂基质中痕量L-Cys的方法,后续将继续优化其最优检测条件,为与L-Cys相关疾病的预防提供理论基础。

