禽腺病毒血清4型QHD2021株的分离鉴定和全基因序列分析
陈 玥,何云凤,刘优优,吴同垒,李佩国,李蕴玉,张建文
(河北科技师范学院 动物科技学院 河北省预防兽医学重点实验室,河北 秦皇岛 066604)
心包积水-肝炎综合征(hydropericardium hepatitis syndrome,HHS)是由Ⅰ群腺病毒血清4型(fowl adenovirus 4,FAdV-4)引起鸡的一种具有高传染性的传染病。1987年,HHS在巴基斯坦安卡拉地区首次报道,所以本病也称为“安卡拉病”(Angara disease)[1],随后在澳大利亚、日本、韩国等地相继报道[2-3]。该病主要危害肉鸡,典型症状是3~5 周龄肉鸡突然死亡,并伴随有心包积水和肝炎,死亡率为30%~70%,最高可达80%,死亡高峰持续4~8 d[4]。自2015年以来,FAdV-4在中国许多肉鸡场暴发,包括山东、河南、江苏、安徽、湖北、江西等[5],严重地阻碍我国养禽业的发展。
目前,已经鉴定的Ⅰ群腺病毒有A、B、C、D、E共5个种,12个血清型[6],引起HHS的病原主要为FAdV-4,其余血清型均能引起包涵体肝炎。我国目前FAdV主要流行株为C、D、E 3个种,其中C种FAdV以血清4型为主[7]。FAdV是二十面体无囊膜的双链DNA病毒,FAdV-4的主要结构蛋白为纤维蛋白(Fiber)、五邻体蛋白(Penton)和六邻体蛋白(Hexon)[8]。研究表明,Hexon蛋白携带主要的属和亚属特异性抗原决定簇和次要的种特异性抗原决定簇,可以引起极强的中和反应,能被中和抗体识别表位,且Hexon 基因高度保守,因此Hexon蛋白能够准确区分FAdV的血清型[9-10]。Hexon基因编码的氨基酸差异会影响FAdV的致病性[11]。Penton蛋白可与其他蛋白结合帮助病毒渗透和进入细胞[12]。Fiber蛋白包括长纤突蛋白(Fiber-1)和短纤突蛋白(Fiber-2),纤突蛋白可识别细胞膜上的特异性受体,病毒粒子通过纤突蛋白与细胞膜受体结合并侵入细胞[13]。
为了解河北省FAdV-4基因组的特征和致病性,本试验对河北秦皇岛养殖场疑似感染FAdV-4的病死鸡样品进行病原的分离与鉴定遗传进化分析和致病性试验,为我国FAdV-4的致病机理的研究奠定理论基础。
1 材料与方法
1.1 病料来源和实验动物病料来源于河北秦皇岛某养殖场有明显心包积液和肝脏肿大、出血等疑似FAdV-4症状的病死鸡。无菌采集其心脏、肝脏等组织,—80℃保存备用;SPF鸡胚购自北京勃林格殷格翰维通实验动物技术有限公司,由本实验室孵育,饲养至3周龄。
1.2 主要试剂鸡肝癌细胞(LMH)购自北京北纳生物公司,由河北省预防兽医学重点实验室保存;病毒DNA提取试剂盒购自天根生物有限公司;2×Taq PCR Mix、Gold View核酸染液、DL2000 DNA Marker均购自北京康为世纪生物科技有限公司;DMEM/F12细胞培养基、胎牛血清(FBS)购自Gibco公司;青链霉素、0.25%胰蛋白酶、DMSO购自北京索莱宝科技有限公司。
1.3 引物的设计及合成根据GenBank中的FAdV-4标准毒株ON1株(登录号:GU188428)Hexon基因序列,采用引物设计软件Primer Premier 5.0软件设计1对检测引物Hexon-R和Hexon-F(表1),预计扩增片段大小为945 bp。设计FAdV-4全基因检测引物39对(表2)。引物均由生工生物工程(上海)股份有限公司合成。

表1 Hexon基因引物序列信息

表2 全基因测序引物
1.4 FAdV-4的PCR鉴定将病死鸡心脏和肝脏剪碎,加入灭菌生理盐水,再加入终浓度为100 U/mL 的青链霉素,使用组织匀浆机将组织磨成匀浆。放入-80℃反复冻融3次,12 000 r/min离心10 min。按照病毒DNA提取试剂盒说明书提取病毒DNA。以提取的DNA为模板,根据设计的检测引物,进行PCR扩增。PCR扩增体系20 μL:2×Premix Taq mix 10 μL,DNA模板1 μL,上、下游引物各1 μL,灭菌ddH2O补足体系。PCR的反应程序:94℃预变性 5 min;94℃变性 30 s,46℃退火30 s,72℃延伸45 s,共30个循环;72℃再延伸 10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测。
1.5 FAdV-4的细胞培养与鉴定取PCR鉴定为阳性的病死鸡的肝脏、心脏匀浆上清液,过滤除菌后,接种到已长成单层LMH上,使病毒吸附2 h,弃掉病毒液,加入细胞维持液(DMEM/F12+2%FBS),37℃、5%CO2培养2~3 d,每12 h观察1次。出现明显的细胞病变(CPE)则可收集病毒液。若没有出现CPE,在培养72 h后收集上清,提取DNA,进行PCR检测,若为阳性则盲传下一代,若为阴性则弃掉。收集有病变的细胞上清液,提取DNA,进行PCR鉴定。
1.6 纯化病毒半数组织培养感染剂量(TCID50)测定取1.5中纯化的细胞病毒液,用细胞维持液将病毒液从10-1~10-10进行10倍梯度稀释。取长满单层LMH的96孔板,弃掉培养基,用PBS缓冲液清洗2~3遍,将稀释好的病毒液加入到96孔板,每个稀释度重复8个孔,每孔100 μL,同时设对照孔,37℃、5% CO2培养箱孵育,连续观察5~7 d,记录CPE孔数,根据Reed-Muench方法计算出病毒的TCID50。
1.7 病毒全基因组测序及遗传进化分析取细胞分离纯化的病毒基因组DNA为模板,应用设计的39对引物,扩增出全基因组序列。用琼脂糖凝胶DNA回收试剂盒进行PCR产物胶回收。回收产物送生工生物工程(上海)股份有限公司进行测序,并利用DNAStar软件对所得的多个基因片段进行拼接,使用 MEGA7.0 软件对全基因组与GenBank上公布的国内外参考毒株进行核苷酸同源性比对分析,基因分型所用的参考毒株信息见表3。

表3 参考毒株信息
1.8 雏鸡感染试验将21日龄SPF雏鸡分为攻毒组和对照组,每组10只,攻毒组腿部肌肉注射纯化的病毒液(0.5 mL/只),对照组注射等量生理盐水。试验鸡自由采食和饮水,逐日观察试验鸡的精神状况,记录临床表现。剖检死亡雏鸡,观察器官病变情况。采取攻毒组病死鸡的心脏、肝脏、肾脏制作组织病理切片,经甲醛固定24 h后,做常规石蜡切片,进行苏木素-伊红(H.E)染色,中性树胶封片后,观察病变并拍照。
2 结果
2.1 病料的PCR检测以Hexon基因鉴定引物对疑似样品提取的DNA进行PCR扩增检测,结果显示均在945 bp处出现目的条带,与预期片段大小一致(图1)。初步判断肝脏、心脏样品为FAdV-4阳性。

M.DL2000 DNA Marker;1.肝脏匀浆上清液;2.心脏匀浆上清液;3.阳性对照;4.阴性对照
2.2 病毒的LMH纯化培养与鉴定经LMH盲传5代后,出现明显的CPE,表现为接毒24 h后细胞开始皱缩逐渐变圆、折光性增强、细胞间距增大、突触消失、有的多个细胞聚集在一起,随后成簇或成葡萄串状。48 h后几乎所有的细胞变圆肿胀,部分细胞开始死亡,72 h后大部分细胞死亡崩解(图2)。

A.接毒24 h后;B.接毒48 h后;C.接毒72 h后;D.正常LMH细胞
病毒连续稳定传代,将第5代细胞培养物反复冻融3次,提取DNA,进行PCR扩增鉴定,扩增条带长约945 bp(图3),与预期片段大小相符。因此确定此次分离株为FAdV-4 QHD2021。

M.DL2000 DNA Marker;1.接种FAdV-4的细胞培养物;2.阳性对照;3.阴性对照
2.3 病毒TCID50测定结果将纯化的病毒液10倍比稀释后,接种已长成单层的96孔板LMH细胞上,根据Reed-Muench方法计算病毒滴度为1×105TCID50/mL。
2.4 病毒的全基因测序分析
2.4.1全基因测序结果 对FAdV-4 QHD2021株进行全基因测序,对测序的结果使用DNAStar软件进行拼接,结果表明,该株全基因大小为44 225 bp,基因组G+C的含量为54.75%,A+T的含量为45.24%,共编码14 741个氨基酸。与FAdV-4国内外毒株比对结果显示,FAdV-4 QHD2021株全基因组比经典毒株FAdV-4 ON1株短1 445 bp,比高致病性MX-SHP95株短1 421 bp,比非致病性的KR5毒株短1 588 bp,但比国内的SD1501株长587 bp,比CH/HNJZ株长494 bp。结果提示QHD2021株与国外的FAdV-4毒株相比存在基因片段缺失,但比国内的毒株长500 bp左右,说明QHD2021株相比于国内外毒株存在遗传进化与变异。
2.4.2全基因核苷酸同源性比对和遗传进化分析 采用MEGA7.0软件的Clustal W方法将FAdV-4 QHD2021株与GenBank公布的FAdV-4国外经典毒株和国内流行毒株进行同源性比对发现,FAdV-4 QHD2021株的全基因组核苷酸序列与表2所列的19株的核苷酸为47.1%~94.3%,其中与Ⅰ群C种FAdV-4参考株的同源性较高,为88.8%~94.3%,与A、B、D、E型的同源性(52.4%~46.8%)较低。FAdV-4 QHD2021株与国内分离株SD1601株和HB1501株的同源性最高,达94.3%,FAdV-4 QHD2021株与国外高致病性MX-SHP95分离株的同源性高达89.5%,与非致病性经典毒株ON1的同源性为88.6%(图4)与国外的经典毒株略有差异。结果提示,FAdV-4 QHD2021分离株可能发生了进化和变异,但并未影响其血清型。

图4 FAdV-4 QHD2021株全基因核苷酸序列同源性分析
将FAdV-4 QHD2021分离株全基因组进行遗传进化树分析发现,FAdV-4 QHD2021株与国内外的FAdV-4分离株同属于FAdV-C分支,与近几年分离的FAdV-4 SD1601株和HB1501株亲缘关系更近,而与FAdV-A、FAdV-B、FAdV-D、FAdV-E距离较远(图5)。确定FAdV-4 QHD2021分离株属于Ⅰ群C种FAdV-4。
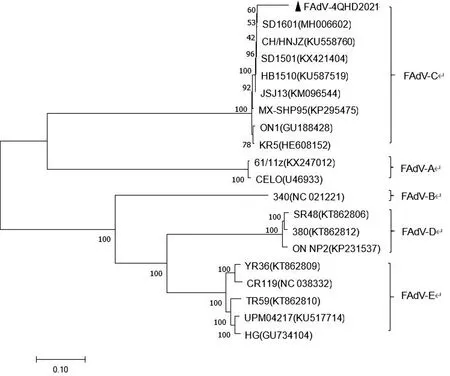
图5 FAdV-4 QHD2021株全基因组系统进化树
2.4.3序列比对分析 核苷酸序列分析显示,与国外的经典毒株(ON1、MX-SHP95、KR5)毒株相比,QHD2021株与我国流行的FAdV-4毒株在35 000~40 000 nt处有1段长1 966 bp的基因片段缺失,这导致基因组中的ORF19、ORF27、ORF48这3个编码蛋白的缺失(图6)。与我国首次分离的高致病株JSJ13的ORF29基因序列相比,国内近几年流行株SD1601、JSJ13、HB1501、HNJZ的ORF29基因序列出现了33个碱基缺失,墨西哥高致病株MX-SHP95也缺失了相同的碱基,而非致病株ON1的ORF29基因序列的碱基缺失更多,比上述毒株多缺失33个碱基(图7),说明FAdV-4在中国的流行过程中发生了变异,这很有可能导致了FAdV-4毒力增强。

中国分离株缺失部分
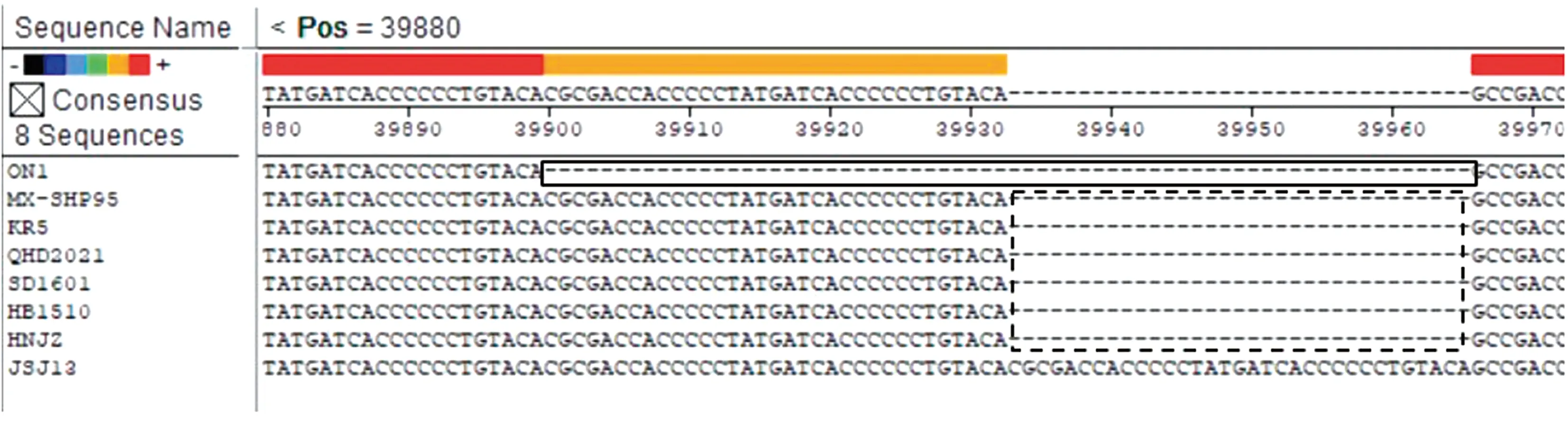
加拿大分离株ON1的缺失部分;.中国分离株、澳大利亚分离株KR5和墨西哥分离株MX-SH95的缺失部分
2.5 雏鸡感染试验对21日龄的SPF雏鸡注射病毒滴度为1×105TCID50/mL的FAdV-4 QHD2021株0.5 mL/只,感染的剂量为0.5×105/mL/只,感染后24 h开始出现明显的临床症状,雏鸡表现精神沉郁、食欲减退、羽毛蓬松、闭目呆立、拉黄绿色稀粪。48 h后雏鸡全部发病,开始出现死亡,雏鸡表现出畏寒聚集、食欲废绝,72 h 后全部死亡。对病死鸡剖检可见肝脏变黄、质地易碎、有明显的心包积液、肾脏出血、腺胃和肌胃交界处出血、肌胃糜烂(图8)。对照组鸡精神、食欲无异常表现,无死亡。

图8 FAdV-4 QHD2021株感染SPF鸡的病理变化
对QHD2021株攻毒后72 h的病死鸡的病变器官进行病理组织学观察(图9),结果显示肝脏可见局部坏死灶,肝细胞脂肪变性、坏死,肝细胞可见嗜碱性核内包涵体;肾脏出血,肾小管上皮细胞坏死;心脏心肌纤维水肿、稀疏、断裂、细胞间见单核细胞浸润。

图9 FAdV-4 QHD2021株感染鸡不同组织的病理学变化
3 讨论
近年来河北地区养鸡场发生多起感染FAdV-4病例,死亡率较高,但尚未发布FAdV-4的全基因组序列,所以FAdV-4高致病性的关键位点不明确[14-15]。为了分析河北地区FAdV-4毒株的变异性和致病性,本试验从秦皇岛某发病养殖场采集到具有明显的胶冻样心包积液和肝出血坏死等典型的病理变化的病死鸡肝和心脏进行病毒检测和分离,成功使用LMH细胞分离培养了FAdV-4,命名为FAdV-4 QHD2021株。将此毒株进行全基因组测序并和国内外毒株进行序列比对,分析该病毒的分子遗传特征和变异程度。QHD2021株对SPF鸡进行动物回归试验,雏鸡死亡率为100%,证明该毒株是较强致病株。
本研究序列比对发现,和国外FAdV-4的经典毒株(ON1、KR5、MX-SHP95)相比,QHD2021株与国内近几年流行毒株均在ORF42~ORF43存在一段长为1 966 bp碱基缺失,这与SLAINEI等[16]发现是一致的,该缺失导致了ORF19、ORF27、ORF48的缺失,有猜测这一段缺失可能是导致我国近几年流行毒株毒力增强的原因[17],但在PAN等[18]进一步的研究中否认了这一猜测,其发现1 966 bp的缺失并不会影响病毒的复制,这种缺失是否影响病毒的毒力还需进一步研究。近期也有研究发现ORF19缺失毒株比未发生缺失的毒株毒力更强,ORF19可能会影响病毒的毒力,这就解释了目前中国各省份FAdV-4死亡率较高的现状[19]。本研究还发现,与国内首次分离株JSJ13相比,QHD2021株与国内其他流行株在ORF29处缺失了33个碱基,经典株ON1缺失了66个碱基。在中国近几年FAdV-4流行株大多数为高致病性毒株,而ON1株为非致病株,因此推测该缺失部分可能会导致FAdV-4的高致病性。但是该部分的生物学功能尚不明确,这一基因缺失对FAdV-4毒株复制和致病力的具体影响还有待进一步研究。据此可知,国内报道的FAdV-4毒株存在不同程度的变异,这种变异也导致了不同的致病性。同源性分析发现QHD2021株与SD1501、HB150株有较高的同源性,但又存在一些差异,说明我国的FAdV-4在不断的进化过程中。因此对该病毒的分子流行病学的研究急需开展。深入分析的这些基因变异对FAdV-4毒力增强的影响,是研发FAdV疫苗的关键[20]。本试验进一步阐明了河北地区FAdV-4的流行情况,为今后掌握FAdV-4致病机理的研究奠定理论基础。

