多模态MRI对新生儿HIE分布模式与临床相关性的诊断价值
田荣华,邹语嫣,王艳,邓兰婷,杨聪,缴春悦,刘绪纶,马芬
新生儿死亡的前3位原因包括早产、感染和围产期窒息(perinatal asphyxia,PA)[1]。PA描述了一种以围产期缺氧、高碳酸血症以及呼吸性代谢性酸中毒为特征的临床病症,孕期或出生前后全脑缺氧缺血,每年约占新生儿死亡人数的23%[1]。新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是围产期窒息的并发症,缺氧缺血并脑细胞能量代谢异常,导致细胞死亡,是脑瘫和神经功能缺陷的最常见病因之一。HIE的数种影像学检查方法中,MRI因具有安全无辐射、软组织分辨力高、多序列多方位成像等优势,对新生儿HIE的临床应用逐年增多。本文搜集2018年1月~2020年12月间经临床确诊为HIE的足月儿资料,探讨MRI在新生儿HIE早期诊断的临床应用价值。
材料与方法
1.临床资料
回顾性搜集2018年1月~2020年12月入院的足月新生儿资料107例,经临床确诊为新生儿HIE,出生时有重度窒息、有宫内窘迫产科病史或分娩过程中有明显窒息等病史,且出生后不久出现神经系统症状。排除先天性脑畸形、遗传代谢性疾病或感染患者。新生儿HIE诊断标准及临床分度具体参照中华儿科学会新生儿学组2004年修订的标准[2]。对不同严重程度HIE患儿的临床资料及磁共振图像表现进行统计分析。
2.MRI检查设备及参数
MRI采用Siemens Avanto 1.5T磁共振扫描仪,全部病例进行常规MRI扫描及DWI扫描,扫描序列及参数:T1-tirm,常规进行矢状面和轴面扫描,TR 2000 ms/9.6 ms, TE 2000 ms/16 ms;T2WI,TSE序列TR 4000 ms,TE 100 ms,常规进行轴面扫描;T2-FLAIR,TR 8000 ms,TE 112 ms,TI 2000 ms,常规进行轴面扫描;DWI使用扩散加权-轴面回波平面成像(EPI)序列扫描,TR 3200 ms,TE 93 ms,b值为800 s/mm2,层厚均为5 mm。扫描前应用水合氯醛镇静,耳罩护耳。
3.图像观察与分析
各患儿MRI图像分别由两名主治及以上影像医师进行双盲法读片,依据 Barkovich 的早期评分系统[3],结合DWI-MRI表现采用改良HIE-MRI分类的损伤评分系统,将HIE的神经病理类型在MRI上划分为:分水岭区(watershed,W)损伤、基底节/丘脑(basal ganglia/thalamus,BG/T)损伤、内囊后肢(posterior limbs of internal capsule,PLIC)损伤及脑干(brainstem,Bs)损伤,对新生儿脑损伤类型进行定位,选取各损伤部位中最高评分作为各区域最终评分[4],对图像病变位置及范围进行评估,意见分歧处经过讨论达成一致(表1)。

表1 改进的HIE MRI影像学评分
4.统计学分析
结 果
1.临床资料分析
纳入临床诊断为HIE的足月患儿共107例,根据临床分度分为3组,轻度39例,中度60例,重度8例。3组患儿中1 min Apgar评分以及机械通气与否的差异有统计学意义(P<0.05)。3组患儿在出生胎龄、出生体重、胎儿性别、是否剖宫产、是否宫内窘迫、是否脐带异常及5 min Apgar评分的差异无统计学意义(表2)。
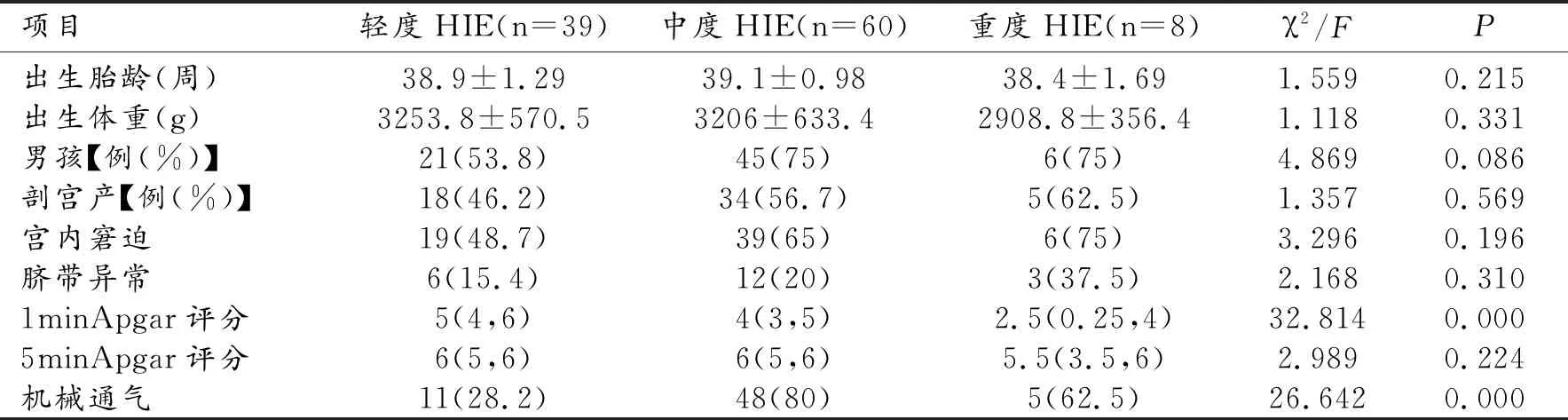
表2 不同临床分度HIE患儿的临床特征比较
2.不同临床分度HIE患儿的MRI脑损伤类型(表3)
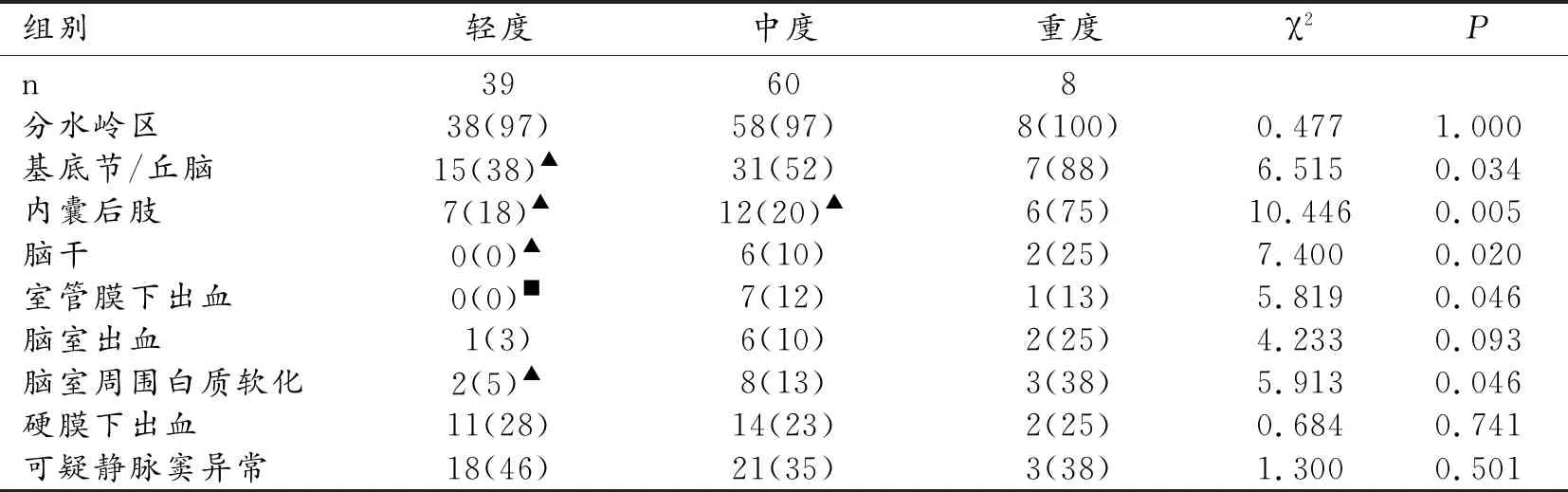
表3 不同临床分度HIE患儿的MRI损伤部位的比较 [例(%)]
3组不同临床分度HIE患儿脑损伤类型比较,基底节/丘脑损伤、内囊后肢损伤、脑干损伤、室管膜下出血及脑室周围白质软化差异均有统计学意义(P<0.05)。组间两两比较,重度与轻度HIE患儿比较更容易发生基底节/丘脑损伤、内囊后肢损伤、脑干损伤和脑室周围白质软化,差异有统计学意义(P<0.05);重度与中度HIE患儿比较更容易发生内囊后肢损伤,差异有统计学意义(P<0.05);中度与轻度HIE患儿比较更容易发生室管膜下出血,差异有统计学意义(P<0.05)。
3.不同临床分度HIE患儿MRI评分比较(表4)

表4 不同临床分度HIE患儿的MRI评分比较 [M(P25,P75)]
3组不同临床分度HIE患儿脑损伤MRI评分比较,分水岭区评分、基底节/丘脑评分、内囊后肢评分、脑干评分、MRI总评分差异均有统计学意义(P<0.05)。组间两两比较,重度HIE患儿基底节/丘脑评分、内囊后肢评分、脑干评分及MRI总评分均高于轻度HIE患儿,差异有统计学意义(P<0.05);重度HIE患儿分水岭区评分、基底节/丘脑评分、内囊后肢评分及MRI总评分均高于中度HIE患儿,差异有统计学意义(P<0.05)。
4.重度HIE患儿MRI图像特点分析
女婴,40+3周,因产程进展慢、宫内窘迫急诊剖宫产,MRI表现为旁矢状区脑损伤,DWI示双侧大脑皮层、皮层下多发斑点、斑片状弥散受限高信号,相应ADC值减低,常规扫描呈长T1长T2信号,这种损伤是足月儿围生期窒息的特征性损伤形式,双侧发生,一侧较严重,病理特点是皮质和皮质下白质的坏死,神经元坏死明显(图1)。

图1 女婴,40+3周。a)DWI示双侧大脑皮层、皮层下斑点、斑片状高信号(箭);b)ADC示双侧大脑皮层、皮层下斑点、斑片状低信号(箭),右侧明显。 图2 男婴,40+5周。a)T1WI示双侧基底节/丘脑不均匀高信号(长箭),内囊后肢正常髓鞘化信号缺失(短箭);b)T2WI示双侧基底节/丘脑不均匀低信号(长箭),内囊后肢正常髓鞘化信号缺失(短箭),白质水肿,皮层变薄,灰白质分界不清(实线框);c)T1WI示罗兰氏区皮层高信号(箭)。 图3 女婴,37周。常规MRI示双侧大脑皮层、皮层下水肿,顶枕区明显,皮髓质分界模糊不清(实线框);DWI示双侧大脑皮层、皮层下片状弥散受限高信号(实线框),胼胝体亦见弥散受限高信号(箭)。a)T1WI;b)T2WI;c)DWI。
男婴,40+5周,顺产,羊水Ⅲ°粪染,脐带扭转,MRI示双侧大脑半球大部分区域损伤,皮层、皮层下片状长T1长T2信号,基底节/丘脑及罗兰氏区损伤呈T1高信号,内囊后肢正常髓鞘化信号消失(图2)。
女婴,胎龄37周,因母“间断脐血流异常”剖宫产,基底节/丘脑损伤不明显,内囊后肢髓鞘化信号浅淡;同图2双侧大脑半球皮层、皮层下亦见广泛水肿,但顶枕区更明显,皮髓质分界模糊不清(图3)。
男婴,胎龄38+2周,产程发作,产前胎心减慢至50~60次/分,行产钳助产娩出,生时羊水Ⅲ°,脐带绕颈绕身,常规MRI示双侧基底节/丘脑可见对称分布短T1、短/长T2信号,T2-FLAIR呈低/高信号,DWI未见弥散受限高信号,信号改变神经病理学机制为神经元死亡、毛细血管增生、胶质增生,局部顺磁性物质沉积(图4)。
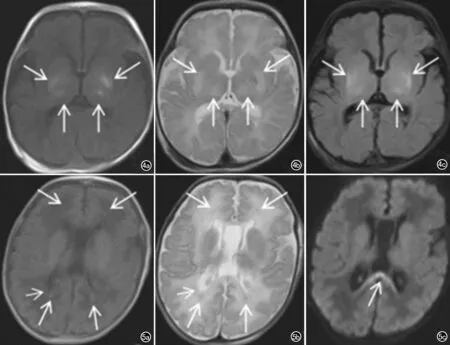
图4 男婴,胎龄38+2周。双侧基底节/丘脑斑片状短T1、短/长T2信号影(箭),T2-FLAIR呈斑片状低/高信号(箭)。a)T1WI;b)T2WI;c)T2-FLAIR。 图5 男婴,胎龄37+1周。双侧侧脑室旁多发斑点状短T1、短T2信号影(长箭),侧脑室扩大变方(短箭);DWI示胼胝体压部高信号(箭)。a)T1WI;b)T2WI;c)DWI。
男婴,胎龄37+1周,因产前胎心监护胎心变异差、妊娠合并子宫肌瘤剖宫产,生时羊水Ⅰ°,患儿孕周较小,MRI示双侧侧脑室旁多发斑点状短T1短T2信号,提示生发基质损伤,双侧侧脑室扩大,形态变方,侧脑室周围白质软化不除外,DWI示胼胝体压部高信号(图5)。
男婴,胎龄37周,因胎儿急性宫内窘迫、羊水少剖宫产,生时羊水Ⅲ°,患儿孕周亦较小,MRI示双侧侧脑室旁斑点状、斑片状短T1短T2信号,双侧侧脑室扩大,室管膜下出血破入侧脑室,右侧明显,信号混杂;内囊后肢正常髓鞘化信号消失(图6)。
讨 论
PA的长期后遗症包括脑瘫、智能障碍、皮层性视损伤、癫痫、学习障碍和行为问题。即使是相当轻微的HIE患者,至少25%的病例也有异常的长期结局[5]。HIE是新生儿死亡和残疾的常见原因,临床指标不能可靠地预测窒息新生儿脑损伤的严重程度,影像学检查可直观地观察新生儿脑组织结构和颅内病变。合适的脑成像方法能够更客观准确地检测新生儿HIE脑损伤模式和程度,对于新生儿HIE早诊断早干预,预测患儿神经发育结果具有重要意义。
缺氧缺血性脑病的发病机制很复杂,涉及两个相互依赖的过程[6]。首先是初级能量衰竭,其特征是三磷酸腺苷(ATP)和磷酸肌酸等富含能量的底物水平降低,结果细胞内酸中毒、脂肪酶、蛋白酶等酶的激活和细胞内钙的升高导致细胞内膜稳态丧失。随后是6到15 h的“潜伏期”,之后二次能量失效随之而来。其特征是激活炎症反应,触发细胞凋亡(程序性细胞死亡)并促进细胞中兴奋性神经递质的积累。继发性能量衰竭导致广泛的神经元损伤,并导致新生儿脑病的主要临床表现。
新生儿HIE 4种主要神经病理学类型有:1)两侧大脑半球损伤,如选择性神经元坏死和/或矢状旁区皮质损伤,伴或不伴脑水肿;2)基底节/丘脑和脑干损伤;3)脑室周围白质软化;4)脑室周围室管膜下/脑室内出血。这些病理学类型是未成熟大脑特有的损伤表现,取决于发生的胎龄、病因以及损伤的严重程度和持续时间。新生儿脑损伤会在数天或数周内演变,这个过程为干预治疗提供了时间窗,在损伤的不同演变阶段需要相应的干预手段。MRI客观地揭示了缺氧缺血性脑损伤的损伤类型及演变过程,提高了我们评估损伤的时间、严重程度和范围的能力(图1、图3)。分水岭区是大脑易损区域,顶枕区损伤更明显,是不完全性缺氧缺血表现,其慢性病理改变为脑萎缩或瘢痕性脑回,有时可见囊腔形成。图2显示全脑损伤,有脐带扭转病史,急性完全性缺氧缺血表现,其预后较差。图5、图6患儿37周左右,孕周较小,表现为早产儿缺氧缺血病理特点,MRI表现有相同之处和不同之处,相同点为双侧侧脑室旁生发基质损伤,双侧侧脑室扩大;不同点为图5双侧侧脑室形态变方,周围白质病变较对称,胼胝体压部损伤,而图6显示室管膜下出血并破入双侧侧脑室,一侧较明显,出血信号混杂,提示急性、亚急性出血并存,可能是一个慢性持续性损伤所致。
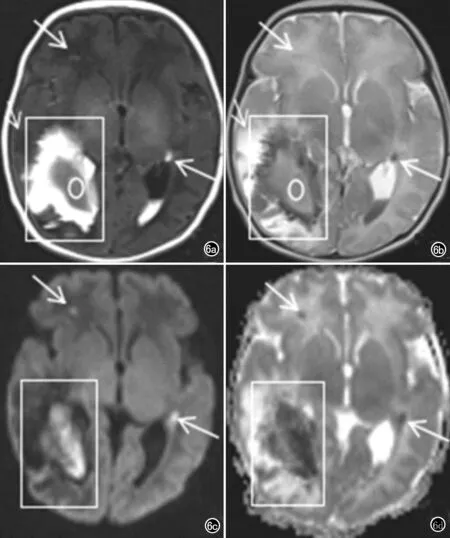
图6 男婴,胎龄37周。双侧侧脑室扩大,右侧明显,室管膜下出血破入脑室,信号混杂,中间出血急性期呈长T1、短T2信号(椭圆),外周出血亚急性呈短T1、短T2信号(实线框),出血信号DWI呈高信号为主(实线框),ADC呈低信号为主(实线框),周围脑实质水肿(短箭);双侧侧脑室旁斑点状短T1、短T2信号(长箭),DWI呈高信号(长箭),ADC呈低信号(箭)。a)T1WI;b)T2WI;c)DWI;d)ADC。
几种HIE病理学类型及相对应的MRI表现常混合存在,也就是HIE可有多个区域脑组织获得损伤,但严重程度可以有很大差异,体现了神经损伤的选择性和等级性。基底神经节优势模式涉及基底神经节、丘脑和外周皮层(主要是罗兰氏区)。分水岭模式为主涉及血管分水岭,从白质延伸至大脑皮层。两者共有的脑损伤为全脑损伤模式。在轻度脑病中运动和认知缺陷的风险似乎很小,严重脑病中神经发育损伤结果很普遍,但中度脑病的预后则难以确定。因此,患有中度脑病的新生儿最有可能从神经影像学中受益[7]。
研究表明新生儿HIE颅脑磁共振显示重度HIE新生儿基底节/丘脑+脑干甚至全脑损伤多见,而中度HIE新生儿主要是脑分水岭损伤,脑干受累很少见。分水岭损伤模式通常被认为程度较轻,对18个月幼儿的神经发育结果影响最小[8]。然而,有研究分析表明分水岭损伤与18~24个月时认知领域的较差结果显著相关[9],表明了分水岭损伤的患儿密切随访和尽早干预治疗的重要性。本研究结果显示不同严重程度HIE患儿的分水岭区评分并无统计学差异,表示任何程度的HIE患儿均可能发生分水岭区损伤,进一步证明其易损性。Mulkey等[10]描述了参加头部冷却试验的一组HIE新生儿的深核灰质损伤及脑容量减少对长期神经发育结果(癫痫和脑瘫等)的影响,本研究显示基底节/丘脑、内囊后肢损伤及脑室周围白质软化在重度HIE患儿中较多,颅脑磁共振的随访复查检测脑实质急性和慢性改变,对临床评价患者发育,指导临床干预治疗至关重要。关于内囊后肢,该区域具有出色的损伤预测价值[11]。重度与轻中度HIE患儿比较,更容易发生内囊后肢损伤。
胼胝体压部的变化对不良结局或死亡的阳性预测值为90%。胼胝体压部的变化还与较低的出生体重、较大的脐动脉血气碱不足,以及在参加选择性头部冷却期间更严重的脑病有关。足月HIE患儿胼胝体压部DWI高信号通常与广泛的脑损伤有关,在这些情况下,它似乎是不良神经系统结局的早期神经放射学标志[12]。本研究重度HIE组中2例(25%)患儿有胼胝体压部DWI高信号,中度HIE组有4例(7%)患儿见到压部DWI高信号,部分伴有双侧大脑皮层、皮层下白质大片梗死,呈“白脑”表现,是新生儿重度窒息的最严重模式。有报道其磁共振成像特征表现为DWI图像上的“白色大脑征”,即“白脑”,经过1个月的随访观察,MRI图像显示双侧弥漫性多囊性脑软化症(MCE)以及基底节和丘脑(BG/T)的萎缩,这一类新生儿都有严重的不良临床结果如严重的残疾等[13]。远期的随访观察中部分儿童时期颅脑MRI显示双侧大脑白质容量减小,胶质增生,脑回细小,双侧基底节、丘脑萎缩,双侧侧脑室扩大、变方等,神经发育结局有智力发育不良、癫痫等。
生发基质出血和脑室内出血(GMH-IVH)仍然是早产儿,特别是极早产儿临床上常见的和显著的问题。大的GMH-IVH通常并发出血后脑室扩张(PHVD)或实质出血性梗塞,并与不良神经系统后遗症的风险增加有关。如图6显示,胎龄37周,急性胎儿宫内窘迫、羊水少剖宫产,生时羊水Ⅲ°,MRI显示双侧侧脑室出血、扩张,并室管膜下出血,右侧明显,出血信号混杂,提示急性出血、亚急性出血并存。自1980年代初期以来,颅脑超声检查的广泛使用表明GMH-IVH的发生率逐渐下降,并有助于识别产前和围产期危险因素以及病变的时间。越来越多的新生儿甚至胎儿使用磁共振成像,有助于更详细地显示GMH-IVH的部位和范围,研究显示在PHVD发展的早期阶段开始的脑脊液引流似乎与更好的神经发育结果相关[14]。此外,MRI有助于了解相关的白质变化以及相关的小脑出血,有研究证明可采用磁共振扩散张量成像(DTI)进行新生儿脑发育的监测,评估脑组织髓鞘化进程,早期、定量、客观评价HIE患儿脑损伤情况[15,16]。
新生儿静脉窦血栓(cerebral sinovenous thrombosis,CSVT)由于缺乏特异性临床表现,诊断较困难,是一种被严重低估的新生儿脑血管疾病,该病的存在更倾向于男婴[17]。本研究中T1WI-FLAIR显示静脉窦局限高信号,诊断可疑静脉窦血栓,亦可能是慢血流高信号,需要进一步结合SWI或MRV诊断评估。本研究结果显示轻度、中度、重度HIE患儿T1WI-FLAIR显示静脉窦局限高信号者,是男孩的分别有11(61%)例、17(81%)例、3(100%)例。其危险因素包括母体并发症、产伤、先天性疾病及感染等。深部髓静脉血栓形成是发生静脉淤血,导致脑白质损伤重要病理机制。围生期脑血管发育不成熟,血管代偿能力不足容易导致脑室内出血,进而深部静脉引流受阻、淤血及血栓形成,伴邻近脑实质损伤,脑梗死、脑出血、脱髓鞘改变,慢性期脑白质软化,脑容量减小[18]。其结局包括癫痫、运动、认知及语言障碍等神经功能损伤[19]。
当新生儿患有脑病并且怀疑缺氧缺血性损伤,MR成像研究的主要内容有1)确定大脑是否已正常发育至足月胎龄,皮质发育畸形或其他显著的先天性脑畸形可能会出现类似的临床表现;2)确定受伤时间以评估是否有证据表明子宫内脑损伤或者是产程损伤,在常规MR成像中检测到生命的最初几天出现亚急性和/或慢性脑损伤,很可能是由于不利的母胎环境或者是与HIE相关的产程损伤;3)区分新生儿HIE脑损伤的不同模式,确定脑损伤的范围和严重程度。有了这些信息,新生儿重症监护室(neonatal intensive care unit,NICU)团队可以开始分析潜在的病因,并采取适当措施以尽量减少进一步的伤害。帮助家庭确定患儿预后以及如何照顾患者。利用预测信息,可以制定适当的护理计划,积极早期干预,可以最大限度地提高孩子的神经系统发育和认知潜力 。
新生儿医疗中心需要提供低体温治疗以及全面的临床护理,包括机械通气、生理和生化监测、神经影像学(包括超声、MRI)、癫痫发作检测和动态脑电图(aEEG)或脑电图(EEG)监测、神经病学咨询以及一套长期的神经发育随访计划。我们将对患儿的随访资料做下一步研究,进一步探讨不同损伤模式及严重程度脑损伤对幼儿发育结局的影响。

