1,2-丁二醇辅助氨基糖苷类抗生素杀灭大肠杆菌效果分析
冯荆城,庄彬彬,李中燕,马月龙,李心想,陈雅娟
(细胞逆境响应与代谢调控福建省高校重点实验室/福建师范大学生命科学学院, 福建 福州 350108)
1928年,亚历山大·弗莱明医生在实验中偶然发现青霉菌具有杀灭清除细菌的作用,进而找到了青霉素这一具有抗击传染性疾病的强效药物,并在第二次世界大战中挽救了无数受伤士兵的生命,这预示了“抗生素时代”的到来[1]。至此开始,抗生素被广泛发现并应用于医疗卫生、农业养殖等领域,成为保证人类健康、防治动物疫病以提高养殖效益的一大必备药品[2-3]。抗生素的临床应用可以说是20世纪最大的医学突破[4]。
随着抗生素的广泛使用,也引发诸多问题,其中最引人关注的即是抗生素的滥用致使病原菌对抗生素逐渐演化出耐药性,该现象在近几十年愈演愈烈,严重威胁病人生命与健康[5-6],同时威胁农业生产系统的可持续性,并对经济发展造成巨大影响。因此,在2014年世界卫生组织已将抗生素耐药列为21世纪最重要的公共卫生威胁之一[7]。有调查预测,若不采取措施使当前存在的不合理使用抗生素的趋势继续演化下去,到2050年,全球每年将有1 000万人死于耐药性感染[8]。
细菌面对不同抗生素的杀灭作用已经进化出了复杂的耐药机制。(1)产生钝化酶[9];(2)耐药菌进化出主动外排机制[10];(3)抗生素杀菌靶点修饰[11];(4)降低外膜渗透性[12]。针对以上错综复杂的耐药机制,研究人员将目光聚焦在:(1)研发新型抗生素;(2)探索新的杀菌靶点和抑制剂;(3)寻找能够辅助现有抗生素杀菌的佐剂及方法策略。而自从20世纪70年代开始,抗生素新药研发进展缓慢,研发周期长、资金投入巨大,许多生物公司已经停止相关项目[13]。提高现有抗生素杀菌效率或者寻找新的杀菌靶点和抑制剂或许才是未来有效解决细菌耐药的方法,研究人员通过外源添加葡萄糖[14]、5-甲基吲哚[15]、正丁醇[16]、丙氨酸[17]增强氨基糖苷类抗生素杀菌效果,也寻找出一系列辅助杀菌的方法策略,例如:低离子休克[18]、冰冻[19]等。与抗生素单处理相比,上述佐剂及方法均可在较短时间内提高抗生素杀菌效率,这种“新瓶装旧酒”的杀菌方式在未来应用潜力巨大。
实验室已有的研究发现,正丁醇能够较好地辅助氨基糖苷类抗生素杀灭金黄色葡萄球菌持留菌、MRSA及多种致病菌[16],看到了醇类在抗击细菌耐药方面的巨大潜力。本研究共测试了8种丁醇类有机化合物与妥布霉素双处理对平台期大肠杆菌进行杀灭5 h的杀菌效果,从中筛选出了1,2-丁二醇(1,2-Butanediol,BD)具有良好的辅助氨基糖苷类抗生素杀灭大肠杆菌的作用。1,2-丁二醇广泛应用于医药、化妆品保湿剂、稳定剂、增塑剂等领域[20]。本研究首次发现1,2-丁二醇在辅助传统杀菌型抗生素增效方面的良好效果,未来有望拓展1,2-丁二醇在医药和农业领域的应用,为抗生素“增效减毒”做出贡献。
1 材料与方法
1.1 试验材料
以大肠杆菌模式菌株BW25113为试验材料,10株临床耐药大肠杆菌由福建医科大学第一附属医院馈赠。
氨基糖苷类抗生素:妥布霉素(Tob)、庆大霉素(Genta)、链霉素(Strep)、卡那霉素(Kana)、阿米卡星(Amk)、奈替米星(Net)。β-内酰胺类抗生素:氨苄青霉素(Amp)、羧苄青霉素(Car)。喹诺酮类抗生素:氧氟沙星(Ofl)、环丙沙星(Cip)。
1.2 试验方法
1.2.1菌种活化及稀释点板方法 菌种活化:吸取-80℃冻存的大肠杆菌菌液1 μL,加入到1 mL LB液体培养基中,于摇床(37℃,220 r·min-1)培养12 h进行菌种活化,所得菌液稀释500倍,接种于20 mL的LB液体培养基中,于摇床(37℃,220 r·min-1)培养24 h,即得平台期大肠杆菌菌液。
稀释点板:经不同试验要求处理后吸出50 μL的菌液离心(13 000 r·min-1,2 min),去除上清液,然后用100 μL PBS缓冲液重悬菌体,洗涤两次后,再加入50 μL PBS缓冲液重悬菌体(使其与原菌液相同体系)。所得菌液按每次10倍的梯度用PBS缓冲液稀释,稀释梯度为101、102、103、104、105,每个稀释度取4 μL菌液点镀在LB固体培养基平板上,倒置于37℃恒温培养箱12 h后,检查细菌死亡并进行计数,计算大肠杆菌经处理后的存活率(注:杀菌测试试验的菌液活化、洗脱、点板均与上述方法相同,仅是处理时的抗生素类型、浓度,1,2-丁二醇的浓度及处理时间不同)。
1.2.28种丁醇类化合物与妥布霉素双处理杀灭平台期大肠杆菌效果测试 取平台期大肠杆菌,分别吸取500 μL菌液分装于18个无菌玻璃摇菌管中,编号为1~18。1号管作为空白对照组不经任何处理,2~9号管内分别加入正丁醇、异丁醇、叔丁醇、2-丁醇、1,2-丁二醇、1,3-丁二醇、1,4-丁二醇、2,3-丁二醇,浓度为30 mmol·L-1,10号管中加入妥布霉素(200 μg·mL-1)作为妥布霉素单处理组,11~18号管分别按序加入上述8种醇(30 mmol·L-1),并分别加入妥布霉素(200 μg·mL-1),将上述18个摇菌管置于37℃摇床(220 r·min-1)孵育5 h处理。
1.2.31,2-丁二醇辅助妥布霉素杀灭平台期大肠杆菌的浓度梯度测试 取平台期大肠杆菌,分别吸取500 μL菌液分装于20个无菌玻璃摇菌管中,编号为1~20。1~10号管为1,2-丁二醇单处理组,设置1,2-丁二醇浓度梯度为0(未添加1,2-丁二醇的空白对照组)、1、3、5、8、10、30、50、80、100 mmol·L-1;11~20号管为1,2-丁二醇与妥布霉素双处理组,在按序添加上述1,2-丁二醇浓度后,在每管中再添加妥布霉素(200 μg·mL-1),将上述20个摇菌管置于37℃摇床(220 r·min-1)孵育5 h处理。
1.2.41,2-丁二醇辅助杀菌型抗生素杀灭平台期大肠杆菌效果测试 1,2-丁二醇与3类杀菌型抗生素联合应用处理:取平台期大肠杆菌,分别吸取500 μL菌液分装于14个无菌玻璃摇菌管中,编号为1~14。1号管为未处理空白对照组,2~7管为抗生素单处理组,其中2~3号管分别添加妥布霉素、庆大霉素(各200 μg·mL-1),4~5号管分别添加氨苄青霉素、羧苄青霉素(各2000 μg·mL-1),6~7号管分别添加氧氟沙星、环丙沙星(各10 μg·mL-1);8号管为1,2-丁二醇单处理组(浓度为50 mmol·L-1),9~14号管为抗生素与1,2-丁二醇双处理组,在按序添加了上述抗生素后,在每管中再添加1,2-丁二醇(50 mmol·L-1),将上述14个摇菌管置于37℃摇床(220 r·min-1)孵育5 h处理。
1,2-丁二醇与6种氨基糖苷类抗生素双处理:6种氨基糖苷类抗生素各设置2个浓度,分别为妥布霉素(Tob1=200 μg·mL-1、Tob2=500 μg·mL-1)、庆大霉素(Genta1=100 μg·mL-1、Genta2=200 μg·mL-1)、链霉素(Strep1=200 μg·mL-1、Strep2=500 μg·mL-1)、卡那霉素(Kana1=1 000 、Kana2=1 500 μg·mL-1)、阿米卡星(Amk1=1 000 μg·mL-1、Amk2=1 500 μg·mL-1)、奈替米星(Net1=100 μg·mL-1、Net2=200 μg·mL-1),以妥布霉素的处理为例,取活化后所得平台期大肠杆菌,分别吸取500 μL菌液分装于5个无菌玻璃摇菌管中,编号为1~5。1号管为0 h未处理组,2号管、3号管分别添加妥布霉素200、500 μg·mL-1,4号管、5号管在分别添加上述妥布霉素外再添加1,2-丁二醇(50 mmol·L-1),然后放置到摇床(37 ℃,220 r·min-1)孵育,设置0~5 h时间梯度,每1 h取样50 μL进行点板。其余5种抗生素均以上述方法进行处理。
1.2.5妥布霉素摄取 (1)标准品制备:分别吸取平台期大肠杆菌1 mL置于6管1.5 mL EP管中,13 000 r·min-1,2 min离心,去上清,PBS洗脱3次,加入100 μL溶菌酶(2 mg·mL-1)于菌样中,用移液枪小心吹打菌样混匀;然后分别加入不同浓度的妥布霉素,设置0、20、40、60、80、100 μg·mL-1的妥布霉素浓度梯度。(2)试验样品制备:分别吸取1 mL平台期大肠杆菌菌液于4个玻璃摇菌管中,编号为1~4,妥布霉素浓度为管1、2:200 μg·mL-1,管3、4:500 μg·mL-1,再往管2、4加入1,2-丁二醇(50 mmol·L-1),将这4管放置到37℃摇床220 r·min-1处理3 h转移至1.5 mLEP管中,离心后去上清,PBS洗脱3遍,洗去细菌表面残留妥布霉素,最后加入100 μL溶菌酶于菌样中吹打混匀。
将上述标准品及试验样品放置到翻转混匀仪上室温裂解3 h。裂解完成后置于-80℃超低温冰箱中冰冻2 min,然后取出静置等待融化,反复冻融3次使细菌充分裂解,接着将其放到90℃加热10 min,使溶菌酶失活。待冷却后离心,吸取上清液至新的1.5 mLEP管中做好标记,然后将上清液点镀在涂满对数期大肠杆菌的平板上,每个样品重复3次,待吹干后置于37℃恒温培养箱内倒置过夜培养。最后测量抑菌圈的直径,计算标准品的抑菌圈面积,作出标准曲线,将样品的抑菌圈面积代入公式中即可测算出试验样品组的大肠杆菌摄取抗生素的情况。
1.2.61,2-丁二醇辅助妥布霉素、庆大霉素杀灭临床耐药大肠杆菌 在进行预试验时根据不同株临床大肠杆菌的耐药程度选择不同浓度的抗生素,其中210215749、210215826、210305607、210215736、210305638、210409104、210215869这7株菌的妥布霉素、庆大霉素浓度均选择500 μg·mL-1,210829776、210117528、210305622这3株菌的妥布霉素、庆大霉素浓度均选择200 μg·mL-1。以210215749菌株为例,取活化后所得平台期210215749,分别吸取500 μL于4个玻璃摇菌管中,1~2号管分别添加妥布霉素、庆大霉素(500 μg·mL-1),3~4号管在添加上述同等抗生素后,在每管中再添加1,2-丁二醇(50 mmol·L-1),然后放置到摇床(37℃,220 r·min-1)孵育处理5 h,剩余9株菌株均以同样方法进行处理。
1.3 数据处理与分析
试验中的数据统计通过ANOVA算法进行分析,数据来源于3次独立试验。
2 结果与分析
2.1 8种丁醇类化合物与妥布霉素双处理杀灭平台期大肠杆菌效果测试
由图1可知,处理5 h后,8组丁醇类化合物(30 mmol·L-1)单处理与空白对照组在杀菌效果上没有显著性差异。妥布霉素(200 μg·mL-1)单处理与空白对照组相比仅展现了轻微的杀菌作用,杀菌数量在1个数量级以内。而8种丁醇类化合物分别与妥布霉素进行双处理的测试结果中,1,2-丁二醇与妥布霉素双处理的杀菌效果与妥布霉素单处理相比增强了约5个数量级的杀菌效果。可见,在这8种丁醇化合物中,1,2-丁二醇对妥布霉素杀灭大肠杆菌的辅助效果最具潜力,因此选用1,2-丁二醇用于后续研究。

注:“control”表示无添加任何醇类,“-”表示无添加妥布霉素,“+”表示添加妥布霉素
2.2 1,2-丁二醇辅助妥布霉素杀灭平台期大肠杆菌的浓度梯度测试
由图2可知,1,2-丁二醇单处理在0~100 mmol·L-1浓度梯度范围内均无显著杀菌现象。而采用1,2-丁二醇与妥布霉素双处理后,在1,2-丁二醇浓度低至3 mmol·L-1时即出现了辅助妥布霉素杀菌的现象,并且随着1,2-丁二醇浓度越高辅助妥布霉素杀灭大肠杆菌效果越显著,在1,2-丁二醇浓度为10~50 mmol·L-1时辅助妥布霉素杀菌效果出现了较大的跨度,50 mmol·L-1与80 mmol·L-1杀菌效果对比无显著性差异(P>0.05),因此后续研究将1,2-丁二醇浓度定为50 mmol·L-1。

注:NS表示差异不显著(P>0.05);**表示差异极显著(P<0.01)
2.3 1,2-丁二醇辅助杀菌型抗生素杀灭平台期大肠杆菌效果测试
从图3A结果可知,在处理5 h后,1,2-丁二醇辅助妥布霉素、庆大霉素这两种氨基糖苷类抗生素杀灭平台期大肠杆菌效果明显,组间差异极显著(P<0.000 1);而1,2-丁二醇与喹诺酮类抗生素中的氧氟沙星双处理,1,2-丁二醇仅具有一定的辅助杀菌的效果(P<0.05),与环丙沙星的双处理中,1,2-丁二醇在辅助杀菌上的效果通过统计学分析无显著性差异(P>0.05);此外,针对同属于青霉素类抗生素的氨苄青霉素和羧苄青霉素,1,2-丁二醇均无显著性辅助杀菌作用(P>0.05)。可见,在这3类杀菌型抗生素中,1,2-丁二醇辅助氨基糖苷类抗生素的杀菌效果最佳,这可能是由于不同抗生素的杀菌机制、抗生素的分子大小不同导致的。
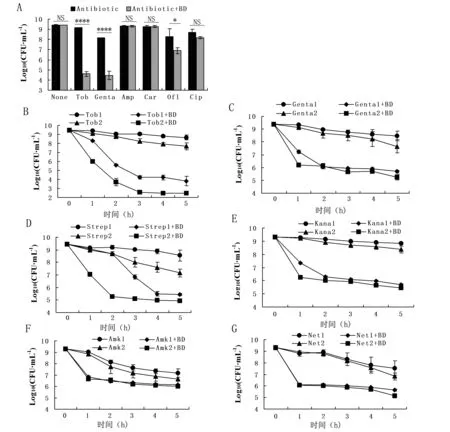
注:A为1,2-丁二醇辅助3类杀菌型抗生素杀灭平台期大肠杆菌效果测试;B-F为1,2-丁二醇辅助6种氨基糖苷类抗生素杀灭平台期大肠杆菌效果测试;Tob1表示妥布霉素浓度为200 μg·mL-1、Tob2表示妥布霉素浓度为500 μg·mL-1;Gen1表示庆大霉素浓度为100 μg·mL-1、Gen2表示庆大霉素浓度为200 μg·mL-1;Strep1表示链霉素浓度为200 μg·mL-1、Strep2表示链霉素浓度为500 μg·mL-1;Kana1表示卡那霉素浓度为1 000 μg·mL-1、Kana2表示卡那霉素浓度为1 500 μg·mL-1;Amk1表示阿米卡星浓度为1 000 μg·mL-1、Amk2表示阿米卡星浓度为1 500 μg·mL-1;Net1表示奈替米星浓度为100 μg·mL-1、Net2表示奈替米星浓度为200 μg·mL-1;NS表示组间没有显著性差异;*表示差异显著(P<0.05);****表示差异极显著(P<0.000 1)
为了验证1,2-丁二醇在辅助氨基糖苷类抗生素作用上是否具有广谱效应,本研究测试了6种氨基糖苷类抗生素与1,2-丁二醇双处理的杀菌效果,分别是妥布霉素、庆大霉素、链霉素、卡那霉素、阿米卡星、奈替米星,且每种抗生素选择2个浓度,并设置0~5 h的时间梯度。由图3B~F可知,1,2-丁二醇对6种氨基糖苷类抗生素均有辅助杀菌作用,且杀菌数量与抗生素浓度、处理时间成正相关。该结果证实1,2-丁二醇对氨基糖苷类抗生素具有广谱辅助杀菌的作用。
2.4 抗生素摄取试验结果
为了探究1,2-丁二醇辅助氨基糖苷类抗生素杀菌是基于何种机制,本研究进一步测试了大肠杆菌胞内抗生素摄取情况。由图4A结果可知,标准品组中的抑菌圈面积与妥布霉素浓度成正比。将样品组抑菌圈面积数值代入到标准曲线公式:y=0.017 9x-0.236 6中,即可获得各样品组大肠杆菌中抗生素的摄取情况,标准曲线、定量结果见图4B、4C,当妥布霉素浓度为200 μg·mL-1时,其单处理的妥布霉素摄取平均值为15.28 μg·mL-1,1,2-丁二醇与妥布霉素双处理的妥布霉素摄取平均值为19.67 μg·mL-1;当妥布霉素浓度为500 μg·mL-1时,其单处理的妥布霉素摄取平均值为23.46 μg·mL-1,1,2-丁二醇与妥布霉素双处理的妥布霉素摄取平均值为31.75 μg·mL-1,1,2-丁二醇和妥布霉素双处理组与妥布霉素单处理组对比,双处理组可以显著提高大肠杆菌细胞中妥布霉素的含量,妥布霉素浓度越高差异越显著。该结果提示1,2-丁二醇可通过增强大肠杆菌对妥布霉素的摄取进而辅助妥布霉素杀菌。

注:A为1,2-丁二醇辅助不同浓度的妥布霉素处理平台期大肠杆菌后形成的抑菌圈;B为抑菌圈标准曲线;C为1,2-丁二醇的添加促进大肠杆菌对妥布霉素的摄取;NS表示差异不显著(P>0.05);**表示差异极显著(P<0.01)
2.5 1,2-丁二醇辅助妥布霉素、庆大霉素杀灭临床耐药大肠杆菌
为了验证1,2-丁二醇在临床耐药方面的应用价值,本研究从福建医科大学第一附属医院获得10株临床上分离的大肠杆菌耐药菌株,其耐药特性见表1。

表1 10株临床耐药大肠杆菌具体信息
由表2可知,在这10株临床分离的耐药大肠杆菌中,与妥布霉素单处理组相比,1,2-丁二醇联合妥布霉素双处理对其中7株的杀灭效果有显著增强,其中1,2-丁二醇对210215749、210305607这两株大肠杆菌的辅助杀灭效果极显著,可提高妥布霉素4个数量级的杀菌效果。但对于210215736、210409104、210215869这3株大肠杆菌无辅助杀菌效果;另外,与庆大霉素单处理组相比,1,2-丁二醇联合庆大霉素双处理对其中4株耐药大肠杆菌的杀灭效果有显著增强。
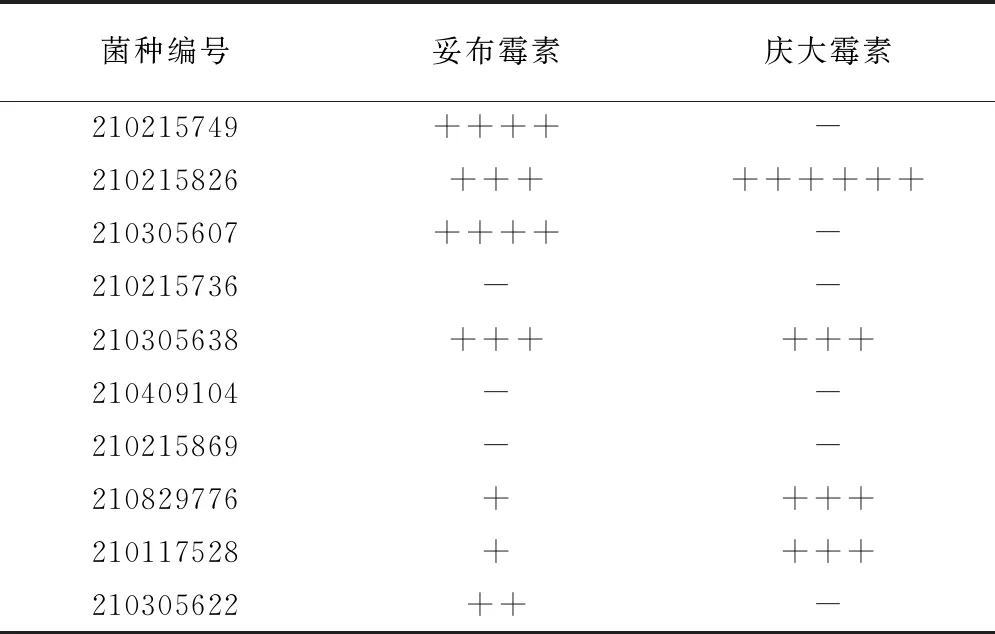
表2 1,2-丁二醇增强妥布霉素、庆大霉素杀灭临床大肠杆菌效果
3 结论与讨论
我国是抗菌药物生产和使用大国。抗生素广泛应用于医疗卫生、农业养殖等领域,在治疗人类感染性疾病、防治动物疫病以及保障公共卫生安全中发挥重要作用。但由于抗生素在医疗卫生领域和动物卫生领域的过度使用或者误用,不仅使抗生素对人体、养殖动物的毒副作用增加,甚至还会致使敏感菌进化成耐药菌[21],尤其是一些多重耐药菌的出现,严重影响抗生素对细菌感染性疾病的治疗成功率[22]。而抗生素新药的研发进度目前已不能满足临床治疗上的需要,寻找其他有效应对耐药细菌的方法策略在临床治疗上已经迫在眉睫。
本研究从8种丁醇中筛选出能够显著有效辅助氨基糖苷类抗生素杀菌效果的1,2-丁二醇,并证实其与妥布霉素、庆大霉素联合应用处理对临床部分耐药大肠杆菌有一定的辅助杀菌作用。抗生素摄取试验结果提示,1,2-丁二醇能够促进大肠杆菌对抗生素的摄取可能是其起到辅助杀菌效果的机制之一。研究结果可为寻找新型有效地增强抗生素杀菌效果的方法提供新的思路,并为有效降低病原菌产生耐药风险提供新的策略。

